Fluorid jodistý
| Fluorid jodistý | |
|---|---|
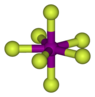 Kuličkovo-tyčinkový model molekuly | |
 Struktura molekuly | |
 Kuličkový model molekuly | |
| Obecné | |
| Systematický název | fluorid jodistý |
| Anglický název | Iodine heptafluoride |
| Německý název | Iodheptafluorid |
| Sumární vzorec | IF7 |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 16921-96-3 |
| PubChem | 85645 |
| SMILES | FI(F)(F)(F)(F)(F)F |
| InChI | InChI=1S/F7I/c1-8(2,3,4,5,6)7 |
| Vlastnosti | |
| Molární hmotnost | 259,90 g/mol |
| Teplota tání | 4,5 °C (trojný bod) |
| Teplota sublimace | 4,8 °C |
| Hustota | 2,6 g/cm3 (6 °C) 2,7 g/cm3 (25 °C) |
| Rozpustnost ve vodě | rozpustný |
| Bezpečnost | |
Některá data mohou pocházet z datové položky. | |
Fluorid jodistý je anorganická sloučenina se vzorcem IF7. Patří mezi halogenidy (dokonce jde o interhalogen, tedy dvouprvkovou sloučeninu obsahující dva různé halogeny) s prvkem v oxidačním čísle VII. Jeho husté páry mají štiplavě plesnivý zápach.
Příprava
[editovat | editovat zdroj]Fluorid jodistý se připravuje přechodem fluoru přes kapalný IF5 při teplotě 90 °C a následným zahříváním par na 270 °C:
IF5 + F2 → IF7.
Většinou se do reakční směsi přidává vysušené palladium nebo jodid draselný pro eliminování vzniku IOF5.[1][2]
Bezpečnost
[editovat | editovat zdroj]Fluorid jodistý je vysoce dráždivý pro kůži a sliznice. Také se jedná o silný oxidant, který může způsobit požár při doteku s organickým materiálem.
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Iodine heptafluoride na anglické Wikipedii.
- ↑ W. C. Schumb, M. A. Lynch, Jr. Iodine Heptafluoride. Industrial & Engineering Chemistry. 1950, s. 1383–1386. DOI 10.1021/ie50487a035.
- ↑ Ruff O., Keim R. "Das Jod-7-fluorid" (The iodine-7-fluoride). Zeitschrift für Anorganische und Allgemeine Chemie. 1930, s. 176–186. DOI 10.1002/zaac.19301930117.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Fluorid jodistý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid jodistý na Wikimedia Commons


