Fluorid wolframový
| Fluorid wolframový | |
|---|---|
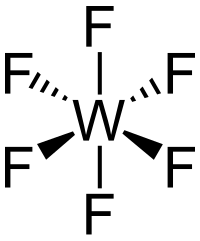 Strukturní vzorec | |
 Kuličkový model | |
| Obecné | |
| Systematický název | Fluorid wolframový |
| Anglický název | Tungsten hexafluoride (Hexafluorotungsten) |
| Německý název | Wolfram(VI)-fluorid |
| Sumární vzorec | WF6 |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 7783-82-6 |
| PubChem | 522684 |
| Vlastnosti | |
| Molární hmotnost | 297,830 g.mol−1 |
| Teplota tání | 2,3 °C (275,4 K) |
| Teplota varu | 17,1 °C (290,2 K) |
| Teplota změny krystalové modifikace | −9 °C |
| Hustota | 12,4 g.dm−3 (plyn) 3,44 g/cm3 (15 °C, kapalný) 4,56 g/cm3 (−9 °C, pevný) |
| Rozpustnost ve vodě | hydrolyzuje |
| Měrný elektrický odpor | 5,6 μΩ·cm |
| Bezpečnost | |
| H-věty | H280, H301+H311, H314, H330 |
| P-věty | P260, P264, P264+265, P270, P271, P280, P284, P301+316, P301+330+331, P302+352, P302+361+354, P304+340, P305+354+338, P316, P317, P320, P321, P330, P361+364, P363, P403+233, P405, P410+403, P501 |
Některá data mohou pocházet z datové položky. | |
Fluorid wolframový, někdy též hexafluorid wolframu, je anorganická sloučenina s chemickým vzorcem WF6 (v angličtině i F6W[1]). Je to toxický, žíravý, bezbarvý plyn s hustotou asi 13 kg/m3 (zhruba 11krát těžší než vzduch).[2][3][4] Je to jeden z nejhustších známých plynů za standardních podmínek.[5][6] WF6 se běžně používá v polovodičovém průmyslu k nanášení wolframových filmů s využitím chemické depozice z plynné fáze. Tato vrstva vytváří vodivé spoje s nízkým odporem.[2] Je to jeden ze sedmnácti známých binárních hexafluoridů.
Vlastnosti
[editovat | editovat zdroj]Molekula WF6 je oktaedrická s grupou symetrií Oh . Délky W–F vazeb jsou 183,2 pm. V rozmezí teplot 2,3 °C až 17 °C je fluorid wolframový bezbarvá kapalina o hustotě 3440 kg/m3 při 15°C.[7][4] Při 2,3 °C tuhne na bílou pevnou látku s krychlovou krystalickou strukturou, mřížkovou konstantou 628 pm a vypočtenou hustotou 3990 kg/m3. Při −9 °C se struktura přemění na kosočtverečnou s mřížkovými konstantami a = 960,3 pm, b = 871,3 pm a c = 504,4 pm a hustotou 4560 kg/m3. V této fázi je vzdálenost W–F 181 pm. Zatímco plynný WF6 je jedním z nejhustších plynů, jehož hustota převyšuje hustotu nejtěžšího elementárního plynu radonu (9,73 g/l), hustota v kapalném a pevném stavu je spíše průměrná.
Tlak par v rozmezí teplot −70 °C a 17 °C lze popsat rovnicí
- log10 P = 4,55569 − 1021,208 ⁄ T + 208.45,
kde P = tlak par (bar), T = teplota (°C).[8][9]
Příprava a výroba
[editovat | editovat zdroj]Fluorid wolframový se obvykle vyrábí exotermickou reakcí plynného fluoru s wolframovým práškem při teplotě mezi 350 °C a 400 °C:[7]
- W + 3 F2 → WF6
Plynný produkt se destilací oddělí od WOF4 (obvyklá nečistota). Ve variantě přímé fluorace se kov umístí do vyhřívaného reaktoru, mírně natlakovaného na 8 až 14 kPa a protékaného konstantním proudem WF6 s malým podílem plynného fluoru.
Plynný fluor ve výše uvedené metodě může být nahrazen ClF, ClF3 nebo BrF3. Alternativním postupem výroby fluoridu wolframového je reakce oxidu wolframového (WO3) s HF, BrF3, popř. SF4. Fluorid wolframový lze také získat konverzí chloridu wolframového pomocí HF, AsF3 nebo SbF5 [5]
- WCl6 + 6 HF → WF6 + 6 HCl nebo
- WCl6 + 2 AsF3 → WF6 + 2 AsCl3 nebo
- WCl6 + 3 SbF5 → WF6 + 3 SbF3Cl2
Reakce
[editovat | editovat zdroj]Ve styku s vodou nebo vodní parou vzniká fluorovodík (HF) a fluoridy-oxidy wolframu, případně až oxid wolframový:[5]
- WF6 + H2O → WOF4 + 2 HF
- WF6 + 2 H2O → WO2F2 + 4 HF
- WF6 + 3 H2O → WO3 + 6 HF
Na rozdíl od některých jiných fluoridů kovů, WF6 není dobrým fluoračním činidlem ani silným oxidantem. WF6 lze zredukovat na fluorid wolframičitý (WF4).[10]
Aplikace v polovodičovém průmyslu
[editovat | editovat zdroj]Nejrozšířenější použití fluoridu wolframového je v polovodičovém průmyslu, kde se používá pro nanášení kovového wolframu pomocí chemické depozice z plynné fáze . V souvislosti s rozvojem polovodičového průmyslu v 80. a 90. letech 20. století vzrostla spotřeba fluoridu wolframového na úroveň kolem 200 tun ročně.[5] V roce 2020 dosáhla spotřeba 4620 tun ročně s trvale rostoucí tendencí.[11]
Kovový wolfram je ve výrobě polovodičů atraktivní díky své relativně vysoké tepelné a chemické stabilitě, nízkému měrnému odporu (5,6 μΩ·cm) a velmi nízké elektromigraci. Výhodou WF6 oproti příbuzným sloučeninám jako WCl6 nebo WBr6 je vyšší tlak par a tedy vyšší rychlosti depozice. Byly vyvinuty dva způsoby depozice: tepelný rozklad a redukce vodíkem. Požadovaná čistota plynu je poměrně vysoká, v závislosti na aplikaci se pohybuje mezi 99,98 % a 99,9995 %.[5]
Jiné aplikace
[editovat | editovat zdroj]Mimo polovodičový průmysl je fluorid wolframový používán k výrobě karbidu wolframu metodou chemické depozice z plynné fáze.[12]
Jako těžký plyn lze fluorid wolframový použít jako pufr pro řízení reakcí plynů. Například zpomaluje rychlost chemické reakce Ar/H2/O2 plamene, což vede ke snížení teploty plamene. [13]
Bezpečnost
[editovat | editovat zdroj]Fluorid wolframový je extrémně žíravý, protože reaguje s vlhkostí v organických materiálech za vzniku kyseliny fluorovodíkové. Zásobní nádoby musí mít teflonová těsnění.[14]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Tungsten hexafluoride na anglické Wikipedii.
- ↑ Tungsten hexafluoride. PubChem [online]. National Library of Medicine [cit. 2023-12-02]. Dostupné online. (anglicky)
- ↑ a b ROUCAN, Jean-Pierre. Proprietes Physiques des Composes Mineraux. [s.l.]: Ed. Techniques Ingénieur (Techniques Ingénieur). Dostupné online. S. 138. (francouzsky)
- ↑ Tabulka vlastností plynů (Wayback Machine archive 7 September 2022)
- ↑ a b TRENTO, Chin. MSDS of Tungsten Hexafluoride. www.samaterials.com [online]. Stanford Advanced Materials [cit. 2023-12-01]. Dostupné online. (anglicky)
- ↑ a b c d e LASSNER, Erik; SCHUBERT, Wolf-Dieter. Tungsten: Properties, Chemistry, Technology of the Elements, Alloys, and Chemical Compounds. [s.l.]: Springer Science & Business Media, 1999. 422 s. Dostupné online. ISBN 0306450534. DOI 10.1007/978-1-4615-4907-9. (anglicky)
- ↑ THE HEAVIEST GAS IN THE WORLD. Tungsten Hexafluoride. WF6. YouTube [online]. 30. 11. 2023 [cit. 2023-12-01]. Dostupné online. (anglicky)
- ↑ a b PRIEST, Homer F.; SWINEHERT, Carl F. Inorganic Syntheses [online]. Wiley, 1950 [cit. 2023-12-01]. Kapitola Anhydrous Metal Fluorides, s. 171–183. Dostupné online. DOI 10.1002/9780470132340.ch47.
- ↑ CADY, George H.; HARGREAVES, George B. Vapour Pressures of Some Fluorides And Oxyfluorides of Molybdenum, Tungsten, Rhenium, and Osmium. S. 1568–1574. Journal of Chemical Society [online]. The Royal Society of Chemistry [cit. 2023-12-01]. Roč. 1961, s. 1568–1574. Dostupné online. DOI 10.1039/JR9610001568. (anglicky)
- ↑ Tungsten hexafluoride. NIST WebBook Chemie, SRD 69 [online]. NIST [cit. 2023-12-01]. Dostupné online. (anglicky)
- ↑ GREENWOOD, N. N.; EARNSHAW, A. Chemistry of the Elements. 2.. vyd. Oxford: Butterworth-Heinemann ISBN 0-7506-3365-4. (anglicky)
- ↑ Global Tungsten Hexafluoride Market Analysis. pmarketresearch.com [online]. PW Consulting Agency [cit. 2023-12-01]. Dostupné online. (anglicky)
- ↑ PIERSON, Hugh O. Chemical Vapor Deposition (CVD): Principles, Technology, and Applications. 1.. vyd. [s.l.]: Elsevier, 1999. Dostupné online. ISBN 9780815513001, ISBN 9781437744880. (anglicky)
- ↑ IFEACHO, Pascal. Semi-conducting metal oxide nanoparticles from a low-pressure premixed H2/O2/Ar flame: Synthesis and Characterization. [s.l.]: Cuvillier Verlag, 2008. Dostupné online. ISBN 978-3-86727-816-4.
- ↑ Tungsten hexafluoride MSDS [online]. Linde Gas. Dostupné v archivu pořízeném z originálu dne 2010-02-12.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Fluorid wolframový na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid wolframový na Wikimedia Commons


