Komplexy přechodných kovů s didusíkem


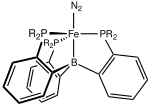
Komplexy přechodných kovů s didusíkem jsou komplexní sloučeniny obsahující vazby mezi atomy přechodných kovů a molekulami didusíku, které jsou zde ligandy.[2]
Historie
[editovat | editovat zdroj]Komplexy přechodných kovů a N2 jsou zkoumány od roku 1965, kdy byla popsána první taková sloučenina,[3] diamagnetický komplex [Ru(NH3)5(N2)]2+, připravený z hydrátu hydrazinu reakcí s chloridem ruthenitým. [Ru(NH3)5]2+ centrum tohoto komplexu je navázáno na jeden konec molekuly N2.[4][5] Existence N2 ligandu byla potvrzena infračervenou spektroskopií, kde se objevil výrazný pás kolem 2170–2100 cm−1.[4] V roce 1966 byla pomocí rentgenové krystalografie určena struktura [Ru(NH3)5(N2)]Cl2.[6]
Sloučenina trans-[IrCl(N2)(PPh3)2] se připravuje reakcí Vaskova komplexu s aromatickým acylazidy. Jeho molekulová geometrie je rovinná.[7]
První příprava didusíkového komplexu pomocí molekulárního dusíku byla provedena v roce 1967; šlo o [Co(H)(N2)(PPh3)3], získaný redukcí Co(acac)3 pomocí AlEt2OEt v dusíkové atmosféře. Protože obsahuje hydrido- i N2 ligandy, tak má tento komplex možné využití při fixaci dusíku.[8]
Od konce 60. let 20. století byly připraveny didusíkové komplexy železa,[9] molybdenu[10] a vanadu.[11]
Výzkum těchto komplexních sloučenin se rozvíjí z těch důvodů, že N2 tvoří většinu atmosféry Země a že dusík je obsažen v mnoha významných sloučeninách. Biologická fixace dusíku probíhá pravděpodobně skrze navazování N2 na kovová centra nitrogenázových enzymů, po kterých následuje několik dalších kroků, jako jsou přenos elektronů a protonace.[12]
Vazby
[editovat | editovat zdroj]Vazby v komplexech N2 jsou podobné jako u komplexů CO a acetylenu, protože všechny tyto molekuly obsahují trojné vazby; bylo nalezeno několik variant těchto vazeb. V závislosti na tom, zda molekuly N2 jsou nebo nejsou sdíleny dalšími dvěma kovovými centry, lze komplexy rozdělit na jednojaderné a můstkové. Podle geometrie mezi molekulami N2 a kovem se dají dělit na dvě skupiny, kde jedna má vektor N-N rovnoběžný s vazbami kov-ligand, zatímco u druhé je na ně kolmý.[13]
Jednojaderné s rovnoběžným vektorem N-N
[editovat | editovat zdroj]Jako ligand se N2 obvykle na kovy, například v [Ru(NH3)5N2]2+, váže tak, že vektor N-N je rovnoběžný se směrem kov-ligand. Takové komplexy jsou často analogy karbonylů. Podobnost lze ukázat na Vaskově komplexu (IrCl(CO)(PPh3)2) a IrCl(N2)(PPh3)2.[14]
N2 u těchto komplexů funguje jako σ-donor i π-akceptor. Úhly vazeb M-N-N bývají blízko 180°.[2] N2 je slabším π-akceptorem než CO, což je způsobeno vlastnostmi π* orbitalů CO a N2. Z tohoto důvodu je znám jen malý počet sloučenin majících současně CO i N2 ligandy.
Komplexy přechodných kovů mohou obsahovat více didusíkových ligandů tohoto typu, jedním z takových je mer-[Mo(N2)3(PPrn2Ph)3], mající oktaedrickou geometrii.[15]
Didusíkový ligand u Mo(N2)2(Ph2PCH2CH2PPh2)2 je možné redukovat za vzniku amoniaku.[16] Řada nitrogenáz obsahuje atomy Mo a tak jsou častými předměty výzkumu Mo-N2 komplexy.
Můstkové s rovnoběžným vektorem N-N
[editovat | editovat zdroj]N2 může také propojovat dva atomy kovu, například ve sloučenině {[Ru(NH3)5]2(μ-N2)}4+; tato a podobné koordinační sloučeniny se často označují jako vícejaderné komplexy didusíku. Na rozdíl od jednojaderných protějšků je lze připravit s rannými i pozdními přechodnými kovy.[2]
V roce 2006 byla vydána studie Fe-N2 komplexů ukazující, že vazby N–N jsou po komplexaci s atomy železa s nižšími koordinačními čísly významně zeslabené. Zkoumaný komplex obsahoval bidentátní chelatující ligandy napojené na atomy železa v Fe–N–N–Fe jádru, kde N2 tvoří můstek mezi dvojicí atomů železa. Navýšení koordinačního čísla železa úpravou chelatujících ligandů a přidáním jednoho ligandu na každý atom železa vedlo ke zvýšení síly vazeb N–N. Fe s nízkými koordinačními čísly má velký význam při fixaci dusíku nitrogenázami, protože jejich Fe–Mo kofaktory také obsahují Fe s nízkými koordinačními čísly.[17]
Průměrná délka vazeb těchto komplexů je okolo 120 pm., někdy však může činit až 140 pm, což je hodnota podobná běžným jednoduchým vazbám N-N.[18]
Jednojaderné s kolmým vektorem N-N
[editovat | editovat zdroj]Tako skupina komplexů se oproti těm s rovnoběžnými vektory N-N vyznačuje vyšší energií a také je vzácnější. Didusík je zde π-donorem. Byl připraven komplex tohoto druhu s N2 navázaným na jedno kovové centrum ve fotoindukovaném metastabilním stavu. Po vystavení ultrafialovému záření lze komplex [Os(NH3)5(N2)]2+, v pevném skupenství převést na metastabilní [Os(NH3)5(η2-N2)]2+, u kterého jsou vibrace didusíku posunuty z 2025 na 1831 cm−1.
Několik dalších takových komplexů existuje v podobě přechodných stavů při vnitromolekulárních izomerizacích. John N. Armor a Henry Taube objevili tyto izomerizace prostřednictvím didusíkových ligandů značkovaných 15N.[19]
Můstkové s kolmým vektorem N-N
[editovat | editovat zdroj]Jsou také známé můstkové komplexy, ve kterých je vektor N-N kolmý na vektor kov-ligand, například [(η5-C5Me4H)2Zr]2(μ2,η2,η2-N2).[20] Tento komplex může reagovat s vodíkem a lze s ním dosáhnou fixace dusíku redukcí N2;[21] ten lze redukovat také obdobným ditantalovým tetrahydridovým komplexem.[22]
Reakce
[editovat | editovat zdroj]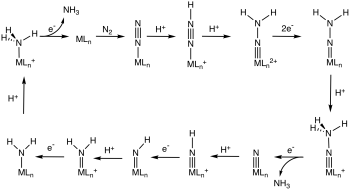
Štěpení na nitridy
[editovat | editovat zdroj]Tvorba nitridokomplexů z dusíku probíhá přes didusíkové komplexy. Štěpit dusík mohou i některé molybdenité komplexy:[23]
- 2 Mo(NR2)3 + N2 → (R2N)3Mo-N2-Mo(NR2)3
- (R2N)3Mo-N2-Mo(NR2)3 → 2 N≡Mo(NR2)3
Elektrofilní ataky
[editovat | editovat zdroj]Některé didusíkové komplexy bohaté na elektrony mohou být, na atomech dusíku, atakovány elektrofily. Reakce, kde je elektrofilem proton, se zkoumají pro možné využití k nebiologické fixaci dusíku.
Některé komplexy N2 jsou dokonce schopny katalyzovat jeho hydrogenaci na amoniak skrz N-protonaci redukovaného komplexu M-N2.[24][25]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Transition metal dinitrogen complex na anglické Wikipedii.
- ↑ Matthew J. Chalkley; Marcus W. Drover; Jonas C. Peters. Catalytic N2-to-NH3 (or -N2H4) Conversion by Well-Defined Molecular Coordination Complexes. Chemical Reviews. 2020, s. 5582–5636. doi:10.1021/acs.chemrev.9b00638.
- ↑ a b c d Transition Metal-Dinitrogen Complexes: Preparation and Reactivity. [s.l.]: =Wiley-VCH, 2019. ISBN 978-3-527-34425-3.
- ↑ Caesar V. Senoff. The discovery of [Ru(NH3)5N2]2+: A Case of Serendipity and the Scientific Method. Journal of Chemical Education. 1990, s. 368. doi:10.1021/ed067p368. Bibcode 1990JChEd..67..368S.
- ↑ a b A. D. Allen; C. V. Senoff. Nitrogenopentammineruthenium(II) complexes. Journal of the Chemical Society, Chemical Communications. 1965, s. 621. doi:10.1021/ed067p368. Bibcode 1990JChEd..67..368S.
- ↑ Michael D. Fryzuk. N2 Coordination. Chemical Communications. 2013, s. 4866–4868. doi:10.1039/C3CC42001A. PMID 23609888.
- ↑ F. Bottomley; S. C. Nyburg. Molecular nitrogen as a ligand. The crystal structure of nitrogenpentaammineruthenium(II) dichloride and related salts. Acta Crystallographica Section B. 1968-10-15, s. 1289–1293. ISSN 0567-7408. doi:10.1107/S056774086800419X.
- ↑ James P. Collman; Mitsuru Kubota; Frederick D. Vastine; Jui Yuan Sun; Jung W. Kang. Iridium complexes of molecular nitrogen. Journal of the American Chemical Society. 1968, s. 5430–5437. ISSN 0002-7863. doi:10.1021/ja01022a018.
- ↑ Akio Yamamoto; Shoji Kitazume; Lyong Sun Pu; Sakuji Ikeda. Synthesis and properties of hydridodinitrogentris(triphenylphosphine)cobalt(I) and the related phosphine-cobalt complexes. Journal of the American Chemical Society. 1971, s. 371–380. ISSN 0002-7863. doi:10.1021/ja00731a012.
- ↑ M. Aresta; P. Giannoccaro; M. Rossi; A. Sacco. Nitrogen fixation.: II. Dinitrogen-complexes of irons. Inorganica Chimica Acta. 1971-03-01, s. 203–206. ISSN 0020-1693. doi:10.1016/S0020-1693(00)95914-0.
- ↑ M. Hidai; K. Tominari; Y. Uchida; A. Misono. A molybdenum complex containing molecular nitrogen. Journal of the Chemical Society D: Chemical Communications. 1969, s. 814. ISSN 0577-6171. doi:10.1039/c29690000814.
- ↑ Jae-Inh Song; Sandro Gambarotta. Preparation, Characterization, and Reactivity of a Diamagnetic Vanadium Nitride. Chemistry - A European Journal. 1996, s. 1258–1263. ISSN 0947-6539. doi:10.1002/chem.19960021012.
- ↑ Jiapeng Li; Jianhao Yin; Chao Yu; Wenxiong Zhang; Zhenfeng Xi. Direct Transformation of N2 to N-Containing Organic Compounds. Acta Chimica Sinica. 2017, s. 733. ISSN 0567-7351. doi:10.6023/a17040170.
- ↑ Michael D. Fryzuk. Side-on End-on Bound Dinitrogen: An Activated Bonding Mode That Facilitates Functionalizing Molecular Nitrogen. Accounts of Chemical Research. 2009-01-20, s. 127–133. ISSN 0001-4842. doi:10.1021/ar800061g. PMID 18803409.
- ↑ J. P. Collman; N. W. Hoffman; J. W. Hosking. trans-Chloro(nitrogen)bis(triphenylphosphine)iridium (I). Inorganic Syntheses. 2000, s. 8–11. ISBN 978-0-470-13171-8. doi:10.1002/9780470132432.ch2.
- ↑ S. N. Anderson; D. L. Hughes; R. L. Richards. A tris-dinitrogen complex. Preparation and crystal structure of mer-[Mo(N2)3(PPrn2Ph)3]. Journal of the Chemical Society, Chemical Communications. 1984, s. 958–959. doi:10.1039/C39840000958.
- ↑ Modern Coordination Chemistry: The Legacy of Joseph Chatt" G. J. Leigh, N. W. Winterton Springer Verlag (2002). ISBN 0-85404-469-8
- ↑ Jeremy M. Smith, Azwana R. Sadique, Thomas R. Cundari, Kenton R. Rodgers, Gudrun Lukat-Rodgers, Rene J. Lachicotte, Christine J. Flaschenriem, Javier Vela, Patrick L. Holland. Studies of Low-Coordinate Iron Dinitrogen Complexes. Journal of the American Chemical Society. 2006, s. 756–769. [url=https://digital.library.unt.edu/ark:/67531/metadc77137/ Dostupné online]. ISSN 0002-7863. doi:10.1021/ja052707x. PMID 16417365.
- ↑ Michael D. Fryzuk; T. S. Haddad; Murugesapillai Mylvaganam; David H. McConville; Steven J. Rettig. End-on versus side-on bonding of dinitrogen to dinuclear early transition-metal complexes. Journal of the American Chemical Society. 1993-04-01, s. 2782–2792. ISSN 0002-7863. doi:10.1021/ja00060a028.
- ↑ John N. Armor; Henry Taube. Linkage isomerization in nitrogen-labeled [Ru(NH3)5N2]Br2. Journal of the American Chemical Society. 1970, s. 2560–2562. ISSN 0002-7863. doi:10.1021/ja00711a066.
- ↑ W. H. Bernskoetter; E. Lobkovsky; P. J. Chirik. Kinetics and Mechanism of N2 Hydrogenation in Bis(cyclopentadienyl) Zirconium Complexes and Dinitrogen Functionalization by 1,2-Addition of a Saturated C-H Bond. Journal of the American Chemical Society. 2005, s. 14051-14061. doi:10.1021/ja0538841. PMID 16201827.
- ↑ Jaime A. Pool; Emil Lobkovsky; Paul J. Chirik. Hydrogenation and cleavage of dinitrogen to ammonia with a zirconium complex. Nature. 2004, s. 527–530. doi:10.1038/nature02274. PMID 14765191. Bibcode 2004Natur.427..527P.
- ↑ Michael D. Fryzuk. Side-on End-on Bound Dinitrogen: An Activated Bonding Mode That Facilitates Functionalizing Molecular Nitrogen. Accounts of Chemical Research. 2008-09-20, s. 127–133. doi:10.1021/ar800061g. PMID 18803409.
- ↑ Michael D. Fryzuk, Catalina E. Laplaza, Marc J. A. Johnson, Jonas C. Peters, Aaron L. Odom, Esther Kim, Christopher C. Cummins, Graham N. George, Ingrid J. Pickering. Dinitrogen Cleavage by Three-Coordinate Molybdenum(III) Complexes: Mechanistic and Structural Data 1. Journal of the American Chemical Society. 1996, s. 8623–8638. doi:10.1021/ja960574x.
- ↑ Dmitry V. Yandulov; Richard R. Schrock. Catalytic Reduction of Dinitrogen to Ammonia at a Single Molybdenum Center. Science. 2003-07-04, s. 76–78. ISSN 0036-8075. doi:10.1126/science.1085326. PMID 12843387. Bibcode 2003Sci...301...76Y.
- ↑ Kazuya Arashiba; Yoshihiro Miyake; Yoshiaki Nishibayashi. A molybdenum complex bearing PNP-type pincer ligands leads to the catalytic reduction of dinitrogen into ammonia. Nature Chemistry. 2011, s. 120–125. doi:10.1038/nchem.906. PMID 21258384. Bibcode 2011NatCh...3..120A.