Octan rtuťnatý
| Octan rtuťnatý | |
|---|---|
 Strukturní vzorec | |
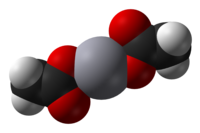 Model molekuly | |
| Obecné | |
| Systematický název | octan rtuťnatý |
| Funkční vzorec | (CH3COO)2Hg |
| Sumární vzorec | C4H6O4Hg |
| Vzhled | bílé krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 1600-27-7 |
| EC-no (EINECS/ELINCS/NLP) | 209-766-2 |
| PubChem | 15337 |
| ChEBI | 33211 |
| SMILES | [Hg+2].[O-]C(=O)C.[O-]C(=O)C |
| InChI | InChI=1S/2C2H4O2.Hg/c2*1-2(3)4;/h2*1H3,(H,3,4);/q;;+2/p-2 |
| Číslo RTECS | AI8575000 |
| Vlastnosti | |
| Molární hmotnost | 318,68 g/mol |
| Teplota tání | 178 až 180 °C (451 až 453 K)[1] |
| Teplota varu | rozkládá se[1] |
| Hustota | 3,27 g/cm3[1] |
| Rozpustnost ve vodě | 25 g/100 ml (10 °C) 100 g/100 ml (100 °C) |
| Rozpustnost v polárních rozpouštědlech | rozpustný v ethanolu |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v diethyletheru |
| Bezpečnost | |
| [1] | |
| H-věty | H300 H310 H330 H373 H400 H410}[1] |
| P-věty | P260 P262 P264 P270 P271 P273 P280 P284 P301+310 P302+350 P304+340 P310 P314 P320 P321 P322 P330 P361 P363 P391 P403+233 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Octan rtuťnatý je organická sloučenina se vzorcem Hg(O2CCH3)2, zkráceně Hg(OAc)2. Používá se na přípravu organických sloučenin rtuti z nenasycených organických prekurzorů.
Struktura
[editovat | editovat zdroj]Octan rtuťnatý je krystalická pevná látka skládající se z jednotlivých molekul Hg(OAc)2, ve kterých mají vazby Hg-O délku 207 pm. Strukturu vytvářejí také tři slabé mezimolekulové vazby Hg···O o délkách kolem 275 pm, což vede k mírně narušené čtvercově pyramidální koordinační geometrii na Hg centru.[2]
Reakce
[editovat | editovat zdroj]Na areny lze navázat rtuť reakcí s Hg(OAc)2. Jedna octanová skupina (OAc) zůstává navázána na rtuť, lze ji ovšem snadno odstranit reakcí s chloridem:[3]
- C6H5OH + Hg(OAc)2 → C6H4(OH)-2-HgOAc + HOAc
- C6H4(OH)-2-HgOAc + NaCl → C6H4(OH)-2-HgCl + NaOAc
Rtuťnatá centra se mohou vázat na alkeny a tím indukovat adice hydroxidů a alkoxidů; například reakcí methylakrylátu s octanem rtuťnatým v methanolu vzniká α-merkuriester:[4]
- Hg(OAc)2 + CH2=CHCO2CH3 + CH3OH → CH3OCH2CH(HgOAc)CO2CH3 + HOAc
Díky vysoké afinitě rtuťnatých sloučenin k sirným ligandům může být Hg(OAc)2 použit k odstranění thiolových chránicích skupin v organické syntéze a k přeměně thiokarbonátových esterů na dithiokarbonáty:
- (RS)2C=S + H2O + Hg(OAc)2 → (RS)2C=O + HgS + 2 HOAc
Octan rtuťnatý může rovněž být použit k oxymerkuračním reakcím.
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Mercury(II) acetate na anglické Wikipedii.
- ↑ a b c d e f g https://pubchem.ncbi.nlm.nih.gov/compound/15337
- ↑ R. Allmann. Die Struktur des Quecksilber(II)-acetats. Zeitschrift für Kristallographie - Crystalline Materials. 1973, s. 366–373. DOI 10.1524/zkri.1973.138.jg.366.
- ↑ F. C. Whitmore; E. R. Hanson. o-chloromercuriphenol. Organic Syntheses. 1925, s. 13. DOI 10.15227/orgsyn.004.0013.
- ↑ Dl-SERINE. Organic Syntheses. 1940, s. 81. DOI 10.15227/orgsyn.020.0081.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Octan rtuťnatý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Octan rtuťnatý na Wikimedia Commons


