Peroxid vodíku
| Peroxid vodíku | |
|---|---|
 | |
 | |
 | |
| Obecné | |
| Systematický název | dihydrogen dioxid |
| Triviální název | peroxid vodíku |
| Ostatní názvy | hydrogen peroxid, perhydrol, kysličník, dioxidan |
| Latinský název | hydrogenium peroxydatum, hydrogenii peroxidum |
| Anglický název | Hydrogen peroxide |
| Německý název | Wasserstoffperoxid |
| Funkční vzorec | HOOH |
| Sumární vzorec | H2O2 |
| Vzhled | namodralá kapalina (v roztoku bezbarvá) |
| Identifikace | |
| Registrační číslo CAS | 7722-84-1 |
| EC-no (EINECS/ELINCS/NLP) | 231-765-0 |
| PubChem | 784 |
| UN kód | 2015 (rozt. nad 60 %) 2014 (rozt. 20–60 %) 2984 (rozt. 8–20 %) |
| Číslo RTECS | MX0900000 (rozt. nad 90 %) MX0887000 (rozt. nad 30%) |
| Vlastnosti | |
| Molární hmotnost | 34,0147 g/mol |
| Teplota tání | −0,43 °C |
| Teplota varu | 150,2 °C |
| Hustota | 1,463 g/cm³ |
| Dynamický viskozitní koeficient | 1,245 cP (20 °C) |
| Index lomu | 1,34 |
| Disociační konstanta pKa | 11,62[1] |
| Rozpustnost ve vodě | neomezeně mísitelný |
| Struktura | |
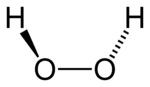
| Tvar molekuly | kovalentní vazby, speciální: tvar složeného papíru do úhlu 97° |
| Dipólový moment | 2.26 D |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −4,007 kJ/g |
| Měrné teplo | 1,267 J/g K (plyn) 2,619 J/g K (kapalina) |
| Bezpečnost | |
| [2] Nebezpečí[2] | |
| H-věty | H271 H332 H302 H314 |
| R-věty | R5 R8 R20/22 R35 |
| S-věty | (S1/2) S17 S26 S28 S36/37/39 S45 |
| NFPA 704 |  0
3
1
OX
|
Některá data mohou pocházet z datové položky. | |

Peroxid vodíku (chemický vzorec H2O2) (triviálně, zastarale kysličník) je čirá namodralá kapalina o něco viskóznější než voda. Má silné oxidační, ale i redukční vlastnosti a často se používá jako dezinfekce (3% vodný roztok). Rovněž se často využívají jeho bělicí účinky při odbarvování vlasů, v ponorkách je částí pohonného média torpéd. Během druhé světové války byl používán jako raketové palivo ať už samostatně jako jednosložkové palivo, tj. katalytickým rozkladem na paroplyn (nejznámější motory Hellmutha Waltera, popřípadě z pozdější doby „raketový pás – rocket belt“ z bondovek), nebo ve spojení s ethanolem (lihem), hydrazinem nebo petrolejem (kerosenem). Při použití s hydrazinhydrátem má samozápalné účinky – tj. při smísení obou látek dojde k okamžitému samovznícení.[zdroj?]
Po válce se od použití peroxidu jako okysličovadla až na pár výjimek (Black Arrow) ustoupilo a místo toho se používá oxid dusičitý, který je ovšem prudce jedovatý. Naproti tomu katalytický rozklad peroxidu na paroplyn se jako pomocný zdroj v raketové technice používá od A4 (známější jako V-2) až po RD 107/108, což jsou hlavní motory prvního a druhého stupně ruské rakety R-7, v současnosti známé ve své nejvýkonnější verzi jako Sojuz U.
V současnosti se uvažuje o návratu k peroxidu především z ekologických důvodů.
Peroxid vodíku je silnější kyselina než voda,[3] poskytuje soli hydrogenperoxidy (HO2)− a peroxidy (O2)2−
Příprava
[editovat | editovat zdroj]Poprvé byl peroxid vodíku připraven v roce 1818 L. J. Thénardem reakcí kyseliny sírové s peroxidem barnatým a odpařením nadbytečné vody za sníženého tlaku dle rovnice:
BaO2 + H2SO4 → H2O2 + BaSO4
Nejdůležitější z peroxidů a výchozí složkou výše uvedené reakce je BaO2, vznikající při zahřívání BaO v kyslíkové atmosféře.
Dalším způsobem přípravy je spalování kovového sodíku za vzniku peroxidu sodného, který se následně hydrolyzuje na peroxid vodíku a hydroxid sodný:
Na2O2 + 2 H2O → 2 NaOH + H2O2
Výroba
[editovat | editovat zdroj]Na 2-alkylantrachinon se působí vodíkem v přítomnosti katalyzátoru za vzniku 2-alkylantrachinolu. Zaváděním vzduchu se uvolňuje peroxid vodíku a zpět vzniká výchozí látka.
Reakce
[editovat | editovat zdroj]Rozklad: 2H2O2 → 2H2O + O2
Rozklad zpomaluje např. močovina, kyselina fosforečná; naopak jej urychluje oxid manganičitý, manganistan draselný, jodid draselný, stříbro nebo platina.
Reakcí s acetonem vzniká třaskavá sloučenina s názvem peroxoaceton.
Přeměna na disulfan: H2O2 + 2 H2S → H2S2 + 2 H2O
Použití v medicíně
[editovat | editovat zdroj]Peroxid vodíku je podle FDA (v USA) všeobecně považován za bezpečný (GRAS) jakožto antimikrobiální činidlo, oxidační činidlo a pro jiné účely schválené FDA.[3]
Peroxid vodíku se díky svému oxidačnímu účinku používá po řadu let jako antiseptikum a dezinficiens. Přestože s růstem popularity jiných snadno dostupných prostředků OTC (prodej bez předpisu) využívání peroxidu vodíku pokleslo, stále ho používá mnoho nemocnic, lékařů a stomatologů.
- Jako mnoho jiných oxidačních antiseptik, peroxid vodíku mírně poškozuje tkáň otevřených ran, je však účinný při rychlém zastavení kapilárního krvácení (pomalé krvácení z malých cév při odřeninách), a někdy se proto šetrně používá k tomuto účelu nebo k čištění.
- Peroxid vodíku lze použít jako pastu na zuby, smísí-li se s odpovídajícím množstvím jedlé sody (hydrogenuhličitanu sodného) a soli.[4]
- Peroxid vodíku a benzoylperoxid se někdy používají pro léčbu akné.[5]
- Ve veterinární praxi se peroxid vodíku používá jako emetikum.[6]
- Používá se také pro výrobu dezinfekčních gelů na ruce
Bezpečnost
[editovat | editovat zdroj]Právní regulace dostupnosti peroxidu vodíku je různá, nicméně v nízkých koncentracích (např. 3 %) bývá běžně dostupný a legálně prodávaný pro lékařské použití. Většina volně prodejných roztoků není vhodná pro použití. Vyšší koncentrace mohou být považovány za nebezpečné a při prodeji musí být k dispozici bezpečnostní list. Ve vysokých koncentracích je peroxid vodíku agresivní oxidant a poškozuje mnoho materiálů včetně lidské kůže. Za přítomnosti redukčního činidla probíhá rozklad koncentrovaného H2O2 velmi bouřlivě.
Koncentrovaný peroxid vodíku (obvykle nad 40 %) je v USA považován za nebezpečný odpad kategorie D001, protože naplňuje definici nebezpečného oxidantu podle specifikace ministerstva dopravy. Povinnému hlášení EPA podléhá množství od 100 liber (asi 45 kg), tj. přibližně 10 amerických galonů koncentrovaného peroxidu vodíku. V Česku není peroxid vodíku považován za odpad, který podléhá povinnému hlášení do Integrovaného registru znečišťování.[7]
Peroxid vodíku by se měl skladovat na chladném, suchém, dobře větraném místě, bez přítomnosti hořlavých nebo zápalných látek.[8] Měl by být uložen v nádobě z nereaktivních materiálů, například korozivzdorné oceli nebo skla (mohou být vhodné i jiné materiály, například plasty nebo hliníkové slitiny).[9] Vzhledem k rychlému rozkladu při expozici světlu by měl být peroxid vodíku uchováván v neprůhledné nádobě; farmaceuticky připravené roztoky často bývají v tmavě hnědých lahvích.[10]
Peroxid vodíku, ať již čistý nebo zředěný, přináší řadu rizik:
- Výbušné páry. Při koncentracích nad 70 % se uvolňují páry, které mohou explodovat při teplotě nad 70 °C za běžného atmosférického tlaku. Destilace peroxidu vodíku za normálního tlaku je proto velmi nebezpečná.
- Nebezpečné reakce. Páry peroxidu vodíku mohou tvořit s uhlovodíky (např. mazivy) výbušniny, které jsou citlivé na dotek. Nebezpečné reakce od vznícení k výbuchu byly hlášeny v případě alkoholů, ketonů, karboxylových kyselin (zvláště octové), aminů a fosforu.
- Samovznícení. Z koncentrovaného peroxidu vodíku, pokud se vylije na oděv či jiné hořlavé materiály, se odpařuje především voda a koncentrace peroxidu proto roste – až do bodu, kdy se materiál sám vznítí.[11][12]
- Žíravost. Koncentrovaný peroxid vodíku (>50 %) je žíravý, i slabé roztoky však mohou podráždit oči, sliznice nebo kůži.[13] Zvlášť nebezpečné je požití, protože rozkladem v žaludku vzniká velké množství plynu (desetinásobek objemu v případě 3% roztoku).
- Bělidlo. Nízké koncentrace peroxidu vodíku (3 % nebo méně) odbarvují mnoho textilií do podoby narůžovělé barvy. Opatrnost je třeba při zacházení s běžnými výrobky, které mohou obsahovat peroxid vodíku, například s čistidly obličeje nebo roztoky pro kontaktní čočky, které mohou snadno kontaminovat různé povrchy.
- Vnitřní potíže. Větší požitá dávka 3% peroxidu vodíku může způsobit „podráždění a zpuchýřování úst (známé jako černý chlupatý jazyk), krku a břišních orgánů“, stejně jako „bolest břicha, zvracení a průjem“.[14]
- Tlak par. Peroxid vodíku má významný tlak par (1,2 kPa při 50 °C[15]) a expozice těmto parám je potenciálně nebezpečná. Páry jsou především dráždivé, dráždí hlavně oči a dýchací systém. IDLH limit podle NIOSH je pouhých 75 ppm.[16] Také dlouhodobá expozice nízkým koncentracím par je nebezpečná a může vést k trvalému poškození plic. Limit OSHA je 1 ppm pro osmihodinovou váženou expozici (29 CFR 1910.1000, Tabulka Z-1). Peroxid vodíku byl ACGIH klasifikován jako „známý zvířecí karcinogen, s neznámou relevancí pro člověka“[17]. V aplikacích, kde se používají vysoké koncentrace peroxidu vodíku, je třeba používat vhodné osobní ochranné pomůcky, a pokud dochází ke tvorbě par (např. při sterilizaci parami peroxidu vodíku), zajistit náležitou ventilaci a monitorovat koncentraci par.[18][19]
- Nemoci kůže. Vitiligo je získaná kožní nemoc, která se projevuje ztrátou přirozeného kožního pigmentu a postihuje 0,5–1 % světové populace. Čerstvé studie zjistily, že jedním z charakteristických znaků tohoto onemocnění je zvýšená koncentrace peroxidu vodíku v pokožce i v krvi.[20]
Výskyt v přírodě
[editovat | editovat zdroj]Peroxid vodíku je přirozeným metabolitem aerobních buněk. Přirozeně se vyskytuje v povrchové vodě, v podzemní vodě i v atmosférickém vzduchu. Vzniká působením světla nebo přirozeným katalytickým působením látek obsažených ve vodě. Mořská voda obsahuje 0,5 až 14 μg/l peroxidu vodíku a sladká voda obsahuje 1 až 30 μg/l. Koncentrace ve vzduchu je obvykle 0,4 až 4 μg/m3, ale může se lišit až o několik řádů v závislosti na podmínkách, jako je roční období, nadmořská výška, denní světlo, znečištění a obsah vodní páry. Ve venkovském nočním vzduchu může být koncentrace neměřitelná, tj. nižší než 0,014 μg/m3, naopak v silném fotochemickém smogu může dosahovat až 250 μg/m3.[21]
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Hydrogen peroxide na anglické Wikipedii.
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ a b Hydrogen peroxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ a b Sec. 184.1366 Hydrogen peroxide [online]. U.S. Government Printing Office via GPO Access, 2001-04-01 [cit. 2007-07-07]. Dostupné v archivu pořízeném dne 2007-07-03.
- ↑ SHEPHERD, Steven. Brushing Up on Gum Disease [online]. FDA Consumer [cit. 2007-07-07]. Dostupné online.
- ↑ MILANI, Massimo, Bigardi, Andrea; Zavattarelli, Marco. Efficacy and safety of stabilised hydrogen peroxide cream (Crystacide) in mild-to-moderate acne vulgaris: a randomised, controlled trial versus benzoyl peroxide gel. Current Medical Research and Opinion. 2003, roč. 19, čís. 2, s. 135–138(4). Dostupné v archivu pořízeném dne 2007-10-01. DOI 10.1185/030079902125001523.
- ↑ Drugs to Control or Stimulate Vomiting. [s.l.]: Merck & Co., Inc, 2006. Dostupné online. Archivováno 24. 3. 2016 na Wayback Machine.
- ↑ Informace o látkách ohlašovaných do IRZ. irz.cz [online]. [cit. 2011-07-17]. Dostupné v archivu pořízeném z originálu dne 2011-10-13.
- ↑ Hydrogen Peroxide MSDS. www.bu.edu [online]. [cit. 2011-07-17]. Dostupné v archivu pořízeném dne 2007-12-20.
- ↑ Ozonelab Peroxide compatibility
- ↑ The Many Uses of Hydrogen Peroxide-Truth! Fiction! Unproven! [online]. [cit. 2008-06-30]. Dostupné online.
- ↑ NTSB – Hazardous Materials Incident Brief
- ↑ Armadilloaerospace material tests with HTP. media.armadilloaerospace.com [online]. [cit. 2007-09-28]. Dostupné v archivu pořízeném dne 2007-09-28.
- ↑ For example, see an MSDS for a 3% peroxide solution Archivováno 2. 7. 2011 na Wayback Machine.
- ↑ Hydrogen Peroxide, 3%. 3. Hazards Identification Archivováno 20. 8. 2002 na Wayback Machine. Southeast Fisheries Science Center, daughter agency of NOAA.
- ↑ CRC Handbook of Chemistry and Physics, 76th Ed, 1995–1996
- ↑ Documentation for Immediately Dangerous to Life or Health Concentrations (IDLH): NIOSH National Institute for Occupational Safety and Health] Chemical Listing and Documentation of Revised IDLH Values (as of 3/1/95)]
- ↑ 2008 Threshold Limit Values for Chemical Substances and Physical Agents & Biological Exposure Indices, ACGIH
- ↑ Occupational Safety and Health Guideline for Hydrogen Peroxide. www.osha.gov [online]. [cit. 2011-07-17]. Dostupné v archivu pořízeném dne 2011-06-12.
- ↑ Agency for Toxic Substances and Disease Registry. www.atsdr.cdc.gov [online]. [cit. 2011-07-17]. Dostupné v archivu pořízeném dne 2016-03-03.
- ↑ forschung [online]. Vitiligo.eu.com [cit. 2010-09-05]. Dostupné v archivu pořízeném dne 2011-07-10.
- ↑ Special Report No. 10, Hydrogen Peroxide OEL Criteria Document. Technical report (European Chemical Industry Ecology & Toxicology Centre) [online]. ECETOC (European Chemical Industry Ecology & Toxicology Centre), 1996 [cit. 2023-03-12]. Dostupné online. ISSN 0773-8072-10. (anglicky)
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Peroxid vodíku na Wikimedia Commons
Obrázky, zvuky či videa k tématu Peroxid vodíku na Wikimedia Commons  Slovníkové heslo peroxid vodíku ve Wikislovníku
Slovníkové heslo peroxid vodíku ve Wikislovníku- Peroxid vodíku 3% – příbalový leták
- Bezpečnostní list Archivováno 14. 9. 2022 na Wayback Machine.


