Pyren
| Pyren | |
|---|---|
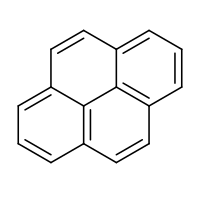 Strukturní vzorec | |
| Obecné | |
| Systematický název | Pyren, benzo[def]fenanthren |
| Sumární vzorec | C16H10 |
| Vzhled | bezbarvá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 129-00-0 |
| Vlastnosti | |
| Molární hmotnost | 202,25 g/mol |
| Teplota tání | 145–148 °C |
| Teplota varu | 404 °C |
| Rozpustnost ve vodě | 0,135 mg/l (ve vodě) |
| Bezpečnost | |
| [1] Varování[1] | |
| R-věty | R36/37/38 R45 R53 |
| S-věty | (S24/25) (S26) (S36) |
Některá data mohou pocházet z datové položky. | |
Pyren je polycyklický aromatický uhlovodík (PAU), jehož molekula se skládá ze čtyř spojených benzenových kruhů v plochém aromatickém systému. Tato bezbarvá pevná látka je nejmenším těsně propojeným polycyklickým aromatickým uhlovodíkem – takovým, kde jsou benzenová jádra spojena více než jednou stranou. Pyren vzniká při nedokonalém spalování organických sloučenin.
Použití
[editovat | editovat zdroj]Využití nachází v biochemickém výzkumu – jeho deriváty se používají jako molekulární sondy ve fluorescenční mikroskopii. Používá se také jako výchozí materiál při výrobě barviv a může sloužit jako donor elektronů čímž zvyšuje tmavost tuhy.[2]
Výskyt a reaktivita
[editovat | editovat zdroj]Pyren byl poprvé izolován z uhelného dehtu, ve kterém tvoří až 2 % (hmotnostní).[3][4] Jakožto PAU s těsně propojenými benzenovými jádry je pyren mnohem více rezonančně stabilizován než jeho izomer fluoranthen s pětičlenným kruhem. Proto vzniká za širšího rozsahu podmínek spalování. Například automobily produkují přibližně 1 μg/km.[5]
Oxidace chromanem poskytuje perinaftenon a následně kyselinu naftalen-1,4,5,8-tetrakarboxylovou. Podléhá sérii hydrogenačních reakcí a je citlivý na halogenaci, Dielsovy–Alderovy adice a nitraci, vždy s proměnným stupněm selektivity.[5]
Bezpečnost
[editovat | editovat zdroj]Přestože pyren není tak problematický jako benzo(a)pyren, studie prováděné na zvířatech ukázaly jeho toxicitu pro ledviny a játra. Také dráždí kůži a může způsobovat její chronické odbarvení.[6]
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Pyrene na anglické Wikipedii.
- ↑ a b Pyrene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Griesbaum K et al. Ullmann's Encyclopedia of Industrial Chemistry 7th ed. (2008). NY, NY: John Wiley & Sons; Hydrocarbons. Online Posting Date: June 15, 2000.
- ↑ Warshawsky D; Patty's Toxicology CD-ROM (2005). NY, NY: John Wiley & Sons; Polycyclic and Heterocyclic Aromatic Hydrocarbons. Online Posting Date: April 16, 2001.
- ↑ IARC. Monographs on the Evaluation of the Carcinogenic Risk of Chemicals to Man. Geneva: World Health Organization, International Agency for Research on Cancer, 1972-PRESENT. (Multivolume work). Available at: http://monographs.iarc.fr/index.php Archivováno 23. 1. 2013 na Wayback Machine. p. V32 432 (1983).
- ↑ a b Selim Senkan and Marco Castaldi "Combustion" in Ullmann's Encyclopedia of Industrial Chemistry, 2003 Wiley-VCH, Weinheim. Article Online Posting Date: March 15, 2003.
- ↑ Lewis, R.J. Sax's Dangerous Properties of Industrial Materials. 9th ed. Volumes 1-3. New York, NY: Van Nostrand Reinhold, 1996., p. 2830.
Literatura
[editovat | editovat zdroj]- BIRKS, J. B. Photophysics of Aromatic Molecules. London: Wiley, 1969.
- VALEUR, B. Molecular Fluorescence: Principles and Applications. New York: Wiley-VCH, 2002.
- BIRKS, J.B. Eximers. london: Reports on Progress in Physics, 1975.
- FETZER, J. C. The Chemistry and Analysis of the Large Polycyclic Aromatic Hydrocarbons. New York: Wiley, 2000.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Pyren na Wikimedia Commons
Obrázky, zvuky či videa k tématu Pyren na Wikimedia Commons - (anglicky) Pyren na Chemical land21
- (anglicky) Pyren na PubChem
- (anglicky) Pyren na Toxnet

