Sulfenové kyseliny
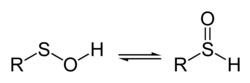
Sulfenové kyseliny jsou organosirné sloučeniny odpovídající vzorci R-S-OH. Jsou první úrovní řady organosirných oxokyselin, kam patří též sulfinové kyseliny (R−S(=O)OH) a sulfonové kyseliny (R−S(=O)2OH). Základní sloučeninou této řady, pro R = H, je thioperoxid vodíku.
Vlastnosti
[editovat | editovat zdroj]Oproti sulfinovým a sulfonovým jsou jednoduché sulfenové kyseliny, například kyselina methansulfenová, CH3SOH, vysoce reaktivní a nelze je izolovat v roztocích; v plynném skupenství je poločas rozkladu kyseliny methansulfenové okolo jedné minuty. Plynná kyselina methansulfenová má, jak bylo zjištěno mikrovlnnou spektroskopií, strukturu CH3–S–O–H.[1]
Sulfenové kyseliny mohou být stabilizovány sterickými efekty, které brání jejich autokondenzacím za tvorby thiosulfinátů, RS(O)SR. Struktura těchto stabilizovaných sulfenových kyselin odpovídá vzorci R–S–O–H.[2][3]
Stabilní kyselina triptycen-1-sulfenová má pKa 12,5 a disociační energie vazby O–H je 301 ± 1 kJ/mol; u (valenčně) isoelektronického hydroperoxidu (ROOH) je pKa větší než 14 a disociační energie vazby O–H činí přibližně 370 kJ/mol.[4]
Vznik a výskyt
[editovat | editovat zdroj]Peroxiredoxiny
[editovat | editovat zdroj]Peroxiredoxiny jsou enzymy, které detoxikují peroxidy; přeměňují přitom cysteinové zbytky na sulfenové kyseliny, které se poté reakcemi s dalšími cysteiny mění na disulfidy.[5]
Česnek a cibule
[editovat | editovat zdroj]Sulfenové kyseliny se také vytváří při enzymatickém rozkladu aliinu a podobných sloučenin po poškození buněk česneku a cibule. Kyselina propen-1-sulfenová, vznikající při krájení cibule, se rychle přeměňuje na syn-propanthial-S-oxid.[6]
Kyselina propen-2-sulfenová, vzniklá z alicinu, je pravděpodobným původcem antioxidačních vlastností česneku.[7]
Pomocí hmotnostní spektrometrie bylo zjištěno, že poločas rozkladu kyseliny 2-propensulfenové je kratší než 1 sekunda.[8]
Farmakologická aktivita některých léčiv, jako jsou omeprazol, esomeprazol, tiklopidin, klopidogrel, a prasugrel se připisuje tvorbě sulfenových kyselin jako meziproduktů jejich metabolismu.[9]
Oxidace cysteinových zbytků v bílkovinách, vytvářející příslušné sulfenové kyseliny, jsou důležité pro redoxně řízené signální transdukce.[10][11]
Sulfenenové kyseliny jsou jedněmi z produktů reakcí probíhajících při rozkrojení cibule. Slzné žlázy jsou drážděny konečným produktem těchto reakcí, syn-propanthial-S-oxidem.[12]
Chemické vlastnosti
[editovat | editovat zdroj]
Sulfoxidy mohou po zahřátí procházet Ei eliminacemi za vzniku vinylalkenů a sulfenových kyselin:[13][14]
Sloučeniny vstupující do takovýchto reakcí se používají jako stabilizátory polymerů, kde brání jejich poškozování dlouhodobým působením vyšších teplot;[15] nejčastěji se používají thiodipropionátové estery.[16]
Sulfenátové ligandy lze nalézt na aktivních místech nitrilhydratáz. Skupina S=O slouží jako nukleofil, který atakuje nitril.[17]
Další sulfenylové sloučeniny
[editovat | editovat zdroj]
Skupina RS (R ≠ H) se označuje názvoslovnou předponou sulfenyl; příkladem sloučeniny může být methansulfenylchlorid, CH3SCl.[18]
Sulfenátové estery, RSOR, vznikají reakcemi sulfenylchloridů s alkoholy.[19]
Sulfenátové estery jsou meziprodukty Mislowových-Evansových přesmyků allylsulfoxidů.[13] Jsou také popsány sulfenamidy, RSNR′2.
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Sulfenic acid na anglické Wikipedii.
- ↑ R. E. Penn; E. Block; L. K. Revelle. Methanesulfenic Acid. Journal of the American Chemical Society. 1978, s. 3622–3624. DOI 10.1021/ja00479a068.
- ↑ K. Goto; M. Holler; R. Okazaki. Synthesis, Structure, and Reactions of a Sulfenic Acid Bearing a Novel Bowl-Type Substituent: The First Synthesis of a Stable Sulfenic Acid by Direct Oxidation of a Thiol. Journal of the American Chemical Society. 1997, s. 1460–1461. DOI 10.1021/ja962994s.
- ↑ A. Ishii; K. Komiya; J. Nakayama. Synthesis of a Stable Sulfenic Acid by Oxidation of a Sterically Hindered Thiol (Thiophenetriptycene-8-thiol)1 and Its Characterization. Journal of the American Chemical Society. 1996, s. 12836-12837. DOI 10.1021/ja962995k.
- ↑ A. J. McGrath; G. E. Garrett; L. Valgimigli; D. A. Pratt. The redox chemistry of sulfenic acids. Journal of the American Chemical Society. 2010, s. 16759-16761. DOI 10.1021/ja1083046. PMID 21049943.
- ↑ Sue Goo Rhee; In Sup Kil. Multiple Functions and Regulation of Mammalian Peroxiredoxins. Annual Review of Biochemistry. 2017, s. 749–775. DOI 10.1146/annurev-biochem-060815-014431. PMID 28226215.
- ↑ E. Block. Garlic and Other Alliums: The Lore and the Science. [s.l.]: Royal Society of Chemistry, 2010. ISBN 978-0-85404-190-9.
- ↑ V. Vaidya; K. U. Ingold; D. A. Pratt. Garlic: Source of the Ultimate Antioxidants – Sulfenic Acids. Angewandte Chemie International Edition. 2009, s. 157–160. DOI 10.1002/anie.200804560. PMID 19040240.
- ↑ E. Block; A. J. Dane; S. Thomas; R. B. Cody. Applications of Direct Analysis in Real Time–Mass Spectrometry (DART-MS) in Allium Chemistry. 2-Propenesulfenic and 2-Propenesulfinic Acids, Diallyl Trisulfane S-Oxide and Other Reactive Sulfur Compounds from Crushed Garlic and Other Alliums. Journal of Agricultural and Food Chemistry. 2010, s. 4617–4625. DOI 10.1021/jf1000106. PMID 20225897.
- ↑ D. Mansuy; P. M. Dansette. Sulfenic acids as reactive intermediates in xenobiotic metabolism. Archives of Biochemistry and Biophysics. 2011, s. 174–185. Dostupné online. DOI 10.1016/j.abb.2010.09.015. PMID 20869346.
- ↑ N. J. Kettenhofen; M. J. Wood. Formation, Reactivity, and Detection of Protein Sulfenic Acids. Chemical Research in Toxicology. 2010, s. 1633–1646. DOI 10.1021/tx100237w. PMID 20845928.
- ↑ Vinayak Gupta; Kate S. Carroll. Sulfenic acid chemistry, detection and cellular lifetime. Biochimica et Biophysica Acta - General Subjects. 2014, s. 847–875. DOI 10.1016/j.bbagen.2013.05.040. PMID 23748139.
- ↑ Why does chopping an onion make you cry? [online]. The Library of Congress [cit. 2019-04-01]. Dostupné online.
- ↑ a b Braverman, S., Rearrangements involving sulfenic acids and their derivatives, Sulfenic Acids and Derivatives, 1990, John Wiley & Sons DOI:10.1002/9780470772287.ch8
- ↑ Michael Carrasco; Robert J. Jones; Scott Kamel; H. Rapoport; Thien Truong. N-(Benzyloxycarbonyl)-L-Vinylglycine Methyl Ester. Organic Syntheses. 1992, s. 29. DOI 10.15227/orgsyn.070.0029.
- ↑ C. Kröhnke. Reference Module in Materials Science and Materials Engineering. [s.l.]: [s.n.], 2016. ISBN 978-0-12-803581-8. DOI 10.1016/B978-0-12-803581-8.01487-9. Kapitola Polymer Stabilization.
- ↑ C. Armstrong; M. A. Plant; G. Scott. Mechanisms of antioxidant action: the nature of the redox behaviour of thiodipropionate esters in polypropylene. European Polymer Journal. 1975, s. 161–167. DOI 10.1016/0014-3057(75)90141-X.
- ↑ Todd C. Harrop; Pradip K. Mascharak. Fe(III) and Co(III) Centers with Carboxamido Nitrogen and Modified Sulfur Coordination: Lessons Learned from Nitrile Hydratase. Accounts of Chemical Research. 2004, s. 253–260. DOI 10.1021/ar0301532. PMID 15096062.
- ↑ The IUPAC Compendium of Chemical Terminology: The Gold Book. Příprava vydání Victor Gold. 4. vyd. Research Triangle Park, NC: International Union of Pure and Applied Chemistry (IUPAC) Dostupné online. DOI 10.1351/goldbook.s06098. (anglicky)
- ↑ Goran Petrovic; Radomir N. Saicic; Zivorad Cekovic. Phenylsulfenylation of Nonactivated Carbon Atom by Photolysiis of Alkyl Benzenesulfenated: Preparation of 2-Phenylthio-5-heptanol. Organic Syntheses. 2005, s. 244. DOI 10.15227/orgsyn.081.0244.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Sulfenové kyseliny na Wikimedia Commons
Obrázky, zvuky či videa k tématu Sulfenové kyseliny na Wikimedia Commons
