Thiomočovina
| Thiomočovina | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | thiokarbonyldiamid |
| Ostatní názvy | thiokarbamid |
| Funkční vzorec | CS(NH2)2 |
| Sumární vzorec | CH4N2S |
| Vzhled | bílé krystaly nebo prášek[1] |
| Identifikace | |
| Registrační číslo CAS | 62-56-6 |
| EC-no (EINECS/ELINCS/NLP) | 200-543-5 |
| PubChem | 2723790 |
| SMILES | C(=S)(N)N |
| InChI | InChI=1S/CH4N2S/c2-1(3)4/h(H4,2,3,4) |
| Číslo RTECS | YU2800000 |
| Vlastnosti | |
| Molární hmotnost | 76,121 g/mol |
| Teplota tání | 182 °C (455 K)[1] |
| Teplota varu | rozklad[1] |
| Teplota sublimace | 150 až 160 °C (423 až 433 K) (za nízkého tlaku)[1] |
| Hustota | 1,405 g/cm3[1] |
| Rozpustnost ve vodě | 14,2 g/100 ml[1] |
| Rozpustnost v polárních rozpouštědlech | 11,9 g/100 g (methanol) 3,6 g/100 g (ethanol), rozpustná v roztoku thiokyanatanu amonného[1] |
| Rozpustnost v nepolárních rozpouštědlech | téměř nerozpustná v diethyletheru[1] |
| Tlak páry | 1,88*10−5 Pa[1] |
| Povrchové napětí | 10,404 mN/m (181 C)[1] |
| Termodynamické vlastnosti | |
| Standardní molární spalná entalpie ΔH°sp | −1482,2 kJ/mol (stálý objem) −1485,6 kJ/mol (stálý tlak)[1] |
| Bezpečnost | |
| [1] Varování[1] | |
| H-věty | H302 H351 H361d H411[1] |
| P-věty | P201 P202 P264 P270 P273 P281 P301+312 P308+313 P330 P391 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Thiomočovina je organická sloučenina se vzorcem CS(NH2)2. Je strukturně podobná močovině, oproti které má místo kyslíkového atomu síru, jejich vlastnosti jsou však odlišné značně. Thiomočovina se používá jako reaktant v organické syntéze. Jako „thiomočoviny“ se také obecně označují sloučeniny typu (R1R2N)(R3R4N)C=S; thiomočoviny jsou podobné thioamidům (RC(S)NR2), kde R je organická funkční skupina.

Struktura
[editovat | editovat zdroj]Molekula thiomočoviny je rovinná. Vazba C=S má délku 171 pm a průměrná délka vazeb C-N činí 133 pm.[2]
Zeslabení vazby C-S bond C-N pí vazbou naznačuje menší délka vazby C=S u thiobenzofenonu (163 pm).
Thiomočovina má dva tautomery, přičemž ve vodných roztocích převažuje thionová forma; rovnovážná konstanta Keq je podle výpočtů 0,001 04.[3]
Thiolová forma, také nazývaná isothiomočovina, vytváří deriváty jako jsou například isothiouroniové soli.
Výroba
[editovat | editovat zdroj]Ročně se vyrobí kolem 10 000 tun thiomočoviny. Thiomočovinu lze získat z thiokyanatanu amonného, častěji se ovšem vyrábí reakcí sulfanu s kyanamidem vápenatým za přítomnosti oxidu uhličitého.[4]
Použití
[editovat | editovat zdroj]Prekurzor thioxosloučenin
[editovat | editovat zdroj]Samotná thiomočovina nemá mnoho využití. Nejčastěji se používá jako prekurzor dioxidu thiomočoviny, používaného jako redukční činidlo v textilním průmyslu.[4]
Hnojivo
[editovat | editovat zdroj]Thiomočovina může být použita jako hnojivo, obzvláště v případech environmentálního stresu.[5]
Ostatní použití
[editovat | editovat zdroj]Thiomočovina se také používá na výrobu pryskyřičných zpomalovačů hoření a urychlovačů vulkanizace.
Thiomočovina je také složkou diazopapírů a fotografických papírů citlivých na světlo.
Thiomočovina je také látkou využívanou při některých pokovovacích metodách.[6]
Je základní složkou některých čistidel barevných kovů. Například Aurex ji obsahuje až z 15 %.
Reakce
[editovat | editovat zdroj]Thiomočovina se při zahřátí nad 130 °C mění na thiokyanatan amonný. Při ochlazení dochází k přeměně amonné soli zpět na thiomočovinu.
Reduční činidlo
[editovat | editovat zdroj]Thiomočovina redukuje peroxidy na odpovídající dioly.[7]
Meziproduktem je nestabilní endoperoxid.

Thiomočovinu lze také zapojit do redukční ozonolýzy vytvářející karbonylové sloučeniny.[8]
Při této reakci je možné použít také dimethylsulfid, který je však velmi těkavý (teplota varu 37 °C) a má nepříjemný zápach, zatímco thiomočovina je bez zápachu a netěkavá (díky své polaritě).

Zdroj sulfidových iontů
[editovat | editovat zdroj]Thiomočovina může být použita jako zdroj sulfidových iontů, například při přeměně halogenalkanů na thioly. Reakce využívá vysokou nukleofilitu sirného centra a snadné hydrolýzy izothiouroniové soli:
- CS(NH2)2 + RX → RSC(NH2) +
2 X− - RSC(NH2) +
2 X− + 2 NaOH → RSNa + OC(NH2)2 + NaX + H2O
- RSNa + HCl → RSH + NaCl
V následujícím případě vzniká z 1,2-dibromethanu ethan-1,2-dithiol:[9]
- C2H4Br2 + 2 SC(NH2)2 → [C2H4(SC(NH2)2)2]Br2
- [C2H4(SC(NH2)2)2]Br2 + 2 KOH → C2H4(SH)2 + 2 OC(NH2)2 + 2 KBr
Podobně jako ostatní thioamidy může být thiomočovina použita jako zdroj sulfidových iontů pomocí reakce s kovovými ionty; například její reakcí s rtuťnatými solemi se tvoří sulfid rtuťnatý:
- Hg2+ + SC(NH2)2 + H2O → HgS + OC(NH2)2 + 2 H+
Tyto sulfidační reakce, tedy přípravy sulfidů kovů, vyžadují vodní prostředí a obvykle také zahřívání reakční směsi.[10][11]
Příprava heterocyklů
[editovat | editovat zdroj]Thiomočoviny jsou stavebními prvky pyrimidinových derivátů. Kondenzují s β-dikarbonylovými sloučeninami.[12] Aminová skupina thiomočoviny kondenzuje s karbonylem, poté dochází k cyklizaci a tautomerizaci. Desulfurizací se poté vytváří pyrimidin.
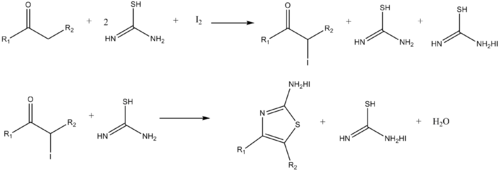
Podobně lze připravit aminothiazoly reakcemi thiomočoviny s α-haloketony.[13]
Z thiomočoviny se vyrábí léčiva kyselina thiobarbiturová a sulfathiazol.[4] 4-Amino-3-hydrazino-5-merkapto-1,2,4-triazol se vyrábí reakcí thiomočoviny s hydrazinem.
Kurnakovova reakce
[editovat | editovat zdroj]Thiomočovina je reaktantem při Kurnakovově reakci používané k odlišení cis- a trans- izomerů některých rovinných komplexů platiny. Objevil ji Nikolaj Kurnakov v roce 1893 a stále se používá.[14]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Thiourea na anglické Wikipedii.
- ↑ a b c d e f g h i j k l m n o Thiourea. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ D. Mullen; E. Hellner. A Simple Refinement of Density Distributions of Bonding Electrons. IX. Bond Electron Density Distribution in Thiourea, CS(NH2)2, at 123K. Acta Crystallographica. 1978, s. 2789–2794. DOI 10.1107/S0567740878009243.
- ↑ P. E. Allegretti; E. A. Castro; J. J. P. Furlong. Tautomeric equilibrium of amides and related compounds: theoretical and spectral evidences. Journal of Molecular Structure: THEOCHEM. 2000, s. 121–126. DOI 10.1016/S0166-1280(99)00294-8.
- ↑ a b c Bernd Mertschenk; Ferdinand Beck; Wolfgang Bauer. Ullmann's Encyclopedia of Industrial Chemistry. [s.l.]: Wiley-VCH, 2002. ISBN 3527306730. DOI 10.1002/14356007.a26_803. Kapitola Thiourea and Thiourea Derivatives.
- ↑ Abdul Wahid. Thiourea: A Molecule with Immense Biological Significance for Plants. International Journal of Agriculture and Biology. 2017-08-01, s. 911–920. Dostupné online. ISSN 1560-8530. DOI 10.17957/ijab/15.0464. Archivováno 15. 2. 2020 na Wayback Machine.
- ↑ 81st Universal Metal Finishing Guidebook. International Metal Finishing, Guidebook and Directory Issue. 2013, s. 285. Dostupné v archivu pořízeném dne 2017-11-17. ISSN 0026-0576. Archivováno 17. 11. 2017 na Wayback Machine.
- ↑ C. Kaneko; A. Sugimoro; S. Tanaka. A facile one-step synthesis of cis-2-cyclopentene and cis-2-cyclohexene-1,4-diols from the corresponding cyclodienes. Synthesis. 1974, s. 876–877. DOI 10.1055/s-1974-23462.
- ↑ D. Gupta; G. Soman; S. Dev. Thiourea, a convenient reagent for the reductive cleavage of olefin ozonolysis products. Tetrahedron. 1982, s. 3013–3018. DOI 10.1016/0040-4020(82)80187-7.
- ↑ SPEZIALE, A. J. Ethanedithiol. Org. Synth.. 1963. Dostupné online.; Coll. Vol.. S. 401.
- ↑ An efficient precursor to synthesize various FeS2 nanostructures via a simple hydrothermal synthesis method. CrystEngComm. 2016, s. 6262–6271. DOI 10.1039/c6ce01203e.
- ↑ Facile Cd−Thiourea Complex Thermolysis Synthesis of Phase-Controlled CdS Nanocrystals for Photocatalytic Hydrogen Production under Visible Light. The Journal of Physical Chemistry C. 2007, s. 17527–17534. DOI 10.1021/jp076566s.
- ↑ FOSTER, H. M., AND SNYDER, H. R. 4-Methyl-6-hydroxypyrimidine. Org. Synth.. 1963. Dostupné online.; Coll. Vol.. S. 638.
- ↑ R. M. Dodson; L. C. King. The reaction of ketones with halogens and thiourea. Journal of the American Chemical Society. 1945, s. 2242–2243. DOI 10.1021/ja01228a059. PMID 21005695.
- ↑ George B. Kauffman. Nikolaĭ semenovich kurnakov, the reaction (1893) and the man (1860–1941) a ninety-year retrospective view. Polyhedron. 1983-01-01, s. 855–863. Dostupné online. ISSN 0277-5387. DOI 10.1016/S0277-5387(00)81400-X.
Literatura
[editovat | editovat zdroj]- The Chemistry of double-bonded functional groups. Redakce Patai S.. New York: John Wiley & Sons, 1977. Dostupné online. ISBN 0-471-92493-8. S. 1355–1496.
Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu thiomočovina na Wikimedia Commons
Obrázky, zvuky či videa k tématu thiomočovina na Wikimedia Commons - INCHEM assessment of thiourea
- International Chemical Safety Card 0680