Xantáty


Jako xantáty se obvykle označují soli se vzorcem ROCS −
2 M+ (R = alkyl; M+ = Na+ nebo K+), jedná se tedy o thioáty kovů a O-dithiouhličitanové estery. Objevil je dánský chemik William Christopher Zeise v roce 1823. Mají význam při výrobě celofánu a podobných polymerů z celulózy a při extrakci kovů z rud.[1] Také se jedná o meziprodukty některých organických syntéz.
Jako xantáty se také označují O,S-estery xanthových kyselin; jejich obecný vzorec je ROC(=S)SR′.
Příprava a struktura
[editovat | editovat zdroj]Xantátovou sůl lze připravit reakcí alkoholu, zásady a sirouhlíku; tento postup se nazývá xantace.[1] Zásada s alkoholem vytváří alkoxid, který se jako nukleofil na elektrofilní uhlíkové centrum v CS2.[2]
Alkoxid se často vytváří v průběhu reakce působením hydroxidu sodného nebo draselného na alkohol;
- ROH + CS2 + KOH → ROCS2K + H2O
například z ethoxidu sodného vzniká ethylxantát sodný. Technické xantáty obvykle mívají čistotu mezi 90 a 95 %. K nečistotám mohou patřit sulfidy kovů, sírany, trithiouhličitany, thiosírany, siřičitany a uhličitany, rovněž i zbytky reaktantů, alkoholů a hydroxidů. Tyto soli mohou být dostupné jako prášky, granule, vločky, tyčinky a roztoky.
Mezi významné xantátové soli patří:
- ethylxantát sodný CH3CH2OCS2Na
- ethylxantát draselný, CH3CH2OCS2K
- isopropylxantát sodný, (CH3)2CHOCS2Na
- isobutylxantát sodný, (CH3)2CHCH2OCS2Na
- anylxantát draselný, CH3(CH2)4OCS2K
OCS2 jsou, podobně jako u jiných esterů kyseliny uhličité, rovinné. Centrální atom uhlíku je sp2-hybridizován.
Reakce
[editovat | editovat zdroj]
Xantátové soli se za přítomnosti kyselin rozkládají:
- ROCS2K + HCl → ROH + CS2 + KCl
Jedná se o opak reakce sloužící na přípravu xantátů. Meziprodukty jsou xantové kyseliny, ROC(S)SH, které v některých případech lze izolovat.
Xantátové anionty mohou také být alkylovány za vzniku xantátových esterů, ty jsou obvykle stálé:[3]
- ROCS2K + R′X → ROC(S)SR′ + KX
Vazby C-O v těchto sloučeninách mohou být zapojeny do Bartonových–McCombieových deoxygenací, což poskytuje možnost deoxygenovat alkoholy.
Lze je zoxidovat na dixantogeny:
- 2 ROCS2Na + Cl2 → ROC(S)S2C(S)OR + 2 NaCl
Xantáty se mohou navázat na atomy přechodných kovů jako bidentátní ligandy. Jejich nenabité komplexy jsou rozpustné v organických rozpouštědlech.[4]
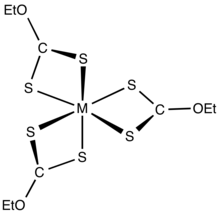
Použití
[editovat | editovat zdroj]
Celulóza reaguje za přítomnosti hydroxidu sodného (NaOH) se sirouhlíkem (CS2) za vzniku xantátu celulózy, z něhož po neutralizaci kyselinou sírovou (H2SO4) vzniká viskóza nebo celofán.
Některé xantáty a bisxantáty (například dixanthogen) se používají jako flotační činidla při zpracování nerostů. Jsou meziprodukty při Čugajevových eliminacích a používají se na řízení radikálových polymerizací.
Podobné sloučeniny
[editovat | editovat zdroj]Vzácně se objevující sloučeniny thioxantáty vznikají reakcemi CS2 s thioláty. Jako příklad lze uvést ethylthioxantát sodný, C2H5SCS2Na. Xantátům se také podobají dithiokarbamáty, jež se dají připravit působením sirouhlíku na sekundární aminy; patří sem například diethyldithiokarbamát sodný se vzorcem (C2H5)2NCS2Na.
Vliv na životní prostředí
[editovat | editovat zdroj]I když jsou biologicky rozložitelné, tak mohou xantáty být toxické pro vodní organizmy i v koncentracích nižších než 1 mg/l.[7]
Odtoky z dolů jsou často kontaminované xantáty.[8]
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Xanthate na anglické Wikipedii.
- ↑ a b ROY, Kathrin-Maria. Xanthates. Příprava vydání Wiley-VCH Verlag GmbH & Co. KGaA. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA Dostupné online. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a28_423. S. a28_423. (anglicky) DOI: 10.1002/14356007.a28_423.
- ↑ Charles C. Price; Gardner W. Stacy. p-Nitrophenyl sulfide. Organic Syntheses. 1948, s. 82. doi:10.15227/orgsyn.028.0082.
- ↑ GAGOSZ, Fabien; ZARD, Samir Z. A Xanthate-Transfer Approach to α-Trifluoromethylamines. Org. Synth.. 1948, s. 32. Dostupné online.; Coll. Vol.. S. 212.
- ↑ I. Haiduc. Comprehensive Coordination Chemistry II. [s.l.]: [s.n.], 2004. doi:10.15227/orgsyn.028.0082. Kapitola 1,1-Dithiolato ligands, s. 349–376.
- ↑ F. Galsbøl; Gardner W. Stacy. Tris (O-Ethyl Dithiocarbonato) Complexes of Tripositive Chromium, Indium, and Cobalt. Inorganic Syntheses. 1967, s. 42–49. ISBN 9780470132418. doi:10.1002/9780470132418.ch6.
- ↑ Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 652, ISBN 3-342-00280-8
- ↑ J. Besser; W. Brumbaugh; A. Allert; B. Poulton; C. Schmitt; C. Ingersoll. Ecological impacts of lead mining on Ozark streams: toxicity of sediment and pore water. Ecotoxicology and Environmental Safety. 2009, s. 516–526. Dostupné online. doi:10.1016/j.ecoenv.2008.05.013. PMID 18603298.
- ↑ Y. Xu; J. P. Lay; F. Korte. Fate and effects of xanthates in laboratory freshwater systems. Bulletin of Environmental Contamination and Toxicology. 1988, s. 683–689. doi:10.1007/BF02021019. PMID 3233367.