RuBisCO
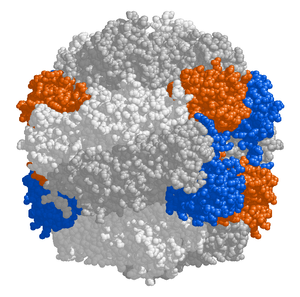
Ribulose-1,5-bisphosphate carboxylase/oxygenase, bedre kendt under navnet RuBisCO [1], er et enzym, der bruges i Calvins cyklus som katalysator for det første, større skridt i kulstofbindingen, en proces, hvor atomer fra atmosfærens CO2 gøres tilgængelige for organismerne i form af energirige molekyler som f.eks. sukrose. RuBisCO katalyserer enten karboxylering eller oxidering af ribulose-1,5-bisfosfat (bedre kendt som RuBP) under forbrug af henholdsvis CO2 eller ilt.
| Hvad der gør RuBisCO enestående og anderledes i forhold til alle andre enzymer, er det, at det kan overleve på egen hånd uden at have behov for planten. Derfor bliver det tilbage, selv efter at planten er død, og hjælper til med nedbrydningen. Det skyldes, at det hverken påvirkes af temperatur eller pH. |
RuBisCO er meget vigtigt på grund af dets biologiske betydning, især fordi det katalyserer den mest brugte kemiske proces (henholdsvis inddragelse og frigivelse af CO2 fra og til atmosfæren). RuBisCO er desuden det mest almindelige protein i bladene, og det kan tilmed være det mest almindeligt forekommende protein i verden, da planter udgør mere end 99 % af Jordens biomasse.[2]. I bevidstheden om stoffets vigtige rolle i biosfæren, er der bestræbelser i gang på at genmanipulere dyrkede afgrøder, sådan at de får et mere effektivt RuBisCO (se nedenfor).
Struktur
[redigér | rediger kildetekst]Hos planter, alger, cyanobakterier samt fototropiske og kemoautotropiske proteobakterier består enzymet almindeligvis af to typer af protein-underenheder, som kaldes den lange kæde (L med ca. 55.000 Da) og den korte kæde (S med ca. 13.000 Da)[3]. De enzymaktive substrat (ribulose-1,5-bisfosfat)-bindingssteder findes i de lange kæder, der danner dimere forbindelser, som vist på figur 1 (ovenfor til højre), hvor aminosyrer fra hver af de lange kæder bidrager til bindingsstederne. En helhed af otte lange kæde-dimerer og otte korte kæder samles til et større kompleks med ca. 540.000 Da[4]. Hos nogle proteobakterier og dinoflagellater har man fundet enzymer, der udelukkende består af lange kæder[5].
Magnesiumioner (Mg2+) er nødvendige for enzymaktivitet. Korrekt placering af Mg2+ i enzymets aktive sted kræver, at et lysin på det aktive sted får tilført et "aktiverende" CO2-molekyle (hvorved der dannes et karbamat)[6]. Dannelsen af karbamatet bliver begunstiget af et basisk pH. pH og koncentrationen af magnesiumioner i væskedelen af grønkornene (stroma[7]) forøges i lys. Se nedenfor.
Enzymaktivitet
[redigér | rediger kildetekst]
Som vist på Figur 2 (til venstre) er RuBisCO et af mange enzymer, der indgår i Calvins cyklus.
- Substrater
Under kulstofbindingen er RuBisCOs substrater ribulose-1,5-bisfosfat, CO2 (ikke det "aktiverende" CO2) og vand [8]. RuBisCO kan også katalysere en proces med ilt (O2) som substrat i stedet for CO2.
- Produkter
Når det er CO2, der er substratet, bliver resultatet af karboxylase-processen et yderst ustabilt mellemprodukt med seks kulstofatomer, der kaldes 3-keto-2-karboxyarabinitol-1,5-bisfosfat. Det går i stykker nærmest øjeblikkeligt og bliver til to molekyler 3-fosfoglycerat. Dette ustabile molekyle, som bliver skabt under den indledende karboxylering, var ukendt indtil 1988, da det blev isoleret første gang. 3-fosfoglycerat kan bruges til at danne større molekyler, så som glukose. Hvis det er fri ilt, der er substratet, bliver produkterne af oxygenaseprocessen fosfoglykolat og 3-fosfoglycerat. Fosfoglykolat indleder en serie af processer, der kaldes fotorespiration, og som inddrager enzymer og cytokromer, der findes i mitokondrierne og peroxisomerne. Under denne proces omdannes to molekyler fosfoglykolat til et molekyle CO2 og et molekyle 3-fosfoglycerat, som kan indgå i Calvins cyklus. Noget af fosfoglykolatet kan tilbageholdes af planterne, sådan at de kan producere andre molekyler, som f.eks. glycin. Ved de niveauer af CO2 og ilt, som findes i atmosfæren, er forholdet mellem de to processer ca. 4:1, hvad der medfører en nettokulstofbinding på kun 3,5 %. RuBisCO-enzymets manglende evne til at undgå at reagere med ilt reducerer derfor mange planters fotosyntesepotentiale. Visse planter, mange alger og fotosyntetiserende bakterier har klaret denne begrænsning ved at opfinde midler til at øge CO2-koncentrationen rundt om enzymet. Metoderne spænder fra C4-kulstofbinding og CAM-binding til brugen af pyrenoid.
- Enzymaktivitetsrate
Nogle enzymer kan typisk gennemføre tusindvis af kemiske reaktioner pr. sekund. Men RuBisCO er langsomt og kan kun ”binde” 3 CO2-molekyler pr. sekund. Ikke desto mindre øges RuBisCO-aktiviteten under de fleste forhold sammen med øgede koncentrationer af CO2 på grund af den ekstremt høje koncentration af enzymet. Når lysmængden ikke nedsætter fotosyntesen, bliver det derfor koncentrationen af CO2, der er den begrænsende faktor. I sidste ende er det i øvrigt en anden faktor ved Calvins cyklus, der er skyld i den begrænsede fotosynteserate, nemlig at RuBisCO ikke kan gendannes hurtigt nok ([9]).
Regulering af RuBisCOs enzymaktivitet
[redigér | rediger kildetekst]RuBisCO er sædvanligvis kun aktivt om dagen, da ribulose-1,5-bisfosfat ikke bliver produceret i mørke på grund af styringen af adskillige andre enzymer i Calvins cyklus. Dertil kommer, at RuBisCOs aktivitet bliver samordnet på mange måder med de andre enzymer i Calvins cyklus:
- Regulering ved ioner. Når grønkornene bliver belyst, stiger pH i stroma fra 7,0 til 8,0 på grund af proton (brintion, H+)-gradienten, der skabes ind gennem tylakoidmembranen[10]. Samtidig flyttes magnesiumioner (Mg2+) ud af tylakoiderne, og det øger koncentrationen af magnesium i grønkornets stroma. RuBisCO har et højt optimalt pH (det kan være >9,0, afhængigt af koncentrationen af magnesiumioner), og det bliver "aktiveret" ved tilførslen af CO2 og magnesium til de aktive steder som beskrevet ovenfor.
- Regulering ved aktivase. Hos planter og visse alger er et andet enzym, RuBisCO aktivase[11] nødvendigt for at muliggøre dannelsen af det afgørende karbamat på det aktive sted hos RuBisCO[12]. Aktivase er nødvendigt, fordi ribulose-1,5-bisfosfat (RuBP)-substratet binder sig kraftigere til aktive steder, der mangler karbamat, og det sinker ”aktiveringen” markant. Under lyspåvirkning fremmer RuBisCO-aktivase løsgørelsen af det hæmmende eller under nogle betingelser: oplagrende RuBP fra de aktive steder [13]. Aktivase kræves også hos nogle planter (f.eks. Tobak og mange Bønner), fordi RuBisCO bliver hæmmet i mørke af et konkurrerende hæmstof, der dannes i disse planter, en substratanalog, der hedder 2-karboxy-D-arabitinol-1-fosfat (CA1P)[14]. CA1P bindes tæt til det aktive sted på et karbamyleret RuBisCO og hæmmer katalytisk aktivitet. Under belysning fremmer RuBisCO-aktivase også løsgørelsen af CA1P fra de katalytiske steder. Når CA1P er frigjort fra RuBisCO, bliver det hastigt omdannet til en ikke-hæmmende form af det lysaktiverede enzym CA1P-fosfatase. Endelig er det sådan, at ud af adskillige hundreder af reaktioner med CO2 eller ilt vil en enkelt ikke blive ført til ende, og der dannes andre, hæmmende substratanaloger på det aktive sted. Endnu en gang kan RuBisCO-aktivase fremme løsgørelsen af disse analoge stoffer fra de katalytiske steder og vedligeholde RuBisCO i en katalytisk aktiv form. Under RuBisCos indledende lysproces bindes det RuBP, som blev adskilt fra RuBisCO, til det karbamylerede enzym, og efter fjernelse af protoner dannes enediol, som kan reagere med CO2. En mangel på enten RuBisCO eller RuBP i et hvilket som helst trin vil lukke processen af for andre faktorer, inklusive CO2-mængden. Af den grund kan modeller, der bygger på en begrænsning af RuBisCO ved lave CO2-niveauer, ikke understøtte livet på planeten[15]. Aktivase-enzymets egenskaber begrænser planters fotosyntetiske aktivitet ved høje temperaturer[16]. CA1P har også vist sig at kunne fastholde Rubisco i en konformation, som er beskyttet mod proteolyse[17].
- Regulering ved ATP/ADP og aktivasestyret reduktion/oxideringstilstand i stroma Fjernelsen af de hæmmende stoffer RuBP, CA1P og andre hæmmende substratanaloger ved aktivase forudsætter et forbrug af ATP. Denne proces hæmmes ved tilstedeværelse af ADP, og det betyder, at aktivaseenzymets aktivitet afhænger af forholdet mellem disse to stoffer i grønkornets stroma. Hos de fleste planter bliver aktivases følsomhed overfor ATP/ADP-forholdet desuden ændret af stromas reduktion/oxidering (redox)-tilstand via et andet, lille reguleringsprotein, thioredoxin. På den måde kan aktivases aktivitet og RuBisCOs aktiveringsgrad ændres som svar på lysintensiteten og derfor også tempoet i dannelsen ribulose-1,5-bisfosfat-substratet[18].
- Regulering ved fosfat. Hos cyanobakterierne deltager uorganisk fosfat (Pi) i den koordinerede regulering af fotosyntesen. Pi bindes til RuBisCOs aktive sted og til et andet sted på den lange kæde, hvor det kan påvirke overgange mellem den aktiverede og de mindre aktive former af enzymet. Aktiveringen af bakterie-RuBisCO kan være særligt følsomt for Pi-niveauer, der kan virke på samme måde, som RuBisCO-aktivase hos højere planter[19].
- Regulering ved CO2. Da CO2 og ilt konkurrerer om det aktive sted på RuBisCO, kan kulstofbindingen ved hjælp af RuBisCO forøges ved at hæve CO2-niveauet i den del, som indeholder RuBisCO (grønkornenes stroma). Flere gange i løbet af planternes udvikling er der opstået mekanismer, der forøger CO2-niveauet i stroma (se C4-kulstofbinding). Brugen af ilt som et substrat er tilsyneladende en forvirrende proces, for det virker, som om den kaster indvundet energi bort. Men den kan være en mekanisme, der skal forebygge overbelastning i perioder med stor lysindstråling. Denne svaghed ved enzymet er baggrunden for fotorespirationen, som kan betyde, at sunde blade i klart lys kan opnå et netto-nulresultat i kulstofbinding, når forholdet mellem ilt og CO2 kommer op på en tærskel, hvor ilt bliver bundet i stedet for kulstof. Fænomenet er først og fremmest temperaturafhængigt. Høje temperaturer nedsætter koncentrationen af CO2, som er opløst i bladvævenes fugtighed. Det samme fænomen er også forbundet med vandmangel. Da bladene bliver afkølet ved fordampning, vil mangel på vand fremkalde høje temperaturer i bladene. C4-planter bruger i begyndelsen enzymet PEP karboxylase, og det har en højere bindingsevne for CO2. Under processen bliver der først dannet et mellemprodukt med 4 kulstofatomer, og det bliver derpå befordret hen til et sted, hvor der foregår C3-fotosyntese, for derefter at blive de-karboxyleret, så der frigives CO2, der øger koncentrationen af CO2. Dette er baggrunden for navnet C4-planter. CAM-planter holder deres spalteåbninger (på undersiden af bladet) lukkede om dagen, hvad der sparer på vandet, men forhindrer fotosyntese, der kræver at CO2 kan passere disse åbninger ved diffusion. Fordampning gennem bladets overside bliver forhindret ved et lag af voks.
Genmanipulation
[redigér | rediger kildetekst]Da RuBisCO ofte anses for at begrænse fotosyntesen hos planter, kunne det være muligt at forbedre effektiviteten af fotosyntesen ved at ændre på RuBisCO-generne i planterne, sådan at man øger enzymets katalytiske aktivitet og/eller nedsætter tempoet i iltningsaktiviteten[20]. Metoder, som man er begyndt at undersøge, omfatter overførelse af RuBisCO-gener fra én organisme til en anden, forøgelse af niveauet for dannelse af RuBisCOs underenheder, dannelse af RuBisCOs korte kæder ud fra grønkorn-DNA og ændring af RuBisCo-generne, så man kan forsøge at øge tendensen til kulstofbinding[21].
En særligt interessant fremgangsmåde er at indføre RuBisCO-varianter med naturligt høj tilbøjelighed for CO2, så som typer fra rødalgen Galdieria partita, i planter. Man kan forvente, at det vil forbedre den fotosyntetiske effektivitet hos planteafgrøder [22]. Vigtige fremskridt på dette område omfatter erstatningen af tobaksplantens enzym med det tilsvarende fra den fotosyntetiserende purpurbakterie Rhodospirillum rubrum [23].
En ny teori undersøger udbyttet ved den forholdsmæssige tilbøjelighed (dvs. evne til at begunstige CO2-binding i forhold til at indbygge fri ilt, hvad der fører til den energimæssigt ødsle fotorespiration) og den rate, produktet dannes ved[24]. Forfatterne konkluderer, at RuBisCO i realiteten kan have udviklet sig til et punkt nær 'det perfekte' hos mange planter (med vidt forskellig adgang til substrat og miljøforhold), sådan at der er opnået et kompromis mellem CO2-målrettethed og tempo i processen.[25] Men forfatterne fra det samme forskerhold har fremsat en teori om, at fotosyntesen bliver hæmmet af RuBisCO ved de CO2-koncentrationer, der er i overensstemmelse med livets opretholdelse på kloden[26].
Se også
[redigér | rediger kildetekst]Eksterne links
[redigér | rediger kildetekst]- Vedrørende mekanismen bag den RuBisCO-katalyserede reaktion Arkiveret 16. marts 2005 hos Wayback Machine
- Rubisco: Protein Data Bank indgang Arkiveret 24. oktober 2005 hos Wayback Machine
- Planterigets dovendyr: Protein Spotlight artikel om det "dovendyrsagtige" enzym, RuBisCO
- Rubisco
Noter
[redigér | rediger kildetekst]
- ^ Udtrykket Rubisco blev udmøntet for sjov af David Eisenberg i 1979 under et seminar til ære for den pensionerede og tidligere fremtrædende RuBisCO-forsker, Sam Wildman. Forkortelsen blev lavet ud fra det fuldstændige navn (Ribulose-1,5-Bisfosfat Carboxylase/Oxygenase), men det hentyder også til et snackmærke, "Nabisco" med en skjult henvisning til Wildmans forsøg på at fremavle spiselige tobaksblade. Wildman SG (2002) Along the trail from Faction I protein to Rubisco (ribulose bisphosphate carboxylase-oxygenase). Photosynth Res 73:243–250; Archie R. Portis Jr. og Martin A. J. Parry (2007) Discoveries in Rubisco (Ribulose 1,5-bisphosphate carboxylase/oxygenase): a historical perspective Photosynth Res 94:121–143
- ^ The Cell—A Molecular Approach, 2. udg. ved Geoffrey M. Cooper, published by Sinauer Associates, Inc. (2000) Sunderland (MA). Online textbook. Coopers tekst antyder, at RuBisCO er det mest udbredte protein på Jorden. (Kapitel 10, The Chloroplast Genome). A nyere artikel af Dhingra m.fl. når frem til, at RuBisCO står for 30–50% af den samlede mængde opløseligt protein i grønkornene (se hele teksten online: Skabelon:Entrez Pubmed).
- ^ Genet for den lange kæde tilhører grønkornenes DNA-molekyle hos planter (Entrez GeneID). Der er typisk flere beslægtede kort kæde-gener i plantecellens kerne og de korte kæder bliver importeret til stoma i grønkornene fra cellevæsken ved at passere den ydre membran hos grønkornet (se hele teksten online: Entrez GeneID). Almindelig Gåsemad (Arabidopsis thaliana) har fire gener for RuBisCOs korte kæder (se: Jeremy M. Berg, John L. Tymoczko og Lubert Stryer: Biochemistry). Det mønster, der skabes, når de lange og korte kæder samles, ses på figur 3 (til højre)
- ^ Jeremy M. Berg, John L. Tymoczko og Lubert Stryer: Biochemistry, 2002: Online lærebog. Figur 20 i Stryers lærebog viser et farvekodet bånddiagram af de strukturelle dele af eukaryoternes RuBisCO. Figur 1 (nær toppen af denne side) viser en anden synsmåde på strukturen.
- ^ Strukturen i RuBisCO hos den fotosyntetiserende bakterie Rhodospirillum rubrum er blevet fastslået ved røntgenkrystallografi, I Protein Data Bank, hvor der findes en sammenligning af strukturerne i eukaryoters og bakteriers RuBisCO. Se: Emneartikel Arkiveret 18. oktober 2015 hos Wayback Machine om Rubisco.
- ^ Molecular Cell Biology, 4. udg. af Harvey Lodish, Arnold Berk, S. Lawrence Zipursky, Paul Matsudaira, David Baltimore og James E. Darnell, 2000. Online lærebog. Figur 16-48 viser en strukturmodel af det aktive sted og magnesiums rolle. Protein Data Banks emneartikel om RuBisCO har også en model af magnesium på det aktive sted Arkiveret 9. januar 2006 hos Wayback Machine.
- ^ Lodish' lærebog beskriver lokaliseringen af RuBisCO til stroma. Figur 17-7 viser, hvordan RuBisCOs korte underenheder flytter ind i grønkornets stroma, hvor de samles med de lange enheder.
- ^ De kemiske processer, der bliver katalyseret af RuBisCO, beskrives online i Stryer m.fl.s lærebog
- ^ Se Hadi Farazdaghi: Modeling Rubisco Reaction with a New Two-Substrate Ordered Model Arkiveret 24. september 2009 hos Wayback Machine
- ^ Figur 20.14 i lærebogen af Stryer m.fl. viser den lysafhængige bevægelse af brint- og magnesiumioner, som er vigtig for lysreguleringen af Calvins cyklus. Flytningen af protoner ind i tylakoiderne er lysdrevet, og den er grundlæggende for ATP-syntasen i grønkornene.
- ^ A. R. Portis. Jr: Rubisco aktivase—Rubisco's catalytic chaperone. i Photosynthesis Research, 2003, volumebd. 75, side 11–27. (se: et abstract af artiklen]).
- ^ S. H. Jin, D. A. Jiang, X. Q. Li and J. W. Sun: Characteristics of photosynthesis in rice plants transformed with an antisense Rubisco aktivase gene. Transgene planter, der blev genmanipuleret, sådan at de havde nedsatte niveauer af RuBisCO-aktivase, viste sig at have nedsat fotosyntese (se: et abstract af artiklen).
- ^ "Hadi Farazdaghi: A Theory and Model for the Kinetics of the Two-Substrate Ordered Reaction of Rubisco with Rate-Determining Steps, and the Effects of RuBP Regeneration on the Hierarchy of Limitations". Arkiveret fra originalen 5. december 2008. Hentet 11. november 2008.
- ^ P. J. Andralojc, G. W. Dawson, M. A. Parry og A. J. Keys: Incorporation of carbon from photosynthetic products into 2-carboxyarabinitol-1-phosphate and 2-carboxyarabinitol. i Biochemical Journal, 1994, bd. 304, side 781–6. (se teksten online Arkiveret 22. februar 2021 hos Wayback Machine).
- ^ "Hadi Farazdaghi: Modeling Rubisco Reaction with a New Two-Substrate Ordered Model". Arkiveret fra originalen 24. september 2009. Hentet 11. november 2008.
- ^ S. J. Crafts-Brandner og M. E. Salvucci: Rubisco aktivase constrains the photosynthetic potential of leaves at high temperature and CO2 i Proceedings of the National Academy of Science USA, 2000, bd. 97, side 12937–8. (se hele teksten online Arkiveret 22. februar 2021 hos Wayback Machine).
- ^ S. Khan, P. J. Andralojc, P. J. Lea og M. A. Parry: 2'-carboxy-D-arabitinol 1-phosphate protects ribulose 1, 5-bisphosphate carboxylase/oxygenase against proteolytic breakdown i European Journal of Biochemistry, 1999, bd. 266, side 840–7. (se hele teksten online
- ^ N. Zhang, R. Kallis, R. G. Ewy og A. R. Portis, Jr.: Light modulation of Rubisco in Arabidopsis requires a capacity for redox regulation of the larger Rubisco aktivase isoform. i Proceedings of the National Academy of Science USA, 2002, bd. 99, side 3330–4 (se hele teksten online Arkiveret 1. august 2013 hos hos Archive.is).
- ^ Yehouda Marcus og Michael Gurevitz: Activation of cyanobacterial RuBP-carboxylase/oxygenase is facilitated by inorganic fosfat via two independent mechanisms i European Journal of Biochemistry, 2000, bd. 267, side 5995–6003. (se hele teksten online)
- ^ R. J. Spreitzer og M. E. Salvucci Rubisco: structure, regulatory interactions, and possibilities for a better enzymei Annual Review of Plant Biology, 2003 bind 53, side 449–75 (se teksten online)
- ^ M. A. Parry, P. J. Andralojc, R. A. Mitchell, P. J. Madgwick og A. J. Keys: Manipulation of Rubisco: the amount, activity, function and regulation i Journal of Experimental Botany, 2003 bd. 54, side 1321–33. (se teksten online)
- ^ S.M. Whitney og T. J. Andrews: (2001). Plastome-encoded bacterial ribulose-1,5-bisphosphate carboxylase/oxygenase (RubisCO) supports photosynthesis and growth in tobacco i Proceedings of the National Academy of Sciences of the United States of America, 2001, bd. 98(25) (se teksten online)
- ^ T.J. Andrews og S. M. Whitney: Manipulating ribulose bisphosphate carboxylase/oxygenase in the chloroplasts of higher plants i Archives of Biochemistry and Biophysics, 2003, bd. 414(2) side 159-169 (se teksten online)
- ^ G. G. Tcherkez, G. D. Farquhar og T. J. Andrews: Despite slow catalysis and confused substrate specificity, all ribulose bisphosphate carboxylases may be nearly perfectly optimized i Proceedings of the National Academy of Sciences of the United States of America, 2006), bd. 103(19) (se teksten online)
- ^ Steven Gutteridge og John Pierce: A unified theory for the basis of the limitations of the primary reaction of photosynthetic CO2 fixation: Was Dr. Pangloss right?
- ^ S. von Caemmerer og G.D. Farquhar: Some relationships between the biochemistry of photosynthesis and the gas exchange of leaves i Planta, 1981, bd. 53 side 376-387.
Litteratur
[redigér | rediger kildetekst]- H. Sugawara, H. Yamamoto, N. Shibata, T. Inoue, S. Okada, C. Miyake, A. Yokota og Y. Kai: Crystal structure of carboxylase reaction-oriented ribulose 1, 5-bisphosphate carboxylase/oxygenase from a thermophilic red alga,"Galdieria partita", i Journal of Biological Chemistry, 1999, bd. 274, side 15655–61. (Se teksten online Arkiveret 10. april 2008 hos Wayback Machine).
- A.R. Portis Jr. og M.A.J. Parry: Discoveries in Rubisco (Ribulose 1,5-bisphosphate carboxylase/oxygenase): a historical perspective i Photosynthesis Research 2007, bd. 94, side 121–43. (se teksten online).