T-formet molekylær geometri
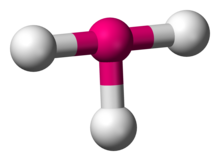
I kemi er 'T-formet molekylær geometri et molekyle med et centralt atom og tre ligander, der er placeret i en T-form, i stedet for de mere normale konfigurationer trigonal plan eller pyramidal. Eksempler på T-formede molekyler er halogen-triflourider som ClF3.[1]
Ifølge VSEPR-teori opstår T-formet geometri når to lonepair bliver bundet til det centrale atom, hvilket skrives i AXE-notation som AX3E2. Den T-formede geometri minder om trigonal bipyramidal molekylær geometri for AX5 molekyler med tre ækvatoriale og to axiale ligander. I et AX3E2 molekyle, de to lonepair optager to af de ækvatoriale placeringer, og de tre ligand-atomer optager to axiale positioner samt én ækvatoriale placerng. Tre atomer har en bindingsvinkel på 90° grader på den ene side af atomet og danner en T-form.[2]
Trifluoroxenat(II) anion, XeF3−, er blevet undersøgt som værende det første eksempel på et AX3E3 molekyle, der kan forventes ved VSEPR-teori at have seks elektronpar i en oktahedral-placering hvor alle tre lonepair og alle tre ligander i mer eller T-formet placering.[3] Selvom anionen er blevet identificeret i gasfasen har forsøg på at syntetisere den i opløsning og bestemme den eksperimentelle struktur ikke været succesfulde. Et beregningskemisk studie viste et forvrænget Y-formet geometri med, hvor den meste F–Xe–F bindingsvinkel var 69°, frem for 90° som i den T-formede geometri.[3]
Se også
[redigér | rediger kildetekst]Referencer
[redigér | rediger kildetekst]- ^ Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (2nd udgave). Oxford: Butterworth-Heinemann. ISBN 978-0-7506-3365-9.
- ^ Housecroft, C. E.; Sharpe, A. G. (2004). Inorganic Chemistry (2nd ed.). Prentice Hall. p. 47. ISBN 978-0-13-039913-7.
- ^ a b Vasdev, Neil; Moran, Matthew D.; Tuononen, Heikki M.; Chirakal, Raman; Suontamo, Reijo J.; Bain, Alex D.; Schrobilgen, Gary J. (2010). "NMR Spectroscopic Evidence for the Intermediacy of XeF3− in XeF2/F− Exchange, Attempted Syntheses and Thermochemistry of XeF3− Salts, and Theoretical Studies of the XeF3− Anion". Inorg. Chem. 49 (19): 8997-9004. doi:10.1021/ic101275m. PMID 20799721. S2CID 25413351.
Eksterne henvisninger
[redigér | rediger kildetekst]- Chem| Chemistry, Structures, and 3D Molecules (Webside ikke længere tilgængelig)
- Indiana University Molecular Structure Center
- Interactive molecular examples for point groups
- Molecular Modeling
- Animated Trigonal Planar Visual