Benzylisochinolin
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Benzylisochinolin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C16H13N | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 219,28 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
1,0961 g·cm−3[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
350,10 °C[1] | ||||||||||||
| Brechungsindex |
1,7020[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||
1-Benzylisochinolin ist eine chemische Verbindung, bei der der Isochinolin-Heterocyclus an der C1-Position durch eine Benzylgruppe substituiert wurde. Die Benzylisochinolin-Einheit ist Bestandteil vieler pharmazeutisch genutzter Substanzen, der sogenannten Benzylisochinoline, zu denen die peripheren Muskelrelaxanzien Atracurium, Cisatracurium, Mivacurium und Tubocurarin gehören. Am häufigsten ist sie jedoch in den Benzylisochinolinalkaloiden zu finden, die in Naturstoffen vorkommen.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Benzylisochinolin kann durch eine Alkylierung von Isochinolin synthetisiert werden. Dabei wird zunächst Isochinolin in Dichlormethan mit Kaliumcyanid und Benzoylchlorid zum 2-Benzoyl-1,2-dihydro-1-isochinolincarbonitril[3] umgesetzt. Im Folgeschritt wird diese Zwischenstufe mit Natriumhydrid in Dimethylformamid und Benzylchlorid alkyliert. Ohne Zwischenisolierung erhält man daraus nach der alkalischen Aufarbeitung das Benzylisochinolin.[4]
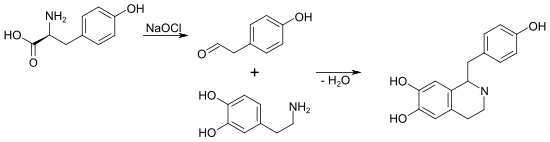
Eine weitere Syntheseroute zu Benzylisochinolin-Derivaten und Benzylisochinolin-Alkaloiden geht von L-Tyrosin aus. Dazu wird dieses mit Natriumhypochlorit zum 4-Hydroxyphenylacetaldehyd desaminiert. 4-Hydroxyphenylacetaldehyd wird mit Dopamin, das ebenfalls aus Tyrosin zugänglich ist, in Gegenwart von Norcoclaurin-Synthase als Katalysator unter Wasserabspaltung zu (S)-Norcoclaurin umgesetzt.[5]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Carl L. Yaws: The Yaws Handbook of Physical Properties for Hydrocarbons and Chemicals:. Physical Properties for More Than 54,000 Organic and Inorganic Chemical Compounds, Coverage for C1 to C100 Organics and Ac to Zr Inorganics. 2. Auflage. Elsevier, 2015, ISBN 978-0-12-800834-8, S. 512 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2-Benzoyl-1,2-dihydro-1-isochinolincarbonitril: CAS-Nr.: 844-25-7, PubChem: 230488, ChemSpider: 200754, Wikidata: Q82016570.
- ↑ Barrie C. Uff, John R. Kershaw, John L. Neumeyer: Alkylation of Benzylisoquinolines via 2-Benzoyl-1,2-Dihydroisoquinaldonitriles: 1-Benzylisoquinoline In: Organic Syntheses. 56, 1977, S. 19, doi:10.15227/orgsyn.015.0014; Coll. Vol. 6, 1988, S. 115 (PDF).
- ↑ Francesca Ghirga, Alessandra Bonamore, Lorenzo Calisti, Ilaria D’Acquarica, Mattia Mori, Bruno Botta, Alberto Boffi und Alberto Macone: Green Routes for the Production of Enantiopure Benzylisoquinoline Alkaloids. In: International Journal of Molecular Sciences. 20. November 2017, doi:10.3390/ijms18112464, PMID 29156609.