Gasbrand
| Klassifikation nach ICD-10 | |
|---|---|
| A48.0 | Gasbrand (Gasödem) |
| ICD-10 online (WHO-Version 2019) | |

Gasbrand (Synonyme: Gasgangrän, Gasödem, Gasphlegmone, Clostridium-Myositis, Clostridium-Zellulitis, clostridiale Myonekrose, malignes Ödem) ist eine schnell hervorgerufene, infektiös-toxische und extrem gefährliche Infektionskrankheit. Ursächlich ist eine lokale Weichteilinfektion mit gasbildenden, anaeroben Clostridien (insbesondere C. perfringens), die überall (omnipräsent) in Form von Sporen im Erdreich und der sonstigen Umwelt vorkommen.
Heute kann durch zügige chirurgische und antibiotische Behandlung von Wunden ein für die Infektion zwingend notwendiges anaerobes Wund-Milieu vermieden und damit dem Gasbrand vorgebeugt werden. Nach Naturkatastrophen kommt es allerdings durch verspätete Wundversorgung nach wie vor (ebenso wie in manchen Kriegsgebieten[1]) zu sehr hohen Infektionszahlen.[2]
Abzugrenzen vom typischen Gasbrand sind eitrige Mischinfektionen, die ebenfalls mitunter Gas bilden können (beispielsweise nekrotisierende Fasziitis oder nicht durch Clostridien verursachte Zellulitis), aber primär und hauptsächlich nicht die Muskulatur zersetzen, eine andere Symptomatik aufweisen und auch eine bessere Prognose haben.
Erreger
[Bearbeiten | Quelltext bearbeiten]Die hier bedeutsamen Clostridien-Arten (Clostridium perfringens (90 % der Fälle), Clostridium novyii, Clostridium septicum, Clostridium histolyticum)[3][4] kommen in der Natur überall (ubiquitär) vor. Sie sind obligat anaerobe grampositive Sporenbildner, die auch im menschlichen Darm zu finden sind, wo sie aber unter normalen Bedingungen nicht pathogen (krankheitserregend) sind.
Die Pathogenität ergibt sich erst mit dem Wechsel der Umweltbedingungen auf ein anaerobes Milieu (Sauerstoffmangel), wie es in zerstörtem Weichteilgewebe mit verringertem Sauerstoffpartialdruck existiert.
Pathogenese
[Bearbeiten | Quelltext bearbeiten]Meistens sind verletzungsbedingt stark verschmutzte, zerstörte und zerklüftete Gewebebereiche der Ort, an dem die Clostridien ihre Pathogenität erlangen, wo sich also aus Sporen Bakterien entwickeln, die sich dann vermehren.
Grundlegend ist der Sauerstoffmangel (Clostridien sind anaerobe Erreger). Begünstigend sind die Minderdurchblutung durch Weichteilquetschung, Gewebeuntergang (Nekrosen), Schock, Begleiterkrankungen wie Diabetes mellitus und bösartige Tumoren. Zusätzlich bringt die Verschmutzung der Wunde eine Infektion mit aeroben (sauerstoffverbrauchenden) Erregern mit sich, was den Sauerstoffmangel im infizierten Gewebe fördert und die Lebensbedingungen für die Clostridien verbessert.
Clostridien bilden außer CO2 verschiedene Exotoxine, die im umgebenden Gewebe eine Zellmembranzerstörung und Ödembildung bewirken und somit im Sinne eines Teufelskreises (Circulus vitiosus) weiteren Nährboden für den Erreger zur Verfügung stellen. Zusätzlich wirken Exotoxine von Clostridien auf weiße Blutkörperchen (Leukozyten) funktionshemmend bis abtötend. Sie fördern zudem den Verschluss kleiner Blutgefäße durch Thrombosen, was den Sauerstoffmangel im betroffenen Gewebe durch eine Durchblutungsstörung weiter verstärkt und das für die Clostridien optimale Wachstumsmilieu fördert.
Symptome
[Bearbeiten | Quelltext bearbeiten]
Nach einer Inkubationszeit von 5 bis 48 Stunden fällt nach Operationen oder Weichteilverletzungen eine sich rasch ausbreitende Wundinfektion auf (Rötung, Hitze im Wundbereich), die extrem schmerzhaft ist.
In den meisten Fällen ist beim Betasten (Palpieren) der Wundumgebung ein auffälliges Knistern zu hören und zu fühlen: ein Hautemphysem durch CO2-Bildung (Hautkrepitation).
Aus Drainagen entleert sich oft ein blutig-schwärzliches, schaumiges, süßlich-faulig riechendes Sekret. Die befallene Muskulatur ist von grauroter Farbe und ähnelt gekochtem Rindfleisch.
Der Allgemeinzustand des Patienten ist gekennzeichnet durch ein rasch fortschreitendes septisches Krankheitsbild, mit Tachykardie, Verbrauchskoagulopathie (Blut-Gerinnungsstörung), Kreislaufstörung, Atemstörungen und hämolytischer Anämie durch die Zersetzung roter Blutkörperchen mittels Toxinen der Clostridien. Hinzu kommen akutes Nierenversagen und Leberfunktionsstörungen (Multiorganversagen).
Diagnose
[Bearbeiten | Quelltext bearbeiten]Aufgrund des schnellen und tödlichen Verlaufs der unbehandelten Krankheit und der Notwendigkeit einer sofortigen, aber zugleich eingreifenden Therapie bis zur Amputation von Extremitäten muss die Diagnose unverzüglich und sicher gestellt werden. Für das klinische Bild eines Gasbrandes müssen alle drei folgenden Kriterien erfüllt sein:
- Starker Wundschmerz
- Rasch zunehmende Weichteilschwellung, eventuell Zeichen einer Gasansammlung im Gewebe
- Beschleunigter Herzschlag (Tachykardie)
Die Gasbildung im Gewebe erscheint im Röntgengebilde typischerweise als „gefiederte“ Muskulatur. Sind alle Kriterien erfüllt, so sollte als Nächstes die Infektionsursache ermittelt werden. Dabei muss ein exogener Gasbrand von einem endogenen unterschieden werden.
Ein exogener Gasbrand kann auftreten nach:
- Verletzung mit stark verschmutzter Wunde oder offenen Frakturen
- Amputation und gefäßchirurgischen Eingriffen
- Punktionen und Injektionen
An einen endogenen Gasbrand muss gedacht werden bei:
- peripheren arteriellen Durchblutungsstörungen (pAVK)
- diabetischer Gangrän (abgestorbenes, schwarzes Gewebe)
- Bestimmten Darmerkrankungen, zum Beispiel Dickdarmkarzinom mit Besiedelung durch Clostridium septicum
- Bestimmten Bauchoperationen mit nachfolgender unklarer Schmerz- und Sepsis-Symptomatik, insbesondere nach Gallenblasenoperation[5] und Darmoperationen.
- Septischem Abort (infizierte Fehlgeburt)
Der klinische Verdacht muss bewiesen werden. Dieses geschieht entweder mit einem direkten Erregernachweis oder dem histologischen Nachweis charakteristischer Veränderungen in Gewebeproben von Muskeln. Für den direkten Erregernachweis kommen drei Methoden infrage:
- Bakterioskopie (mikroskopischer Nachweis der Bakterien im Muskelquetschpräparat)
- Mikrobiologie: Erregeranzüchtung aus verdächtigen Wundarealen, infizierter Muskulatur oder Blutkultur
- PCR (Nukleinsäure-Nachweis)
Typische Merkmale einer Gasbrand-infizierten Muskulatur sind der schollige Zerfall, ein leukozytenarmes Ödem und Gaseinschlüsse.[6]
Therapie
[Bearbeiten | Quelltext bearbeiten]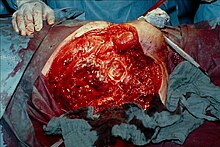
Die Therapie des Gasbrands steht auf vier Säulen:
- Chirurgische Intervention (Operation)
- Antibiotische Therapie (mit Penicillin G und Clindamycin oder Metronidazol)[7]
- Hyperbare Oxygenierung
- Intensivmedizin
Die Therapie muss bereits bei Verdacht beginnen.
Chirurgische Intervention
[Bearbeiten | Quelltext bearbeiten]Ziele des chirurgischen Eingriffs:
- Verringerung der Toxinlast durch Beseitigung allen infizierten Gewebes. Obwohl grundsätzlich erwünscht ist, den Körper möglichst ohne bleibende Schäden zu erhalten, muss zur Rettung des Patientenlebens auch eine Gliedmaßenamputation ernsthaft in Erwägung gezogen werden.
- Beseitigung des Sauerstoffmangels im infizierten Gewebe, um durch Änderung des Wundmilieus den Erregern die Lebensgrundlage zu entziehen. Besonders am Körperstamm, wo eine Amputation technisch unmöglich ist, aber auch an Extremitäten, die man nicht opfern will, werden Débridement und Gewebespaltungen durchgeführt, die zu einer Druckentlastung mit verbesserter Durchblutung führen.
Aufgrund von Dramatik und Gefährlichkeit des Krankheitsverlaufs wird oft der Lebenserhaltung Vorrang vor dem kosmetischen und sogar dem funktionellen Ergebnis eingeräumt.
Antibiotika-Therapie
[Bearbeiten | Quelltext bearbeiten]Die antibiotische Therapie muss eingeleitet werden, bevor das Ergebnis eines Antibiogramms bekannt ist. Aufgrund der zumeist vorliegenden Mischinfektion werden Kombinationen von hochdosierten Breitbandantibiotika und Antibiotika mit Wirksamkeit gegen Anaerobier eingesetzt. Eine Beispielkombination nach dieser Grundlage ist Penicillin G und Metronidazol.
Hyperbare Oxygenierung
[Bearbeiten | Quelltext bearbeiten]Der Gasbrand ist eine Standardindikation für den Einsatz von Sauerstoff-Überdruckkammern.
Diese Therapie zielt darauf ab, durch extrem hohe Sauerstoffpartialdrücke in der umgebenden Atmosphäre mittels Diffusion den O2-Partialdruck im infizierten Gewebe zu erhöhen. So entzieht man dem obligat anaeroben Keim die Lebensgrundlage und erhofft sich mit dieser eleganten, aber logistisch anspruchsvollen Behandlung eine Rettung des Lebens und die Erhaltung von Extremitäten.
Ein Problem dabei ist der Zeitfaktor. Schwer Erkrankte sind kaum transportfähig und Überdruckkammern sind selbst unter Einschluss kooperierender militärischer Einrichtungen rar. Deutschlandweit existieren zwar 25 dieser Kammern, jedoch nur 4 verfügen über eine 24-Stunden-Intensivbereitschaft.[8][9] Initial bleibt häufig nur eine aggressive chirurgische Maßnahme.
Intensivmedizin
[Bearbeiten | Quelltext bearbeiten]Bedingt durch Wirkungen der Exotoxine des Erregers kommt es zum Multiorganversagen. Zur stabilisierenden Behandlung der Patienten werden häufig Beatmung, Therapie mit Katecholaminen und weitere intensivmedizinische Therapie- und Überwachungsmethoden nötig.
Meldepflicht
[Bearbeiten | Quelltext bearbeiten]Nach dem Recht Sachsens besteht eine namentliche Meldepflicht bezüglich Erkrankung und Tod an Gasbrand.[10] Nach dem Recht Thüringens besteht eine nichtnamentliche Meldepflicht bezüglich Erkrankung und Tod an Gasbrand.[11]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Vgl. etwa Richard Bieling, Martin Nordmann: Kriegserfahrungen zur Pathologie und Therapie des Gasbrandes (= Veröffentlichungen aus der Konstitutions- und Wehrpathologie. Heft 47). Gustav Fischer, Jena 1941.
- ↑ Yue Wang, Bo Lu, Peng Hao, Meng-ning Yan, Ke-rong Dai: Comprehensive treatment for gas gangrene of the limbs in earthquakes. In: Chinese Medical Journal. Band 126, Nr. 20, Oktober 2013, ISSN 0366-6999, S. 3833–3839, PMID 24157141.
- ↑ Helmut Hahn, Stefan H. E. Kaufmann, Thomas F. Schulz, Sebastian Suerbaum: Medizinische Mikrobiologie und Infektiologie. 3. Auflage. Springer Berlin Heidelberg, Berlin/Heidelberg 1999, ISBN 978-3-662-08629-2, S. 357.
- ↑ Birgid Neumeister, Heinrich K. Geiss, Rüdiger Braun, Peter Kimmig: Mikrobiologische Diagnostik: Bakteriologie – Mykologie – Virologie – Parasitologie. Georg Thieme Verlag, 2. Auflage, Stuttgart 2009, ISBN 978-3-13-157942-3, S. 542.
- ↑ Benjamin Sommer, Stefan Eggstein: Klinischer Schnappschuss: Gasbrand der Gallenblase. In: Deutsches Ärzteblatt. Band 117, Heft 3, 17. Januar 2020, S. 38
- ↑ Robert Koch-Institut: Falldefinitionen für die Gesundheitsbehörden der Länder, in denen zusätzlich zum IfSG eine Meldepflicht für weitere Krankheiten besteht. Robert Koch-Institut, 2009, abgerufen am 8. März 2019.
- ↑ Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 159.
- ↑ Isolde Stöcker-Gietl: Regensburg hat wieder eine Druckkammer. Mittelbayerische Zeitung, archiviert vom am 21. Oktober 2015; abgerufen am 10. November 2015.
- ↑ Notfallzentren für Tauchunfälle und andere (Notfall-) Indikationen für die HBOT. Gesellschaft für Tauch- und Überdruckmedizin, archiviert vom am 14. Juli 2014; abgerufen am 19. November 2023.
- ↑ § 1 Abs. 1 Nr. 7 Sächsische Infektionsschutz-Meldeverordnung. Vollzitat: Sächsische Infektionsschutz-Meldeverordnung vom 19. Juli 2024 (SächsGVBl. S. 745). In: revosax.sachsen.de. Abgerufen am 22. Oktober 2024 (Fassung gültig ab: 17. August 2024).
- ↑ Thüringer Verordnung über die Anpassung der Meldepflicht für Infektionskrankheiten (Thüringer Infektionskrankheitenmeldeverordnung – ThürIfKrMVO -) Vom 15. Februar 2003. Fundstelle: GVBl. 2003, 107. (Zum 17. November 2020 aktuell verfügbare Fassung der Gesamtausgabe, Stand: letzte berücksichtigte Änderung: zuletzt geändert durch Verordnung vom 4. Februar 2015 (GVBl. S. 3)).