Glucose-6-Phosphatase
| Glucose-6-Phosphatase | ||
|---|---|---|
| Masse/Länge Primärstruktur | 357 Aminosäuren | |
| Isoformen | G6Pase, G6Pase-2, G6Pase-3 | |
| Bezeichner | ||
| Gen-Name(n) | G6PC, G6PC2, G6PC3 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 3.1.3.9, Phosphatase | |
| Reaktionsart | Hydrolyse einer Phosphorsäureester-Bindung | |
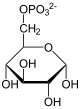
| Substrat | D-Glucose-6-phosphat + H2O | |
| Produkte | D-Glucose + Phosphat | |
| Vorkommen | ||
| Homologie-Familie | G6Pase | |
| Übergeordnetes Taxon | Euteleostomi | |
Glucose-6-Phosphatase (Abk.: G6Pase, Gen: G6PC) ist der Name des Enzyms, das die Abspaltung von Phosphat von Glucose-6-phosphat (G6P) katalysiert. Diese Reaktion ist ein unentbehrlicher Teilschritt mehrerer Energiestoffwechselwege in Wirbeltieren. Im Menschen werden drei Isoformen des Enzyms produziert, die von den Genen G6PC, G6PC2 und G6PC3 codiert werden; die entsprechenden Enzyme heißen G6Pase, G6Pase-2 und G6Pase-3. G6Pase ist beim Menschen in der Leber, den Nieren und in geringen Mengen im Darm anzutreffen, G6Pase-2 ist spezifisch in Inselzellen lokalisiert, die Enzymaktivität der G6Pase-3 ist zweifelhaft. Mutationen in G6PC sind verantwortlich für von-Gierke-Krankheit Typ Ia, und Variationen in G6PC2 sind assoziiert mit hohem Glucoselevel während des Fastens (FGQTL1, >5,55 mmol/l Glucose), einem Risikofaktor für Diabetes mellitus; Mangel an G6PC-3 schließlich kann zu schwerer familiärer Neutropenie Typ 4 (SCN4) führen.[1]
Die G6Pasen sind Membranproteine im endoplasmatischen Reticulum (ER), die zusammen mit Glucose-6-phosphat-Translokase einen Proteinkomplex bilden. Dieser Komplex sorgt gleichzeitig für das Einfließen von G6P ins Innere (Lumen) des ER, und für die Hydrolyse von G6P zu Glucose und Phosphat. Schlussendlich wird die Glucose aus dem ER transportiert, der genaue Mechanismus ist aber noch unbekannt (2008).[1][2]
Katalysierte Reaktion
[Bearbeiten | Quelltext bearbeiten]G6P wird zu Glucose hydrolysiert. Die Reaktion ist praktisch irreversibel.[3]
Die Reaktion ist Teilschritt der Gluconeogenese.
Literatur
[Bearbeiten | Quelltext bearbeiten]- R. M. Cohn, R. H. Herman, D. Zakim: Glucose 6-phosphatase: a multifunctional enzyme. In: Am. J. Clin. Nutr. 22. Jahrgang, Nr. 9, September 1969, S. 1204–10, PMID 4309941.