Glycerinaldehyd
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Fischer-Projektion, offenkettige Darstellung | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Glycerinaldehyd | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H6O3 | ||||||||||||||||||
| Kurzbeschreibung |
farbloses Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 90,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,46 g·cm−3 (D,L-Form)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Glycerinaldehyd ist eine süß schmeckende, chemische Verbindung, die in wasserfreiem Zustand einen kristallinen Feststoff bildet. Es gehört zur Stoffgruppe der Zucker und innerhalb dieser zur Untergruppe der Triosen. Bezüglich des molekularen Baus handelt es sich um den einfachsten denkbaren Einfachzucker. Die physiologische Bedeutung der Verbindung ist groß, da es sich um einen Grundstoff des Stoffwechsels handelt, aus dem die Zelle sehr viele weitere Stoffe zu bilden vermag. Glycerinaldehyd besitzt mit C3H6O3 dieselbe Summenformel wie das strukturisomere Dihydroxyaceton.
Isomerie
[Bearbeiten | Quelltext bearbeiten]Glycerinaldehyd enthält ein Chiralitätszentrum, es gibt zwei Enantiomere, die mit D-Glycerinaldehyd [Synonym: (R)-Glycerinaldehyd] und L-Glycerinaldehyd [Synonym: (S)-Glycerinaldehyd] bezeichnet werden. Wenn in diesem Text oder in der wissenschaftlichen Literatur „Glycerinaldehyd“ ohne weiteren Namenszusatz (Deskriptor) erwähnt wird, ist meist D-Glycerinaldehyd gemeint.
| Isomere von Glycerinaldehyd | ||
| Name | D-Glycerinaldehyd | L-Glycerinaldehyd |
| Andere Namen | (R)-Glycerinaldehyd | (S)-Glycerinaldehyd |
| Fischer-Projektion | 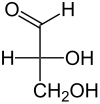
|

|
| Keilstrichformel | 
|

|
| CAS-Nummer | 453-17-8 | 497-09-6 |
| 56-82-6 (unspez.) | ||
| EG-Nummer | 207-217-1 | 207-836-7 |
| 200-290-0 (unspez.) | ||
| ECHA-Infocard | 100.006.562 | 100.007.125 |
| 100.000.264 (unspez.) | ||
| PubChem | 79014 | 439723 |
| 751 (unspez.) | ||
| DrugBank | DB02536 | – |
| – (unspez.) | ||
| Wikidata | Q27093516 | Q27103431 |
| Q423211 (unspez.) | ||
Besonderer historischer Stellenwert in der Stereochemie
[Bearbeiten | Quelltext bearbeiten]Glycerinaldehyd kommt in der Wissenschaftsgeschichte eine besondere Rolle zu, da mit einer Vereinbarung, die diese Verbindung betraf, auch die Konfiguration (also die räumliche Anordnung der Substituenten) anderer chiraler Moleküle angegeben werden konnte.
Ohne die tatsächliche räumliche Anordnung der Hydroxygruppen am Glycerinaldehyd zu kennen, wurde folgendes vereinbart: Dasjenige Glycerinaldehyd-Enantiomer, das linear polarisiertes Licht nach rechts dreht, bekam die Konfiguration D zugeordnet (D steht für dexter, lat. für rechts). Demnach wurde angenommen, dass die Hydroxygruppe am Chiralitätszentrum in der Fischer-Projektion nach rechts zeigt. (Näheres: siehe Fischer-Projektion). Das Glycerinaldehyd-Enantiomer, das linear polarisiertes Licht nach links dreht, bekam willkürlich die Konfiguration L zugeschrieben. Man hätte die Zuordnung auch andersherum wählen können, denn absolute Konfiguration und die Drehrichtung können genauso gut voneinander abweichen (Beispiel: L-Milchsäure dreht linear polarisiertes Licht nach rechts.)
Mit dieser Vereinbarung konnte die Konfiguration anderer chiraler Moleküle angegeben werden: Man überführte die zu prüfende Verbindung (z. B. Milchsäure) durch chemische Reaktionen in Glycerinaldehyd, ohne dabei die Konfiguration am Chiralitätszentrum zu verändern. Drehte die so entstandene Verbindung linear polarisiertes Licht nach links, so wusste man, dass es sich laut Konvention um L-Glycerinaldehyd handelt. Daraus konnte man schlussfolgern, dass auch die Ausgangsverbindung die L-Konfiguration besaß, da die chemischen Reaktionen unter Erhalt der Konfiguration durchgeführt wurde (z. B. L-Milchsäure).
Erst nach Einführung der Röntgenstrukturanalyse konnte die tatsächliche Konfiguration experimentell überprüft werden. Es zeigte sich, dass die Zuordnung (linksdrehendes Glycerinaldehyd → L-Konfiguration, rechtsdrehendes Glycerinaldehyd → D-Konfiguration) zufälligerweise übereinstimmend mit der Fischer-Projektion gewählt wurde.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Glycerinaldehyd und ein Derivat – Glycerinaldehyd-3-phosphat – sind weit verbreitet, es sind Schlüsselstoffe des Zellstoffwechsels.
Molekülbau und optische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Glycerinaldehyd ist eine optisch aktive Verbindung mit einem Chiralitätszentrum am mittleren C-Atom. Je nach räumlicher Anordnung der Substituenten an diesem Chiralitätszentrum existieren zwei Verbindungen, deren Moleküle sich untereinander wie Bild und Spiegelbild verhalten. Die beiden Enantiomere werden, wie bei Zuckern üblich, entsprechend der Fischer-Projektion meist als D-Glycerinaldehyd und L-Glycerinaldehyd bezeichnet. Mit der Cahn-Ingold-Prelog-Konvention erhält man (R)-Glycerinaldehyd[4] für das D-Glycerinaldehyd bzw. (S)-Glycerinaldehyd für das L-Glycerinaldehyd. L-Glycerinaldehyd dreht linear polarisiertes Licht nach links, D-Glycerinaldehyd hingegen nach rechts.
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Durch geeignete Oxidationsmittel kann die Aldehyd-Gruppe (–CHO) zur Carboxygruppe (–COOH) oxidiert werden. Dabei geht die Verbindung in Glycerinsäure über.
Glycerinaldehyd isomerisiert basenkatalysiert in der Lobry-de-Bruyn-Alberda-van-Ekenstein-Umlagerung sowohl zu Dihydroxyaceton als auch von der D-Form in die L-Form. Es liegt also Gleichgewichtsreaktion zwischen D- und L-Glycerinaldehyd und dem nicht-chiralen Dihydroxyaceton vor. In folgender Abbildung steht der Rest –R für die Gruppe –CH2–OH:
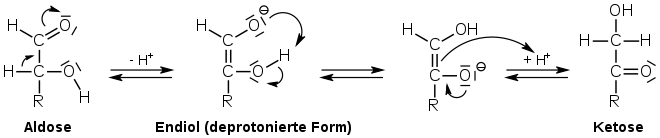
Entsprechend steht auch Glycerinaldehyd-3-phosphat mit Dihydroxyacetonphosphat im Gleichgewicht. In der Zelle werden die Gleichgewichtseinstellungen durch bestimmte Enzyme katalysiert.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Glycerinaldehyd kann am einfachsten durch katalytische Umpolung von Formaldehyd hergestellt werden.[5]

Im Labor kann es genauso wie sein Isomer Dihydroxyaceton durch Oxidation von Glycerin mit Wasserstoffperoxid und einem Eisensalz als Katalysator dargestellt werden. Dihydroxyaceton und Glycerinaldehyd können durch ihre unterschiedlichen Löslichkeiten in Wasser getrennt werden.
Nachweis
[Bearbeiten | Quelltext bearbeiten]Die Aldehydgruppe des Glycerinaldehyds lässt sich durch die Fehling-Probe, die Tollensprobe oder durch die Schiffsche Probe nachweisen.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Eintrag zu Glyceraldehyd. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Juni 2014.
- ↑ a b c The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, ISBN 978-0-911910-00-1, S. 774.
- ↑ Datenblatt DL-Glyceraldehyde, ≥90 % (GC) bei Sigma-Aldrich, abgerufen am 15. Februar 2013 (PDF).
- ↑ Axel Schunk, CCC, Univ. Erlangen, 09/1999: Vernetzte Chemie: R,S-Nomenklatur. Abgerufen am 28. Januar 2018.
- ↑ Patent DE4212264A1: Verfahren zur katalytischen Herstellung von Kondensationsprodukten des Formaldehyds. Veröffentlicht am 1992.