Homocystein
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Strukturformel von L-Homocystein | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | L-Homocystein | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H9NO2S | ||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 135,18 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
L-Homocystein (Hcy) (ausgesprochen: Homo-cyste-ín) ist eine natürlich vorkommende, aber nicht proteinogene α-Aminosäure. Sie ist im Stoffwechsel ein Zwischenprodukt des Ein-Kohlenstofftransfers und entsteht durch S-Demethylierung von L-Methionin als Methyldonor. Im Vergleich zum proteinogenen Cystein enthält Homocystein eine zusätzliche Methylengruppe. Erhöhte Blutwerte für Homocystein (Homocysteinämie) können eine Schädigung der Blutgefäße zur Folge haben. Es steht auch in engem Zusammenhang mit Depressionen und Demenzerkrankungen im Alter. Normale Laborwerte bei der Blutuntersuchung liegen zwischen 5 und 10 µmol·l−1. Zur Regulierung des Homocysteinspiegels im Blut ist eine ausreichende Versorgung mit Betain und den Vitaminen B12, B6 sowie Methyltetrahydrofolat erforderlich.[3][4] Eine Therapie mit Folsäure zur Krankheitsprävention ist wissenschaftlich umstritten.
Zwei Moleküle Homocystein können sich über eine Disulfidbrücke zum Homocystin verbinden. Bei erhöhtem Homocysteinspiegel im Blut wird Homocystin mit dem Urin ausgeschieden (Homocystinurie).
Geschichte
[Bearbeiten | Quelltext bearbeiten]Homocystein wurde 1932 von Vincent du Vigneaud bei seinen Arbeiten über schwefelhaltige Verbindungen entdeckt. Doch erst 1962 erkannten Carson und Neil den Zusammenhang zwischen Homocystein und bestimmten Erkrankungen. Sie fanden deutlich erhöhte Homocysteinwerte im Urin einer Gruppe von Kindern mit geistiger Behinderung und postulierten einen Enzymdefekt – die klassische Homocystinurie, verursacht durch einen Defekt der Cystathionin-β-Transferase.[5][6][7]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Chemische Eigenschaften
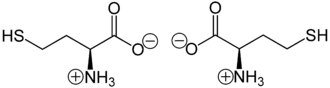
[Bearbeiten | Quelltext bearbeiten]Homocystein liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxygruppe an das einsame Elektronenpaar des Stickstoffatoms der Aminogruppe wandert.
Zwitterionen von L-Homocystein (links) bzw. D-Homocystein (rechts)
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert) der Fall, bei dem das Homocystein auch seine geringste Löslichkeit in Wasser hat. Durch seine im Vergleich zu Cystein zusätzliche CH2-Gruppe kann Homocystein einen fünfgliedrigen heterocyclischen Ring bilden, ein sogenanntes Thiolacton.[8] Diese Cyclisierungsreaktion verhindert die Bildung stabiler Peptidbindungen. Ein Protein, das Homocystein enthält, hat demnach die Tendenz, sich aufzuspalten.
Biochemische Bedeutung
[Bearbeiten | Quelltext bearbeiten]Aus L-Homocystein und Methyl-FH4 kann durch das Enzym Methionin-Synthase die Aminosäure L-Methionin in einer Remethylierung gebildet werden. Die Methionin-Synthase benötigt Vitamin B12 als Coenzym. Alternativ kann Homocystein in Leber und Niere über die Betain-Homocystein-Methyltransferase zu Methionin umgewandelt werden. Coenzym für diese Reaktion ist Betain. Abgebaut wird Homocystein über die Transsulfurierung, einen rein Vitamin-B6-abhängigen Schritt.
L-Methionin wird einerseits zur Proteinsynthese, andererseits zur Bildung von S-Adenosylmethionin (SAM) biochemisch genutzt. SAM ist der wichtigste Donator für Methylgruppen im zellulären Stoffwechsel. Hat es seine Methylgruppe abgegeben, entsteht S-Adenosylhomocystein (SAH), das zu Adenosin sowie L-Homocystein hydrolysiert wird:

SAH hemmt Methylierungsreaktionen, sein Abbau zu Homocystein ist also zwingend notwendig, um Methylierungsreaktionen aufrechterhalten zu können. Ist der Abbau von Homocystein gestört, sind auch die wichtigen Methylierungsreaktionen in der Zelle gestört.[9]
Bedeutung für die Gesundheit
[Bearbeiten | Quelltext bearbeiten]Homocystein kommt natürlicherweise im menschlichen Körper vor. Allerdings führen erhöhte Werte zum Krankheitsbild der Hyperhomocysteinämie. Bereits moderat erhöhte Homocystein-Werte können darüber hinaus das Risiko für Herz-Kreislauferkrankungen erhöhen. Eine Senkung des Homocystein-Spiegels könnte vorbeugend wirken, allerdings gibt es noch keine Studien, die dies belegen.[10]
Erhöhte Homocystein-Werte werden außerdem mit Augenkrankheiten in Verbindung gebracht, insbesondere mit Retinopathie, Pseudoexfoliationssyndrom, Katarakt, Optikusatrophie und Arteriosklerose der Netzhautgefäße;[11] ob auch eine Verbindung zur Makulopathie besteht, ist umstritten.[12]
Bei Vitamin-B12-Mangel ist Homocystein erhöht und kann als Verlaufsparameter für die Therapie eines Vitamin-B12-Mangels verwendet werden (bei effektiver Therapie sollten sich die erhöhten Homocystein-Spiegel wieder normalisieren).[13][14]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Olaf Stanger: Homocystein: Grundlagen, Klinik, Therapie, Prävention. Maudrich, Wien / München / Bern 2004, ISBN 3-85175-766-1.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 5. Auflage. Spektrum Akademischer Verlag, Heidelberg 2003, ISBN 3-8274-1303-6.
- Per Magne Ueland, Helga Refsum, Lars Brattström: 8. Plasma Homocysteine and Cardiovascular Disease. In: Robert Francis (Hrsg.): Atherosclerotic cardiovascular disease, hemostasis, and endothelial function. M. Dekker, New York 1992, ISBN 0-8247-8726-9, S. 183–236 (englisch, uib.no ( vom 20. November 2004 im Internet Archive) [PDF; 2,9 MB]).
- Wolfgang Herrmann, Rima Obeid: Vitamins in the prevention of human diseases. 2011, ISBN 978-3-11-021448-2.
- Wolfgang Herrmann, Rima Obeid: Die obligatorische Folsäurefortifikation von Nahrungsmitteln: Ein in Deutschland kontrovers diskutiertes Thema. The Mandatory Fortification of Staple Foods with Folic Acid: A Current Controversy in Germany. Ärzteblatt-Übersichtsarbeit, doi:10.3238/arztebl.2011.0249
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag zu Homocystein. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Juni 2014.
- ↑ a b Datenblatt DL-Homocysteine bei Sigma-Aldrich, abgerufen am 5. November 2016 (PDF).
- ↑ Deutsches Institut für Ernährungsforschung Potsdam-Rehbrücke: Kombination von niedrigem Vitamin B12- und niedrigem Folat-Spiegel erhöht das Schlaganfallrisiko. Pressemitteilung vom 25. September 2007, abgerufen am 9. Februar 2013.
- ↑ Cornelia Weikert u. a.: B Vitamin Plasma Levels and the Risk of Ischemic Stroke and Transient Ischemic Attack in a German Cohort. In: Stroke. 38, 2007, S. 2912–2918. doi:10.1161/STROKEAHA.107.486068.
- ↑ D. Gruson: Cardiovascular diseases and homocysteine, a short summary of a long story. In: J Int Clin Chem. 14, 2003, S. 3.
- ↑ Vincent du Vigneaud: A Trail of Sulfa Research: From Insulin to Oxytocin. In: Nob Lec. 1955, S. 1–10. (PDF)
- ↑ N. A. Carson, D. W. Neill: Metabolic abnormalities detected in a survey of mentally backward individuals in Northern Ireland. In: Arch. Dis. Child. Band 37, Oktober 1962, S. 505–513, doi:10.1136/adc.37.195.505, PMID 14018926, PMC 2012909 (freier Volltext).
- ↑ H. S. Baernstein: In: Journal of Biological Chemistry. 106, 1934, S. 451.
- ↑ P. Durand, M. Prost, N. Loreau: Impaired homocysteine metabolism and atherothrombotic disease. In: Lab Invest. 81, 2001, S. 645–672. PMID 11351038.
- ↑ Deutsches Grünes Kreuz, abgerufen am 25. November 2015
- ↑ T. A. Ajith, Ranimenon: Homocysteine in ocular diseases. In: Clin. Chim. Acta. Band 450, Oktober 2015, S. 316–21, doi:10.1016/j.cca.2015.09.007, PMID 26343924.
- ↑ A. Pinna, F. Zaccheddu, F. Boscia, C. Carru, G. Solinas: Homocysteine and risk of age-related macular degeneration: A systematic review and meta-analysis. In: Acta Ophthalmol. Band 96, Nr. 3, Mai 2018, S. e269–e276, doi:10.1111/aos.13343, PMID 27966830.
- ↑ S. Rajan, J. I. Wallace, S. A. Beresford, K. I. Brodkin, R. A. Allen, S. P. Stabler: Screening for cobalamin deficiency in geriatric outpatients: prevalence and influence of synthetic cobalamin intake. In: J Am Geriatr Soc. 50(4), 2002, S. 624–630. PMID 11982661.
- ↑ Wolfgang Herrmann, Rima Obeid: Ursachen und frühzeitige Diagnostik von Vitamin-B12-Mangel. In: Deutsches Ärzteblatt. Band 105, Nr. 40, 2008, S. 680–685, doi:10.3238/arztebl.2008.0680 (online).