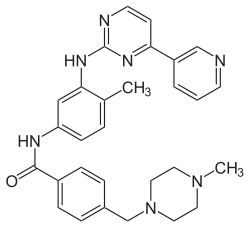
Imatinib
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Imatinib | |||||||||||||||
| Andere Namen |
4-[(4-Methylpiperazin-1-yl)methyl]-N-{4-methyl-3-[(4-pyridin-3-ylpyrimidin-2-yl)amino]phenyl}benzamid | |||||||||||||||
| Summenformel | C29H31N7O | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code | ||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Wirkmechanismus | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 493,60 g·mol−1 | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Imatinib ist ein Proteinkinaseinhibitor zur Behandlung der chronischen myeloischen Leukämie (CML), von gastrointestinalen Stromatumoren (GIST) sowie weiteren malignen Erkrankungen. Es ist der Wirkstoff des von der Firma Novartis unter dem Handelsnamen Glivec (Europa/Australien) oder Gleevec (USA) vertriebenen Medikaments. Arzneilich verwendet wird das Imatinibmesilat, ein Salz der Methansulfonsäure, dessen Name in der Entwicklungsphase CGP57148B bzw. STI-571 lautete.
Wirkmechanismus
[Bearbeiten | Quelltext bearbeiten]Hintergrund
[Bearbeiten | Quelltext bearbeiten]Bei über 90 % der Patienten mit einer chronischen myeloischen Leukämie (CML) findet sich das sogenannte Philadelphia-Chromosom. Es handelt sich dabei um ein verkürztes Chromosom 22, welches durch Austausch von genetischem Material zwischen Chromosom 9 und 22 entsteht. Diesen Vorgang nennt man Translokation. Dadurch wird das Gen für ein natürliches Enzym, die Tyrosinkinase ABL von Chromosom 9, mit einem Fragment des BCR-Gens auf Chromosom 22 verschmolzen. Die so mutierten Zellen produzieren ein sogenanntes Fusionsprotein BCR-ABL, eine im Vergleich zum ABL mit verstärkter Aktivität ausgestattete Tyrosinkinase, die zur unkontrollierten Vermehrung von weißen Blutkörperchen führt und eine entscheidende Rolle bei der Entstehung einer CML spielt.
Imatinib ist ein spezifischer Hemmstoff, der die Aktivität der Tyrosinkinase ABL in den erkrankten Zellen blockiert und damit die krankhaft gesteigerte Vermehrung der mutierten Blutstammzellen unterdrückt.
Ziel der Behandlung der chronischen myeloischen Leukämie mit Imatinib (und anderen Tyrosinkinase-Inhibitoren) ist es, eine möglichst weitgehende Reduktion des pathologischen Zellklons zu erreichen. Eine molekulare Remission, bei der BCR-ABL-Transkripte auch mittels sensitiver Verfahren (RT-PCR) nicht mehr nachweisbar sind, erreicht nur eine kleinere Gruppe von Patienten. Etwa 40 % erreichen eine deutliche Reduktion von BCR-ABL in der quantitativen PCR (> 3 log-Stufen), bei mindestens 75 % sind keine Metaphasen mit dem Philadelphia-Chromosom mehr nachweisbar (komplette zytogenetische Reduktion). Eine Normalisierung des Blutbildes (komplette hämatologische Remission) wird unter Imatinib bei über 95 % der Patienten erreicht.[3]
Molekularer Mechanismus
[Bearbeiten | Quelltext bearbeiten]
Der Wirkmechanismus von Imatinib besteht in der kompetitiven und selektiven Blockade der ATP-Bindungsstelle spezifischer Tyrosinkinasen, wie z. B. ABL, BCR-ABL, c-Kit und der PDGF-Rezeptor. Durch diese Blockade wird die Übertragung eines Phosphatrestes auf das Substrat verhindert. Imatinib wirkt auch auf das physiologisch vorkommende ABL. Gesunde Zellen besitzen jedoch zusätzliche Signalwege und werden kaum in ihrer Funktion gestört. Krebszellen hingegen sind abhängig von der Aktivität von BCR-ABL und werden in ihrer Teilungs- und Überlebensfähigkeit stark beeinträchtigt. Weitere Ziele von Imatinib sind die Tyrosinkinasen ARG und DDR1 und die Oxidoreduktase NQO2[4].
Stoffliche Weiterentwicklungen mit ähnlichen Wirkmechanismen, die bei Imatinib-Resistenz oder -unverträglichkeit eine therapeutische Alternative darstellen können, sind die Tyrosinkinase-Inhibitoren Dasatinib, Nilotinib und SGX393.
Imatinib hemmt in vitro das Enzym Deacetylase Agd3, mit dem der Schimmelpilz Aspergillus fumigatus einen Zucker für seinen schützenden Biofilm produziert.[5][6] Aspergillus fumigatus ist ein opportunistischer Erreger, der beispielsweise im Fall eines geschwächten Immunsystems Krankheiten unterschiedlichen Schweregrads verursachen kann.
Metabolismus
[Bearbeiten | Quelltext bearbeiten]| Bioverfügbarkeit | 98 % |
| Plasmaeiweißbindung | 95 % |
| Metabolismus | Hepatisch, vorwiegend Cytochrom P450 3A4 |
| Halbwertzeit | 18–22 Stunden |
| Ausscheidung | Hepatisch |
| Verabreichungsform | Oral |
| Schwangerschaft | sorgfältige Nutzen-Risiko-Abwägung (teratogen im Tierversuch) |
Imatinib wird hauptsächlich von dem Cytochrom P450-Isoenzym CYP3A4 verstoffwechselt, wobei das N-Desmethyl-Piperazin-Derivat als Hauptmetabolit mit Restaktivität entsteht. Inhibitoren dieses Isoenzyms (zum Beispiel Erythromycin, Cimetidin oder Grapefruitsaft) können die Metabolisierung von Imatinib hemmen und somit zu einer Erhöhung der Plasmakonzentrationen und in der Folge zu höherer Toxizität führen. Des Weiteren findet man N-Oxide am Piperazin- und am Pyrimidin-Ring sowie die Oxidation der aromatischen Methylgruppe zum Alkohol. Die Ausscheidung erfolgt größtenteils über die Galle (biliär), zu einem geringeren Teil über die Niere. Unverändert werden 25 % ausgeschieden. Imatinib ist kompetitiver Hemmstoff der Cytochrome CYP2C9, CYP2D6, CYP3A4/5. Der Zeitpunkt der maximalen Plasmakonzentration liegt bei 1 bis 2 Stunden.
Unerwünschte Wirkungen und Gegenanzeigen
[Bearbeiten | Quelltext bearbeiten]Imatinib wird im Allgemeinen gut vertragen. Zu den unerwünschten Wirkungen zählen Übelkeit, Erbrechen, Durchfall, Muskelschmerzen (Myalgie), Muskelkrämpfe, Hautrötungen, erhöhte Leberwerte (Transaminasenanstieg), Schwellungen (Ödeme) und Hautveränderungen. Imatinib ist im Tierversuch teratogen und sollte deshalb während der Schwangerschaft nicht angewendet werden.
Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Das arzneilich verwendete Mesilat liegt als kristalliner Feststoff vor, der in zwei polymorphen Kristallformen auftreten kann.[1][7] Die α-Form schmilzt bei 220,5 °C mit einer Schmelzenthalpie von −22,28 J·g−1, die β-Form bei 214,0 °C mit −31,38 J·g−1[1] Beide Formen stehen enantiotrop zueinander. Bei Raumtemperatur ist die β-Form die thermodynamisch stabile Form. Eine Patentschrift aus dem Jahr 2013 beschreibt vier weitere polymorphe Formen, die eine höhere Löslichkeit als die β-Form besitzen.[8]
Patentrechtliche Aspekte
[Bearbeiten | Quelltext bearbeiten]Mit Ablauf des Patentschutzes des Originalpräparates Glivec war die Vermarktung von Generika möglich. Im Jahr 2013 wurden für das Anwendungsgebiet chronisch myeloische Leukämie (CML) bei Philadelphia-Chromosom-positiven Kindern und Erwachsenen Imatinib Teva (Teva),[9][10] Imatinib Actavis[11] Imatinib Accord und Imatinib medac zugelassen. In Deutschland lief im Dezember 2016 in sieben von neun zugelassenen Indikationen den Patentschutz für Glivec aus.[12][13] Im Oktober 2021 endete auch der Patentschutz für die Indikation GIST.[14]
Im April 2013 hatte der Supreme Court of India als oberstes indisches Gericht in einem wegweisenden Urteil entschieden, dass Imatinibmesilat, der Wirkstoff von Glivec, in Indien keinen Patentschutz erhält.[15] Bereits 2006 hatten die indischen Behörden Novartis die Patentierung von Imatinibmesilat verweigert. Das indische Patentgesetz (Indian Patent Act) von 2005 schließt nämlich in Paragraph 3(d) einen Patentschutz für Arzneistoffe aus, wenn sie eine nur geringfügige Abwandlung (beispielsweise Salze, Isomere oder polymorphe Kristallstrukturen) von bereits vorhandenen Arzneistoffmolekülen darstellen und diese Abwandlung zu keinem Wirksamkeitsvorteil führt.[16][17][18] Dem hatte Novartis entgegengehalten, dass die Abwandlung gegenüber der bereits bekannten Imatinib-Base nicht geringfügig, sondern gravierend sei.
Die indische Paragraph-3(d)-Regelung soll eigentlich die Verlängerung eines bestehenden Patentschutzes mit nur minimalen Veränderungen zum vorher patentierten Wirkstoff (Evergreening) verhindern.[15] Allerdings war Imatinib-Base nicht durch Patente geschützt, da vor 2005 in Indien Patente auf Arzneistoffe generell nicht erteilt wurden.[19] Für das Fertigarzneimittel Glivec hatte Novartis 2003 basierend auf einer speziellen Klausel des damals geltenden indischen Patentgesetzes Indian Patent Act 1970 exklusive Vermarktungsrechte für eine Zeitspanne von fünf Jahren erhalten.[20]
Weitere Anwendungsgebiete
[Bearbeiten | Quelltext bearbeiten]Imatinibmesilat war neben der Behandlung verschiedener Krebsarten auch zur Zusatzbehandlung der pulmonalen arteriellen Hypertonie (PAH) vorgesehen. Einen Zulassungsantrag auf dieses Anwendungsgebiet zog Novartis jedoch zurück, nachdem zur Beurteilung der Arzneimittelsicherheit weiterhin erforderliche Daten nicht innerhalb des behördlich vorgegebenen Zeitraums vorgelegt werden konnten.[21]
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Glivec (EU, CH), Generika
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Imatinib-Arzneimittel auf der Website der Europäischen Arzneimittelagentur (Europäischer Öffentlicher Beurteilungsbericht, EPAR)
- Gleevec: the Breakthrough in Cancer Treatment – Learn Science at Scitable. In: nature.com. (englisch).
Literatur
[Bearbeiten | Quelltext bearbeiten]- M. Deininger u. a.: The development of imatinib as a therapeutic agent for chronic myeloid leukemia. In: Blood. Band 105, 2005, S. 2640–2653, PMID 15618470.
- S. G. O’Brien u. a.: Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia. In: N. Engl. J. Med. Band 348, 2003, S. 994–1004, PMID 12637609.
- D. G. Savage, K. H. Antman: Imatinib Mesylate — A New Oral Targeted Therapy. In: N. Engl. J. Med. Band 346, 2002, S. 683–693, PMID 11870247.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d E. B. Atici, B. Karliga: Quantitative determination of two polymorphic forms of imatinib mesylate in a drug substance and tablet formulation by X-ray powder diffraction, differential scanning calorimetry and attenuated total reflectance Fourier transform infrared spectroscopy. In: J. Pharm. Biomed. Anal. 114 (2015) 330–340, doi:10.1016/j.jpba.2015.06.011.
- ↑ a b Registrierungsdossier zu Benzamide, 4-[(4-methyl-1-piperazinyl)methyl]-N-[4-methyl-3-[[4-(3-pyridinyl)-2-pyrimidinyl]amino]phenyl]- (Abschnitt GHS) bei der Europäischen Chemikalienagentur (ECHA), abgerufen am 3. Juli 2020.
- ↑ Hochhaus A et al. for the IRIS Investigators. Long-Term Outcomes of Imatinib Treatment for Chronic Myeloid Leukemia, N Engl J Med 2017, 376:917-927, doi:10.1056/NEJMoa1609324
- ↑ Oliver Hantschel, Uwe Rix, Giulio Superti-Furga: Target spectrum of the BCR-ABL inhibitors imatinib, nilotinib and dasatinib. In: Leukemia & Lymphoma. Band 49, Nr. 4, 1. Januar 2008, S. 615–619, doi:10.1080/10428190801896103, PMID 18398720.
- ↑ Drug from cancer chemotherapy helps fight deadly fungal infections, Medizinische Hochschule Hannover, Pressemitteilung, 28. Februar 2023.
- ↑ Carla I. I. Seegers, Danielle J. Lee, Patricia Zarnovican, Susanne H. Kirsch, Rolf Müller, Thomas Haselhorst, Françoise H. Routier: Identification of Compounds Preventing A. fumigatus Biofilm Formation by Inhibition of the Galactosaminogalactan Deacetylase Agd3. In: International Journal of Molecular Sciences. 2023, Band 24, Nummer 3, S. 1851. DOI:10.3390/ijms24031851.
- ↑ Patent WO 99/03854A (Novartis, 28. Januar 1998).
- ↑ Patent EP2604596: Polymorphs of imatinib. Veröffentlicht am 19. Juni 2013, Erfinder: Philipp Daniel Haas, Fikret Koc, Bekir Karliga, Atici Esen Bellur, Ramazan Sivasligil.
- ↑ Öffentlicher Beurteilungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) zu: Imatinib Teva.
- ↑ Bittere Pille für Novartis Ärzte Zeitung online, 23. Oktober 2012.
- ↑ Öffentlicher Beurteilungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) zu: Imatinib Actavis,
- ↑ apotheke adhoc: Glivec wird generisch ( vom 4. März 2016 im Internet Archive), 27. Februar 2013.
- ↑ Imatinib zur GIST-Therapie bis 2021 patentgeschützt, Praxis-Depesche, abgerufen am 2. März 2023.
- ↑ Imatinib beim Gastrointestinalen Stromatumor (GIST), DGHO, 11. November 2021.
- ↑ a b Novartis unterliegt in letzter Instanz In: Neue Zürcher Zeitung. vom 1. April 2013.
- ↑ Novartis' imatinib patent battle resumes in Indian Supreme Court. In: thepharmaletter.com. vom 15. August 2011.
- ↑ Ducking' TRIPS in India: A Saga Involving Novartis and the Legality of Section 3(d). In: National Law School of India Review. Band 20, Nummer 2, 2008, S. 131–155.
- ↑ Pharmabranche im Land Hintergrund. In: Tages-Anzeiger vom 22. August 2012.
- ↑ J. Bidder: Schutz des geistigen Eigentums Focus online, 25. Januar 2008.
- ↑ Erklärung von Bern: Novartis reicht in Indien zwei Klagen ein: Krebspatienten und Gesundheitsgruppen fordern den Rückzug der Klagen ( vom 14. Juli 2010 im Internet Archive) (PDF; 25 kB), 26. September 2006.
- ↑ Pressemitteilung der EMA: Novartis Europharm Ltd withdraws its marketing-authorisation application for Ruvise (imatinib mesilate), 24. Januar 2013.