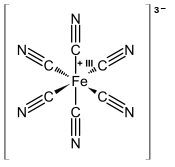
Kaliumhexacyanidoferrat(III)
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kaliumhexacyanidoferrat(III) | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | K3[Fe(CN)6] | ||||||||||||||||||
| Kurzbeschreibung |
rubinrote, monokline Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 329,26 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
1,85 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Kaliumhexacyanidoferrat(III) ist ein Salz mit der Formeleinheit K3[Fe(CN)6]. Innerhalb der Cyanide handelt es sich um eine Komplexverbindung. Es wird auch als Kaliumferricyanid, Ferricyankalium, Rotes Blutlaugensalz, oder Rotkali bezeichnet; nach älterer Nomenklatur der IUPAC auch noch als Kaliumhexacyanoferrat(III). Die wässrige Lösung besitzt eine gelbe Farbe und zersetzt sich im Licht unter Bildung von Eisen(III)-hydroxid (Fe(OH)3).
Herkunft des Namens
[Bearbeiten | Quelltext bearbeiten]Der Name Blutlaugensalz rührt von der Herstellungsweise durch Alchemisten. Sie erhitzten Blut mit Knochen, Horn und anderen proteinhaltigen Substanzen in Gegenwart von Pottasche. Der Rückstand wurde mit Wasser ausgelaugt. Daraus kristallisierte anschließend ein Salz aus, welches je nachdem, wie viel Luft man beim Erhitzen zuließ, rot (Rotes Blutlaugensalz) oder gelb (Gelbes Blutlaugensalz) war.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Die Herstellung erfolgt durch Oxidation von Kaliumhexacyanidoferrat(II) (K4[Fe(CN)6]) mit Wasserstoffperoxid (H2O2) oder elektrochemisch.
-
Monokristall (258,9 g), ca. ein halbes Jahr gewachsen
-
Kristallines Kaliumhexacyanidoferrat(III)
-
Kristall, mikroskopisch, polarisiertes Licht
Verwendung
[Bearbeiten | Quelltext bearbeiten]Das Salz wird als mildes Oxidationsmittel bei organischen Synthesen eingesetzt. In der Analytik wird es zum Nachweis von Eisen(II)-Ionen verwendet. Dabei entsteht das sogenannte Berliner Blau.
Cyanotypien werden mit Kaliumhexacyanidoferrat(III) und mit grünem Ammoniumeisen(III)-citrat (Ammoniumferrizitrat) oder Ammoniumtrioxalatoferrat(III) (Ammoniumeisen(III)-oxalat) (neue Formel) hergestellt.[3] Aufgrund der Färbung wird umgangssprachlich auch von Blaupausen gesprochen.[4] Außerdem wird es in der Färberei, als Stahlhärtungsmittel, als Holzbeize und in der Analogfotografie verwendet, z. B. als Teil des Farmerschen Abschwächers.
Bei unsachgemäßem Umgang kann sich aus Kaliumhexacyanidoferrat(III) durch Abspaltung die sehr giftige Blausäure (Cyanwasserstoff) bilden.[5] Diese Gefahr ist insbesondere bei Reaktionen mit starken Säuren unter Wärmeeinwirkung gegeben. Auch beim Kontakt mit starken Säuren in der Kälte kann unter ungünstigen Umständen Blausäure freiwerden, da Kaliumhexacyanidoferrat(III) im Gegensatz zu Kaliumhexacyanidoferrat(II) einen schwachen Ligandenaustausch von Wasser und Cyanid zeigt.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Eintrag zu Hexacyanidoferrate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 6. Juni 2014.
- ↑ a b c d e f Eintrag zu Kaliumhexacyanoferrat(III) in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ [1] Neue und alte Techniken der Radierung und Edeldruckverfahren/ EIN ALCHEMISTISCHES (ONLINE-)WERKSTATTBUCH MIT TIPPS, REZEPTUREN + ANLEITUNGEN AUS 500 JAHREN, Cyanotypie
- ↑ Matthias Ducci, Marco Oetken: Chemische Unterhaltungen: Pop-Art-Labor. In: spektrum.de. Abgerufen am 28. Februar 2023.
- ↑ Karlheinz Lohs, Peter Elstner, Ursula Stephan: Fachlexikon Toxikologie. Springer-Verlag, 2008, ISBN 978-3-540-27337-0, S. 118.





![{\displaystyle \mathrm {Fe^{2+}+[Fe(CN)_{6}]^{3-}\ \rightleftharpoons \ Fe^{3+}+[Fe(CN)_{6}]^{4-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ba48a61dbef287bc9886697f83bbae98997a0c18)