Linalool
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
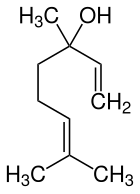
| |||||||||||||||||||
| Vereinfachte Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Linalool | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C10H18O | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 154,25 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,86 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
198–200 °C [(S)-(+)-Linalool] [4] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (1,59 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Brechungsindex |
1,4616 (20 °C)[5] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Linalool ist eine organisch-chemische Verbindung aus der Stoffgruppe der acyclischen Monoterpen-Alkohole. Linalool ist ein Naturstoff mit frischem, maiglöckchenähnlichem Geruch.
Isomere
[Bearbeiten | Quelltext bearbeiten]Die Substanz hat ein stereogenes Zentrum am Kohlenstoffatom der Position 3 und tritt somit in Form zweier Enantiomere auf: Licareol [(R)-(−)-Linalool] und Coriandrol [(S)-(+)-Linalool]. Es ist isomer zu Nerol/Geraniol wie auch zu Pinanol, Borneol, Myrcenol und Dihydrocarveol.
| Isomere von Linalool | ||
| Name | (S)-(+)-Linalool | (R)-(−)-Linalool |
| Andere Namen | Coriandrol | Licareol |
| Strukturformel |  |

|
| CAS-Nummer | 126-90-9 | 126-91-0 |
| 78-70-6 (unspez.) | ||
| EG-Nummer | 204-810-7 | 204-811-2 |
| 201-134-4 (unspez.) | ||
| ECHA-Infocard | 100.004.374 | 100.004.375 |
| 100.001.032 (unspez.) | ||
| PubChem | 67179 | 443158 |
| 6549 (unspez.) | ||
| Wikidata | Q27105233 | Q27105200 |
| Q410932 (unspez.) | ||
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Linalool ist Bestandteil vieler ätherischer Öle und kommt dort oft als Hauptbestandteil vor. So enthält das Shuiöl aus dem Kampferbaum 80–85 %, das Korianderöl 60–70 % Linalool.[7] Es kommt im Sternanis,[8] Anis-Duftnessel,[9] Bay,[10] Hopfen, Muskat, Ingwer, Bohnenkraut, Zimt, Basilikum,[11] Echtem Lorbeer,[11] Pfefferminze,[11] Acker-Minze,[11] Majoran, Thymian, Oregano, schwarzen Pfeffer, Safran, Hanf und anderen Gewürzpflanzen vor.
-
Kampfer
-
Koriander
-
Sternanis
-
Anis-Duftnessel
-
Hopfen
-
Muskatnuss
Auch als Ester (Linalylacetat) und als Linalooloxid findet es sich in vielen ätherischen Ölen. Linalool gehört auch zu den Aromen im Wein. Mit einem Geruchsschwellenwert von 0,025 Milligramm pro Liter ist es eine wichtige Komponente des Muskateller-Bouquets.[12]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Nach Schätzungen wurden im Jahr 2000 weltweit etwa 12.000 Tonnen Linalool industriell hergestellt. Die natürliche Produktion übertrifft die industrielle aber um ein Vielfaches.
Zur Synthese wird Methylheptenon ethinyliert. Das entstehende Dehydrolinalool wird durch eine partielle Hydrierung zum Linalool reduziert. Diese Synthese gelang erstmals Leopold Ruzicka und Virgilio Fornasir 1919.[13]

Eine zweite mögliche Syntheseroute geht vom α-Pinen aus. Dieses wird zum cis-Pinan hydriert und an der Luft zu cis- bzw. trans-Pinanhydroperoxid oxidiert. Das Hydroperoxid wird reduktiv zum Gemisch aus cis- oder trans-Pinanol aufgearbeitet, das destillativ getrennt werden kann. Bei Temperaturen von über 500 °C wird cis-Pinanol dann zum Coriandrol und trans-Pinanol zum Licareol isomerisiert.

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Linalool ist eine klare, farblose Flüssigkeit. Coriandrol riecht seifig-korianderartig, Licareol holzig-lavendelartig. Der Geruch des Racemats wird als angenehmer, leicht erfrischender, blumig-holziger/herber Geruch beschrieben. Linalool ist brennbar, der Flammpunkt der Flüssigkeit liegt bei 78 °C, die Zündtemperatur bei 235 °C und die Explosionsgrenzen liegen zwischen 0,9 % (untere Explosionsgrenze) und 5,2 % (obere Explosionsgrenze).[2] Der Brechungsindex der Flüssigkeit liegt bei 20 °C zwischen 1,46 und 1,4675.
Reaktionen
[Bearbeiten | Quelltext bearbeiten]Linalool kann mit Wasserstoff an Katalysatoren zu Tetrahydrolinalool hydriert werden:

Im sauren Milieu isomerisiert Linalool zum Geraniol. Analog erfolgt die Isomerisierung zum Nerol bzw. Terpineol.

Linalool reagiert wie alle Alkohole mit Säuren zu Carbonsäureestern. So kann Linalool z. B. mit Essigsäure zu Linalylacetat verestert werden.

Verwendung
[Bearbeiten | Quelltext bearbeiten]Als ein Bestandteil ätherischer Öle wie auch als Reinstoff findet Linalool als Geruchs- und Geschmackstoff Verwendung.[14] Es ist seit 1954 ein duftgebender Bestandteil des tschechischen Rasierwassers Pitralon F – voda po holení, das bis heute in unveränderter Zusammensetzung produziert wird.
Es ist ein Zwischenprodukt bei der Synthese von Vitamin E.
Gefahrenhinweise
[Bearbeiten | Quelltext bearbeiten]Linalool wirkt reizend auf Haut und Augen, es ruft Rötungen und Schmerzen hervor. Linalool kann oral oder inhalativ aufgenommen werden. Es ist schwach wassergefährdend (WGK 1). Die LD50 für Ratten bei oraler Aufnahme liegt bei 2.790 mg/kg, bei dermaler Resorption bei 5.610 mg/kg. Linalool hat sich in vielen Tests als nicht erbgutverändernd erwiesen. Auch eine karzinogene Wirkung konnte bis heute nicht nachgewiesen werden. Chronische Aufnahme führt zur Schädigung der Leber.
Linalool gehört zu den Prohaptenen, Substanzen, deren Oxidationsprodukte an der Luft (Linalooloxid) bzw. Reaktionsprodukte auf der Haut allergieauslösend sind. In einer europaweiten Studie erwiesen sich 1,3 Prozent der Patienten als sensibel auf oxidiertes Linalool.[15]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- OECD: Screening Information Dataset (SIDS) Initial Assessment Report (SIAR) für 1,6-Octadien-3-ol, 3,7-dimethyl-
- Eintrag zu Linalool in der Consumer Product Information Database
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu LINALOOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. September 2021.
- ↑ a b c d e f g h i j k l Eintrag zu Linalool in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Eintrag zu Linalool. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. November 2014.
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 952, ISBN 978-0-911910-00-1.
- ↑ Horst Surburg, Johannes Panten (Hrsg.): Common Fragrance and Flavor Materials: Preparation, Properties and Uses. Wiley-VCH, 2016, doi:10.1002/9783527693153.
- ↑ Eintrag zu Linalool im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 30. Dezember 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Karl‐Georg Fahlbusch, Franz‐Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe, Horst Surburg: Flavors and Fragrances. In: Ullmann's Encyclopedia of Industrial Chemistry. Band 15, 2012, S. 73–198, doi:10.1002/14356007.a11_141.
- ↑ Jayanta Kumar Patra, Gitishree Das, Sankhadip Bose, Sabyasachi Banerjee, Chethala N. Vishnuprasad, Maria Pilar Rodriguez‐Torres, Han‐Seung Shin: Star anise (Illicium verum): Chemical compounds, antiviral properties, and clinical relevance. In: Phytotherapy Research. Band 34, Nr. 6, Juni 2020, S. 1248–1267, doi:10.1002/ptr.6614.
- ↑ G. R. Mallavarapu, R. N. Kulkarni, K. Baskaran, S. Ramesh: The essential oil composition of anise hyssop grown in India. In: Flavour and Fragrance Journal. Band 19, Nr. 4, Juli 2004, S. 351–353, doi:10.1002/ffj.1316.
- ↑ J. Abaul, P. Bourgeois, J. M. Bessiere: Chemical composition of the essential oils of chemotypes ofPimenta racemosa var.racemosa (P. Miller) J. W. Moore (Bois d'Inde) of Guadeloupe (F.W.I.). In: Flavour and Fragrance Journal. Band 10, Nr. 5, September 1995, S. 319–321, doi:10.1002/ffj.2730100506.
- ↑ a b c d (-)-LINALOOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 24. Mai 2021.
- ↑ Wie kommt eigentlich die schwarze Johannisbeere in die Scheurebe? (PDF; 2,1 MB), von Rainer Amann, Staatliches Weinbauinstitut Freiburg, in Der Badische Winzer, Ausgabe Oktober 2002.
- ↑ L. Ruzicka, V. Fornasir: Ueber die Totalsynthese des Linalools. In: Helv. Chim. Acta. 2. Jahrgang, 1919, S. 182–188, doi:10.1002/hlca.19190020119.
- ↑ Juliane Daphi-Weber, Heike Raddatz, Rainer Müller: Untersuchung von Riechstoffen – Kontrollierte Düfte, S. 94–95, in Band V der Reihe HighChem hautnah – Aktuelles aus der Lebensmittelchemie (Herausgegeben von der Gesellschaft Deutscher Chemiker) 2010, ISBN 978-3-936028-64-5.
- ↑ M. Matura et al.: Selected oxidized fragrance terpenes are common contact allergens. In: Contact Dermatitis. 52/6/2005. S. 320–328, PMID 15932583.






