Lithiumamid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| _ Li+ _ N3− _ H+ | ||||||||||||||||
| Kristallsystem | ||||||||||||||||
| Raumgruppe |
I4 (Nr. 82) | |||||||||||||||
| Gitterparameter | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Lithiumamid | |||||||||||||||
| Verhältnisformel | LiNH2 | |||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 22,96 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,178 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
430 °C[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Lithiumamid ist eine chemische Verbindung des Lithiums aus der Stoffgruppe der Metallamide.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Lithiumamid wird industriell durch Erhitzen von Lithium oder Lithiumhydrid in einem Strom von Ammoniak hergestellt. Außerdem bildet es sich langsam, wenn Lithium in flüssigem Ammoniak gelöst wird.[5] Wie auch bei anderen Alkali- und Erdalkaliamiden wird diese Reaktion durch die Anwesenheit von Eisen(II)-chlorid erheblich beschleunigt.[6]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Lithiumamid ist ein farb- und geruchloser Feststoff, der sich in Wasser zersetzt.[2]
Die Verbindung ist allgemein sehr hydrolyseempfindlich und greift Glas schwach an.[3][7] Beim Erhitzen im Vakuum gibt sie oberhalb von 300 °C Ammoniak ab. Der quantitative Abbau zu Lithiumimid erfolgt jedoch erst bei 400 °C und erst oberhalb 750–800 °C zersetzt sie sich unter Abgabe von Stickstoff, Wasserstoff und Ammoniak.[7]
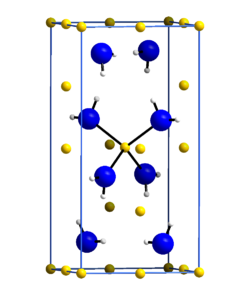
Kristallstruktur
[Bearbeiten | Quelltext bearbeiten]Die Kristallstruktur des Lithiumamids wurde im Jahr 1951 von Robert Juza und Karl Opp in der tetragonalen Raumgruppe I4 (Nr. 82) mit a = 501,6 pm und c = 1022 pm anhand von Pulveraufnahmen bestimmt[8]. Hierbei wurde die Lage der Stickstoffatome und der Lithiumatome bestimmt, jedoch nicht des Wasserstoffs. In einer späteren Arbeit im Jahre 1972 wurde die Kristallstruktur anhand eines Lithiumamid-Einkristalls neu bestimmt. Hierbei wurden auch die Lagen der Wasserstoffatome bestimmt. Die Gitterparameter wurden zu a = 503,7 pm und c = 1027,8 pm bestimmt. Die Stickstoffatome bilden eine verzerrte kubisch dichteste Kugelpackung, in der jede zweite Tetraederlücke von Lithium besetzt ist. Die ABC-Abfolge der Schichten ist entlang [112] angeordnet. In z = 0 sind es drei Li+, in z = 1/4 ein Li+, in z = 1/2 wieder drei Li+ und in z = 3/4 wieder ein Li+. Die Struktur steht in Verwandtschaft zu der des Lithiumhydroxides, unterscheidet sich aber von dieser.[9][10]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Lithiumamid wird in der organischen Chemie bei Claisen-Kondensationen, bei der Alkylierung von Nitrilen und Ketonen sowie der Synthese von Ethinyl-Verbindungen und Carbinolen verwendet.[5] Sie wird weiterhin als Reagenz zur Kreuzkupplung von Arylchloriden und Aminen eingesetzt.[11]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ W.I.F. David, M.O. Jones, D.H. Gregory, C.M. Jewell, S.R. Johnson, A. Walton, P.P. Edwards: A mechanism for non-stoichiometry in the lithium amide/lithium imide hydrogen storage reaction. In: Journal of the American Chemical Society, 2007, Bd. 129(6), S. 1594–1601, doi:10.1021/ja066016s.
- ↑ a b c d e f Datenblatt Lithiumamid bei Merck, abgerufen am 27. März 2013.
- ↑ a b Roger Blachnik (Hrsg.): Taschenbuch für Chemiker und Physiker. Begründet von Jean d’Ans, Ellen Lax. 4., neubearbeitete und revidierte Auflage. Band 3: Elemente, anorganische Verbindungen und Materialien, Minerale. Springer, Berlin 1998, ISBN 3-540-60035-3, S. 536 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Eintrag zu Lithiumamid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18. November 2022. (JavaScript erforderlich)
- ↑ a b Eintrag zu LITHIUM AMIDE in der Hazardous Substances Data Bank (via PubChem), abgerufen am 28. März 2013.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 666.
- ↑ a b Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 448.
- ↑ R. Juza und K. Opp: Die Kristallstruktur des Lithiumamides. In: Z. Anorg. Allg. Chem, 1951, Bd. 266, S. 313–324, doi:10.1002/zaac.1951266060.
- ↑ H. Jacobs und R. Juza: Neubestimmung der Kristallstruktur des Lithiumamids. In: Z. Anorg. Allg. Chem, 1972, Bd. 391, S. 271–279, doi:10.1002/zaac.19723910308.
- ↑ Theresia M. M. Richter und Rainer Niewa: Chemistry of Ammonothermal Synthesis. In: Inorganics, 2014, Bd. 2, S. 29–78, doi:10.3390/inorganics2010029.
- ↑ Datenblatt Lithium amide, powder, 95% bei Sigma-Aldrich, abgerufen am 28. März 2013 (PDF).





