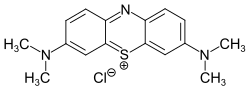
Methylenblau
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Methylenblau | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C16H18ClN3S | |||||||||||||||||||||
| Kurzbeschreibung |
dunkelgrüne, glänzende Kristalle[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 319,86 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Methylenblau (Synonym: Methylthioniniumchlorid, lateinisch Methylenum caeruleum, systematische Bezeichnung nach Colour Index C.I. Basic Blue 9) ist ein Phenothiazin-Derivat. Der kationische Farbstoff wird in der Chemie, Medizin und Färbetechnik verwendet.
Als reiner Farbstoff erscheint Methylenblau dunkelgrün, als Pulver oder Kristalle. Das im Handel auch übliche Methylenblau als Doppelsalz mit Zinkchlorid ist ein braunes Pulver.
Historisches
[Bearbeiten | Quelltext bearbeiten]Methylenblau wurde erstmals 1876 von dem Chemiker Heinrich Caro bei der BASF synthetisiert.[1] Ein Jahr später erhielt die BASF für Methylenblau das erste Deutsche Reichspatent für einen Teerfarbstoff. Um 1900 wurde Methylenblau auch als ein Medikament gegen psychische Erkrankungen versucht. Erst in den 1950er Jahren wurden andere Phenothiazine (Chlorpromazin) als Psychopharmaka entdeckt.[4]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Methylenblau wird in mehreren Schritten aus N,N-Dimethyl-p-phenylendiamin unter Zusatz von Dichromat als Oxidationsmittel sowie der Addition von N,N-Dimethylanilin hergestellt. Abschließend muss es zum Indamin oxidiert werden, wobei sich Bindschedlers Grün bildet. Dieses wird in Gegenwart von Kupfersulfat mit Schwefelwasserstoff cyclisiert.
Die Synthese von Methylenblau lässt sich in fünf Schritte unterteilen. Dabei wird N,N-Dimethylanilin vorgelegt und mit Salzsäure und Natriumnitrit versetzt. Dabei entsteht p-Nitroso-N,N-dimethylanilin. Durch Zugabe von Zink wird die entstandene Nitrosogruppe zu einem Amin reduziert. Anschließend reagiert das Produkt der Reduktion p-Amino-N,N-dimethylanilin unter Zugabe von konzentrierter Schwefelsäure und Thioschwefelsäure zu der Thiosulfonsäure von p-Amino-N,N-dimethylanilin. Bei der erneuten Zugabe von konzentrierter Schwefelsäure und der Zugabe eines weiteren Äquivalents von N,N-Dimethylanilins entsteht die Thiosulfonsäure von Bindschedlers Grün. Dies geschieht in einer oxidativen Kupplungsreaktion. Aus der Thiosulfonsäure von Bindschedlers Grün entsteht durch Zugabe von Mangandioxid das gewünschte Produkt Methylenblau.[5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Methylenblau absorbiert sichtbares Licht im Bereich von ca. 530 bis 700 nm; das Absorptionsmaximum liegt bei 660 nm.
Der kristalline Feststoff zeigt eine ausgeprägte Tendenz zur Hydratbildung. So lassen sich mit einem Pentahydrat, einem 2,2–2,3–Hydrat, zwei polymorphen Dihydraten und einem Monohydrat fünf verschiedene Hydratformen differenzieren.[7]
Methylenblau wird als Redoxindikator benutzt. Es ist ein guter Wasserstoff-Akzeptor, der Alkohole in Gegenwart von Platin zu Aldehyden oxidiert. Dabei entfärbt sich die Lösung. Eine analoge Reaktion lässt sich auch mit Glucose und Luftsauerstoff als Blue-Bottle-Experiment durchführen.[1] Eine entsprechende Redoxreaktion läuft ab, wenn man zu einer Methylenblaulösung verdünnte Schwefelsäure und etwas Zinkpulver gibt. Methylenblau wird zur farblosen Leukoform reduziert. Die farblose Lösung wird nach Schütteln an der Luft wieder blau, weil die Leukoform vom Luftsauerstoff wieder zum Methylenblau oxidiert wird.
Verwendung
[Bearbeiten | Quelltext bearbeiten]
Färbemittel
[Bearbeiten | Quelltext bearbeiten]Es wird zur Blaufärbung von Fasern oder Papier verwendet. In Wasser löst sich Methylenblau gut als intensiv blaue Farbe (daher der Name), selbst geringe Mengen bewirken eine sichtbare Färbung des Wassers.
In der Histologie wurde es 1885 erstmals durch Paul Ehrlich zur selektiven Färbung bestimmter Gewebearten (besonders der grauen Substanz im peripheren Nervensystem) verwendet. Die Färbung mit Methylenblau ist am lebenden Organismus möglich (Vitalfärbung), daher zählt man es zu den so genannten Vitalfarbstoffen. Die bakteriologische Verwendung des alkalischen Methylenblaus wird auch als Loeffler-Färbung[8] (nach Friedrich Loeffler) bezeichnet.
In der Molekularbiologie wird Methylenblau zum Färben von DNA und RNA in Gelen und auf Membranen nach dem Blotten verwendet. Zwar ist Methylenblau nicht so sensitiv wie Ethidiumbromid, dafür aber weniger toxisch und es interkaliert nicht in die Nukleinsäure-Ketten.
In der Botanik wird es neben Rutheniumrot zum Färben von Pektinen genutzt.
Medizin
[Bearbeiten | Quelltext bearbeiten]In der Heilkunde ist es ein wichtiges Antidot bei Nitrit- und Anilinvergiftungen, da es die Rück-Umwandlung von Methämoglobin zu funktionsfähigem Hämoglobin beschleunigt (s. Methämoglobinämie). Weiter wird es noch als Antiseptikum, zur Bekämpfung von Malaria,[9] Antirheumatikum und zu Diagnosezwecken eingesetzt. In der Tiermedizin findet es, zusammen mit Malachitgrün, als Mittel gegen die bei Fischen auftretende Weißpünktchenkrankheit Verwendung.
Weiterhin wird der Farbstoff auf seine Eignung zur Behandlung von chronischen Schmerzen des unteren Rückens untersucht. Diese Anwendung hat jedoch keine Arzneimittelzulassung. Es wird das Methylenblau zwischen die Wirbel direkt in die beschädigten Bandscheiben (lat. Discus intervertebralis) injiziert, was zu einer Zerstörung der Schmerzrezeptoren und somit zur Beseitigung bzw. Linderung des Schmerzes führt. Initiale Ergebnisse der im Rahmen einer Placebo-kontrollierten klinischen Studie durchgeführten Untersuchung waren ermutigend: Die Behandlungsmethode führte bei einem Großteil der Patienten zu einer nachhaltigen, für mindestens zwei Jahre anhaltenden Schmerzlinderung, wobei bei keinem der Patienten Komplikationen auftraten.[10] Nachfolgende Studien lieferten allerdings teils widersprüchliche Ergebnisse.[11][12][13]
Methylenblau wirkt in bestimmten Konzentrationen neurotoxisch.[14][15] Die Anwendung von Methylenblau kann zum Serotoninsyndrom führen, wenn MAO-Hemmer wie z. B. Methylenblau und Antidepressiva der Gruppe Selektive Serotonin-Wiederaufnahmehemmer (SSRI), wie beispielsweise Fluoxetin, Fluvoxamin, Paroxetin, Sertralin und Citalopram kombiniert werden.[16][17][18]
Im Tierversuch zeigte sich an Mäusen nach oraler Verabreichung von M.-Trihydrat an 5 d/Woche über 106 Wochen per Schlundsonde in Dosierungen von 2,5 bis 25 mg/kg KG x d eine dosisabhängige Zunahme von Adenomen und Karzinomen des Dünndarms; bei der höchsten Dosis lag die kombinierte Inzidenz von Adenomen und Karzinomen mit 12 % signifikant über der historischer Kontrollen.[19] Weiterhin wurde ein leichter Anstieg der Inzidenz bösartiger Lymphome beobachtet, der jedoch bei den Männchen nur marginal über der Inzidenz historischer Kontrollen lag und bei den Weibchen keine klare Dosisabhängigkeit zeigte; der Zusammenhang mit der Exposition wurde vom NTP daher als „nicht eindeutig“ („equivocal“) bewertet. Der Bewertung der US-amerikanischen Arzneimittelbehörde FDA zufolge weisen die Ergebnisse dieser Studie hingegen nicht auf eine substanzbedingte Entstehung von Tumoren bei Mäusen hin.[20] Bei Ratten zeigte sich nach entsprechender Verabreichung an 5 d/Woche über 106 Wochen per Schlundsonde in Dosierungen von 5 bis 50 mg M.-Trihydrat/kg KG x d bei den Männchen ein Trend für eine dosisabhängige Zunahme von Inselzelladenomen und möglicherweise von Adenomen + Karzinomen der Bauchspeicheldrüse. Bei Weibchen wurden keine erhöhte Inzidenz von Tumoren festgestellt. Das NTP sieht in diesen Befunden „einige Anzeichen“ („some evidence“) für eine kanzerogene Wirkung von M. bei männlichen und keine derartige Evidenz bei weiblichen Ratten. Die FDA kam zu dem Schluss, dass M. bei männlichen Ratten Inselzelladenome oder -karzinome der Bauchspeicheldrüse verursacht.
In der experimentellen Pharmakologie und auch schon in der klinischen Medizin wird Methylenblau als Enzymhemmer der löslichen Guanylylcyclase und damit beim katecholaminrefraktären septischen Schock eingesetzt.[21][22][23]
Methylenblau gilt auch als Hoffnungsträger für eine künftige Therapie der Frontotemporalen Demenz (FTLD), da es die Aggregation von Tau-Proteinen hemmt.[24][25]
Nebenwirkungen
[Bearbeiten | Quelltext bearbeiten]| Kardiovaskulär[26][27] | Zentrales Nervensystem[26][27] | Dermatologisch[26][27] | Gastrointestinal[26][27] | Urologisch[26][27] | Hämatologisch[26][27] |
|---|---|---|---|---|---|
| • Bluthochdruck • präkordialer Schmerz |
• Schwindel • Geistige Verwirrung • Kopfschmerzen • Fieber |
• Verfärbung der Haut • Nekrose der Injektionsstelle |
• Verfärbung des Stuhls • Übelkeit • Erbrechen • Unterleibsschmerzen |
• Verfärbung des Urins (Dosen über 80 µg) • Blasenreizung |
• Anämie |
Methylenblau ist ein Monoaminoxidase-Hemmer (MAOI),[28] und kann bei intravenöser Verabreichung von Dosen über 5 mg/kg in Kombination mit selektiven Serotonin-Wiederaufnahmehemmern (SSRI) oder anderen Serotonin-Wiederaufnahme-Hemmern (z. B. Duloxetin, Sibutramin, Venlafaxin, Clomipramin, Imipramin) eine schwere Serotonin-Toxizität, das Serotoninsyndrom, auslösen.[29]
Es verursacht eine hämolytische Anämie bei Trägern des G6PD-Enzymmangels (Favismus).[30]
Sonstige
[Bearbeiten | Quelltext bearbeiten]In der Geologie dient die Methylenblau-Methode zur Bestimmung des Smektitgehalts in Tonmineralien. Es stellt damit ein wichtiges Verfahren zur Qualitätskontrolle in vielen Industriezweigen dar.
In der Analytischen Chemie wird es in der Bestimmung von Aniontensiden nach der Longwell-Manience-Methode und bei der Epton-Titration verwendet.
In der Abwasseranalytik wird eine Methylenblauprobe zur Bestimmung der Fäulnisfähigkeit herangezogen. Mit Hilfe der Methylenblauprobe kann der Nachweis geführt werden, ob bzw. in welchem Maße der Ablauf einer Kläranlage noch fäulnisfähige Stoffe enthält. Methylenblau ist ein Redoxindikator und entfärbt sich bei absolutem Luftabschluss in dem Maße, in dem anaerobe Verhältnisse (H2S-Bildung) überhandnehmen. Es wird die Zeit bis zur Entfärbung des der Probe zugesetzten Farbstoffes bestimmt. Man gibt 0,6 ml einer Methylenblaulösung (0,05 %ig) in eine 100 ml Schliffstopfenflasche, füllt randvoll mit Probe, setzt den Stopfen blasenfrei auf und bewahrt sie im Dunkeln bei 20 °C (Brutschrank) auf. Die Probe wird täglich beobachtet (am ersten Tag mehrmals) und stellt die Zeit bis zur Entfärbung fest; erfolgt diese bereits am ersten Tag (Angaben in Stunden) oder innerhalb vier Tagen (Angabe in Tagen), ist die Ablaufqualität unzulässig; tritt innerhalb von fünf Tagen keine Entfärbung ein, wird die Probe als „n. e.“ (nicht entfärbt) bezeichnet und der Test abgebrochen (s. DEV [1], H 22,„Prüfung auf Fäulnisfähigkeit“ und ÖNORM M 6276).
In der Biochemie wird Methylenblau als Redoxmediator eingesetzt. Das Halbwertspotential E0' beträgt +0,011 mV.[31]
In der Bakteriologie wird Methylenblaumilch zum Nachweis Reduktase-bildender Bakterien eingesetzt.
-
Methylenblau-Lösung
-
Methylenblau-Pulver
-
Methylenblau-Kristalle
Literatur
[Bearbeiten | Quelltext bearbeiten]- Ulrich L. Bohne, Richard P. Kreher: Methylenblau. Geschichte eines Farbstoffs – ein Farbstoff mit Geschichte. In: NiU-Chemie. Nr. 52, 1999, S. 36–37.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Eintrag zu Methylenblau. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. Mai 2014.
- ↑ a b c d Eintrag zu Methylthioniniumchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- ↑ Eintrag zu Methylene blue in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ Hans Bangen: Geschichte der medikamentösen Therapie der Schizophrenie. Berlin 1992.
- ↑ J. Sinclair, S. Nicoll, J. Storey, C. Harringston, J. Carlisle, Methodes of chemical synthesis of diaminophenothiazinium compounds including methylthioninium chloride (MTC), 16. April 2015, 2925801, Canadian patent application.
- ↑ Scott Prahl: Tabulated Molar Extinction Coefficient for Methylene Blue in Water. In: OMLC. Scott Prahl & Steve Jacques, 4. März 1998, abgerufen am 13. Oktober 2020 (englisch).
- ↑ T. Rager, A. Geoffroy, R. Hilfiker, J. M. D. Storey: The crystalline state of methylene blue: a zoo of hydrates. In: Phys. Chem. Chem. Phys. Band 14, 2012, S. 7877–8240. doi:10.1039/c2cp40128b.
- ↑ Gundolf Keil: Robert Koch (1843–1910). Ein Essai. In: Medizinhistorische Mitteilungen. Zeitschrift für Wissenschaftsgeschichte und Fachprosaforschung. Band 36/37, 2017/2018 (2021), S. 73–109, hier: S. 86.
- ↑ Brigitte M. Gensthaler: Ehrlichs Methylenblau – Blauer Farbstoff gegen Malaria. In: Pharmazeutische Zeitung. Nr. 39, 2004. HTML
- ↑ B. Peng u. a.: A randomized placebo-controlled trial of intradiscal methylene blue injection for the treatment of chronic discogenic low back pain. In: Pain. Band 149, Nr. 1, 2010, S. 124–129, PMID 20167430.
- ↑ G. Gupta, M. Radhakrishna u. a.: Methylene blue in the treatment of discogenic low back pain. In: Pain physician. Band 15, Nummer 4, 2012 Jul-Aug, S. 333–338, PMID 22828687.
- ↑ J. W. Kallewaard, J. W. Geurts u. a.: Efficacy, Safety, and Predictors of Intradiscal Methylene Blue Injection for Discogenic Low Back Pain: Results of a Multicenter Prospective Clinical Series. In: Pain practice. Band 16, Nummer 4, April 2016, S. 405–412, doi:10.1111/papr.12283, PMID 25753429.
- ↑ X. Zhang, J. Hao u. a.: Clinical Evaluation and Magnetic Resonance Imaging Assessment of Intradiscal Methylene Blue Injection for the Treatment of Discogenic Low Back Pain. In: Pain physician. Band 19, Nummer 8, 2016 Nov-Dec, S. E1189–E1195, PMID 27906950.
- ↑ H. P. Patel, D. R. Chadwick, B. J. Harrison, S. P. Balasubramanian: Systematic review of intravenous methylene blue in parathyroid surgery. In: The British Journal of Surgery. Band 99, Nummer 10, Oktober 2012, S. 1345–1351, doi:10.1002/bjs.8814, PMID 22961511.
- ↑ G. Sweet, S. B. Standiford: Methylene-blue-associated encephalopathy. In: Journal of the American College of Surgeons. Band 204, Nummer 3, März 2007, S. 454–458, doi:10.1016/j.jamcollsurg.2006.12.030, PMID 17324781.
- ↑ Klonus, Hyperreflexie und Agitation bei einer Patientin mit hohem Fluvoxamin-Serumspiegel: Symptome der Serotonin-Toxizität. (PDF; 170 kB) In: Schweiz Med Forum. 8, 2008, S. 100–103.
- ↑ psychotropical.com: Methylene Blue and Serotonin Toxicity: Introduction.
- ↑ R. R. Ramsay, C. Dunford, P. K. Gillman: Methylene blue and serotonin toxicity: inhibition of monoamine oxidase A (MAO A) confirms a theoretical prediction. In: Br J Pharmacol. 152(6), 2007 Nov, S. 946–951. PMID 17721552.
- ↑ NTP technical report on the toxicology and carcinogenesis studies of methylene blue trihydrate (CAS NO. 7220-79-3) in F344/N rats and B6C3F1 mice (gavage studies) (PDF; 11 MB), auf ntp.niehs.nih.gov
- ↑ Pharmacology review(s) (PDF; 8,3 MB), auf accessdata.fda.gov
- ↑ G. M. Tiboni, F. Giampietro, D. Lamonaca: The soluble guanylate cyclase inhibitor methylene blue evokes preterm delivery and fetal growth restriction in a mouse model. In: In Vivo. 2001 Jul-Aug;15(4), S. 333–337. PMID 11695226.
- ↑ Hans-Anton Adams: Zur Diagnostik und Therapie der Schockformen. Empfehlungen der Interdisziplinären Arbeitsgruppe Schock der DIVI – Teil V Septischer Schock. In: Anästh Intensivmed. 46, 2005, S. 290.
- ↑ M. Y. Kirov, O. V. Evgenov, N. V. Evgenov, E. M. Egorina, M. A. Sovershaev, B. Sveinbjørnsson, E. V. Nedashkovsky, L. J. Bjertnaes: Infusion of methylene blue in human spetic shock: A pilot, randomized, controlled study. Crit Care Med 29, 2001, S. 1860–1867.
- ↑ Avoxa-Mediengruppe Deutscher Apotheker GmbH: Frontotemporale Degeneration: Die wenig bekannte Demenz. Abgerufen am 28. Juli 2021.
- ↑ Elias Akoury, Marcus Pickhardt, Michal Gajda, Jacek Biernat, Eckhard Mandelkow: Mechanistic Basis of Phenothiazine-Driven Inhibition of Tau Aggregation. In: Angewandte Chemie International Edition. Band 52, Nr. 12, 2013, S. 3511–3515, doi:10.1002/anie.201208290.
- ↑ a b c d e f Mokhlesi B, Leikin JB, Murray P, Corbridge TC: Adult toxicology in critical care: Part II: specific poisonings. In: Chest. 123. Jahrgang, Nr. 3, März 2003, S. 897–922, doi:10.1378/chest.123.3.897, PMID 12628894 (chestnet.org).
- ↑ a b c d e f Harvey JW, Keitt AS: Studies of the efficacy and potential hazards of methylene blue therapy in aniline-induced methaemoglobinaemia. In: British Journal of Haematology. 54. Jahrgang, Nr. 1, Mai 1983, S. 29–41, doi:10.1111/j.1365-2141.1983.tb02064.x, PMID 6849836 (wiley.com).
- ↑ Ramsay RR, Dunford C, Gillman PK: Methylene blue and serotonin toxicity: inhibition of monoamine oxidase A (MAO A) confirms a theoretical prediction. In: British Journal of Pharmacology. 152. Jahrgang, Nr. 6, November 2007, S. 946–951, doi:10.1038/sj.bjp.0707430, PMID 17721552, PMC 2078225 (freier Volltext).
- ↑ Gillman PK: Methylene blue implicated in potentially fatal serotonin toxicity. In: Anaesthesia. 61. Jahrgang, Nr. 10, Oktober 2006, S. 1013–1014, doi:10.1111/j.1365-2044.2006.04808.x, PMID 16978328.
- ↑ Rosen PJ, Johnson C, McGehee WG, Beutler E: Failure of methylene blue treatment in toxic methemoglobinemia. Association with glucose-6-phosphate dehydrogenase deficiency. In: Annals of Internal Medicine. 75. Jahrgang, Nr. 1, Juli 1971, S. 83–86, doi:10.7326/0003-4819-75-1-83, PMID 5091568.
- ↑ Hewitt, LF: Oxidation-Reduction Potentials in Bacteriology and Biochemistry. In: Oxidation-Reduction Potentials in Bacteriology and Biochemistry. Edn 6 (1950).



