Molybdänacetat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Molybdänacetat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C8H12Mo2O8 | |||||||||||||||
| Kurzbeschreibung |
gelber Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 428,079 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
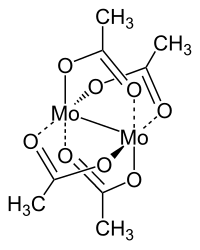
Molybdänacetat ist eine Komplexverbindung des Übergangsmetalls Molybdän aus der Gruppe der Acetate mit der dimeren Konstitutionsformel [Mo(CH3COO)2]2.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Molybdänacetat kann durch Reaktion von Molybdänhexacarbonyl mit einem Überschuss von Eisessig, dem eine kleine Menge Acetanhydrid zugesetzt wurde, gewonnen werden.[2]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Molybdänacetat liegt unter Standardbedingungen als diamagnetischer,[2] brennbarer Feststoff in Form von gelben Kristallnadeln vor. Er ist praktisch unlöslich in Wasser[1] und unlöslich in praktisch allen gängigen Lösungsmitteln. Auch unter Schutzgas erfolgt eine langsame Zersetzung bei Raumtemperatur. Er ist äußerst feuchtigkeitsempfindlich unter Bildung eines grünen Hydrats.[2] Die Verbindung hat eine trikline Kristallstruktur mit der Raumgruppe P1 (Raumgruppen-Nr. 2).[3]
Molekülstruktur
[Bearbeiten | Quelltext bearbeiten]Bei den Molekülen, aus denen der makroskopische Stoff aufgebaut ist, handelt es sich um nach außen elektrisch neutrale, zweikernige Komplexe des Übergangsmetalls Molybdän. Die beiden -konfigurierten Mo(II)-Zentren sind über die Carboxylatgruppen aus vier Acetat-Anionen verbrückt. Diese sind dabei so angeordnet, dass die Sauerstoffatome ein quadratisches Prisma bilden. Der Mo–Mo-Abstand im Kristall beträgt ca. 2,09 Å und ist damit bedeutend kürzer als der aus tabellierten Atomradien berechnete Abstand von 2,90 Å.[4] Dadurch liegt jedes Mo(II)-Zentrum annähernd in einer Ebene mit den vier Sauerstoffatomen, die es koordinieren. Der Komplex kann daher als zusammengesetzt aus zwei quadratisch-planaren Koordinationseinheiten mit einer -Ebene senkrecht zur verbindenden -Achse beschrieben werden. Senkrecht zu und zueinander stehen je ein Paar - und -Ebenen. Die Verbindungsachsen gegenüberliegender Methylgruppen bilden zwei weitere -Achsen. All diese Symmetrieelemente fallen im Inversionszentrum in der Mitte der Mo–Mo-Bindung in eins. Der Komplex gehört damit in die Punktgruppe .[5]
Nachfolgende Tabelle fasst die Ergebnisse von vier Arbeiten zur Strukturaufklärung zusammen. Dabei ist im Hinblick auf die Ergebnisse von Hogan[6] und Kollamana et al.[7] die noch kürzere Mo–Mo-Bindungslänge von ca. 2,08 Å festzuhalten, die Kelley und Fink bei Untersuchungen mit Elektronenbeugung in der Gasphase (Gas-Elektronenbeugung, GED) gemessen haben.[8] Diese empirische Differenz der Mo–Mo-Bindungslänge in Festkörper und Gasphase entspricht in etwa dem Unterschied von 1 %, den Kollamana et al. mithilfe der Dichtefunktionaltheorie (DFT) für die Bindungslänge bei flat-Adsorption auf der (111)-Oberfläche von Kupfer einerseits und für upright-Orientierung andererseits berechnet haben.[7]
| Lawton/Mason 1965[3] (XRD) | Cotton et al. 1974[9] (XRD) | Hino et al. 1981[10] (XRD) | Kelley/Fink 1982[8] (GED) | |
|---|---|---|---|---|
| Abstand Mo–Mo | 2,11(1) Å | 2,0934(8) Å | 2,0885(5) Å | 2,079(3) Å |
| Abstand Mo–O | 2,10(3) Å | 2,119(11) Å | 2,118(2) Å | 2,108(3) Å |
| Abstand O–C | 1,28(4) Å | 1,277(7) Å | 1,272(5) Å | 1,275(3) Å |
| Abstand C–Me | 1,49(4) Å | 1,502(9) Å | 1,496(5) Å | 1,512(6) Å |
| Winkel Mo-Mo-O | n. a. | 91,8(1,2)° | 91,8(1)° | 92,2(2)° |
| Winkel O-C-O | n. a. | 121,3(6)° | 121,8(5)° | 123,0(4)° |
Um besser zu verstehen, warum der Mo–Mo-Abstand in [Mo2(O2CMe)4] so kurz und in der Gasphase noch kürzer ist, und wie sich die Wechselwirkung zwischen den beiden Metallzentren beeinflussen lässt, ist es nötig, sich näher mit der Natur der Metall-Metall-Vierfachbindung zu befassen, die an diesem Molekül und seinen Analoga intensiv studiert worden ist.
Forschungsgeschichte
[Bearbeiten | Quelltext bearbeiten]Dimolybdän(II)-tetraacetat ist einer jener Übergangsmetallkomplexe, denen im Rahmen der „Renaissance der anorganischen Chemie“ nach dem Zweiten Weltkrieg beträchtliche Aufmerksamkeit zuteilwurde, da sich an ihnen mithilfe einer Vielzahl neuartiger instrumenteller Methoden (UV-, IR- und NMR-Spektroskopie, Massenspektrometrie, Röntgenkristallographie) neue Einblicke in die Natur der chemischen Bindung gewinnen ließen.[11] Nachdem die britische Forschungsgruppe um Geoffrey Wilkinson 1960 erstmals seine Synthese aus Molybdänhexacarbonyl publiziert hatte,[12] konnten sie 1963 aufgrund osmometrischer und ebullioskopischer Studien an verschiedenen Molybdän(II)-carboxylaten darauf schließen, dass diese Komplexe dimer vorliegen müssen.[13] Entsprechend dem kurz zuvor etablierten VSEPR-Modell waren sie jedoch noch von tetraedrischer Koordination der Mo(II)-Zentren und damit -Symmetrie wie im AlCl3-Dimer ausgegangen, wobei sie annahmen, dies würde durch den diamagnetischen Charakter der Verbindung belegt. Tatsächlich kann damit zwar beispielsweise eine oktaedrische Koordinationssphäre der -Metallzentren (die selbst in low-spin-Konfiguration noch einen Spin hätten) ausgeschlossen werden, jedoch ist die Ligandenfeldaufspaltung in tetraedrisch koordinierten Komplexen allgemein so gering, dass in ihnen die hypothetische low-spin-Elektronenkonfiguration mit nur äußerst selten angenommen wird.[14] Im gleichen Jahr hatten in den USA Frank A. Cotton et al. erstmals Metall-Metall-Doppelbindungen in [Re3Cl12]3− postuliert und in der UdSSR W. G. Kusnezow und P. A. Kosmin[15] von einer präzedenzlos kurzen Re–Re-Bindung sowie einer ungewöhnlichen Molekülgeometrie in [Re2Cl8]4− berichtet, bei der die Chloridoliganden ein quadratisches Prisma bilden.[16]
Im Jahr darauf schlugen Cotton et al. die Existenz einer Metall-Metall-Vierfachbindung in [Re2Cl8]4− vor,[9] und Lawton und Mason gelang die Aufklärung der Kristallstruktur von Mo2(O2CMe)4 durch Röntgenbeugung.[3] Diese ergab eine Koordinationsgeometrie analog jener der von Cotton et al. untersuchten Verbindungen mit -symmetrischen [Re2Cl8]4−- und [Tc2Cl8]4−-Einheiten. Ähnliche Strukturen waren zwar bereits zuvor von Koordinationsverbindungen -konfigurierter Übergangsmetalle bekannt gewesen, doch weisen jene überbrückten Verbindungen keine Metall-Metall-Abstände auf, die gegenüber der Summe zweier Kovalenzradien, wie sie sich aus der jeweiligen M–O-Bindungslänge ergeben, nennenswert abweichen. (Im Falle von [Cu2(O2CMe)4(H2O)2] kommunizieren die beiden Spinzentren auch ohne enge Metall-Metall-Bindung miteinander. Diese antiferromagnetische Kopplung findet primär in Form eines Superaustauschs über das π-System der Carboxylatbrücken statt.)[17][18][19] Demgegenüber stellte sich der Intermetallabstand von 2,11 Å im Mo2(O2CMe)4 gegenüber dem erwarteten doppelten Kovalenzradius von 2,90 Å[4] ähnlich drastisch verkürzt dar wie im Falle der anderen Verbindungen mit -Zentren, die Cotton et al. untersucht hatten.
In der Folgezeit wurde eine große Vielzahl weiterer Komplexe mit Vierfachbindung zwischen zwei -konfigurierten Metallzentren synthetisiert, wobei Mo2(O2CMe)4 sowohl für die Erforschung der Vierfachbindung als auch für die Synthese nahezu aller Komplexe mit der Mo24+-Einheit weiterhin eine zentrale Rolle einnimmt.[20] Im Jahr 2002 waren bereits über tausend derartige Verbindungen beschrieben worden, und für mindestens 467 lagen röntgenkristallographische Strukturanalysen vor. Die bimodale Verteilung der bekannten Mo–Mo-Vierfachbindungslängen spiegelt die beiden wesentlichen Strukturtypen wider: Die meisten Komplexe mit verbrückenden Liganden finden sich im Bereich 2,06–2,13 Å wieder, diejenigen ohne verbrückende Liganden im Bereich 2,11–2,17 Å.[21] Die ursprünglich von Lawton und Mason für Mo2(O2CMe)4 gemessene Bindungslänge von 2,11 Å wurde in jüngeren Röntenbeugungsexperimenten leicht korrigiert und genauer auf ca. 2,09 Å bestimmt.[20]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Eintrag zu CAS-Nr. 14221-06-8 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 7. Juli 2013. (JavaScript erforderlich)
- ↑ a b c Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1554.
- ↑ a b c D. Lawton, R. Mason: The Molecular Structure of Molybdenum(II) Acetate. In: Journal of the American Chemical Society, 1965, Band 87, Nr. 4, S. 921–922, doi:10.1021/ja01082a046.
- ↑ a b John C. Slater: Atomic Radii in Crystals. In: The Journal of Chemical Physics, 1964, Band 41, Nr. 10, S. 3199–3204, doi:10.1063/1.1725697.
- ↑ David M. Bishop: Group Theory and Chemistry. Clarendon Press, Oxford 1973/1993, ISBN 0-486-67355-3, S. 46/284.
- ↑ R. H. Hogan: Scanning tunneling microscopy and photoelectron spectroscopy of thin film dichromium tetraacetate and dimolybdenum tetraacetate on single crystal graphite and molybdenum disulphide. Diss. University of Arizona, 1990.
- ↑ a b J. Kollamana, Z. Wei, L. Lyu, M. Zimmer, F. Dietrich, T. Eul, J. Stöckl, M. Maniraj, S.~Ponzoni, M. Cinchetti, B. Stadtmüller, M. Gerhards, M. Aeschlimann: Adv. Funct. Mater., 2017, 1703544.
- ↑ a b M. H. Kelley, M. Fink: J. Chem. Phys., 1982, Band 76, S. 1407 ff.
- ↑ a b F. A. Cotton, N. F. Curtis, C. B. Harris, B. F. G. Johnson, S. J. Lippard, J. T. Mague, W. R. Robinson, J. S. Wood: Mononuclear and Polynuclear Chemistry of Rhenium (III): Its Pronounced Homophilicity. In: Science, 1964, Band 145, Nr. 3638, S. 1305–1307, doi:10.1126/science.145.3638.1305.
- ↑ K. Hino, Y. Saito, M. Bénard: Acta Cryst., 1981, Band B37, S. 2164 ff.
- ↑ Lutz H. Gade: Koordinationschemie. Wiley-VCH, Weinheim 1998, ISBN 978-3-527-29503-6, S. 23–24.
- ↑ E. Bannister, G. Wilkinson: Chem. and Ind., 1960, 319.
- ↑ T. A. Stephenson, E. Bannister, G. Wilkinson: Molybdenum(II) carboxylates. In: Journal of the Chemical Society, 1964, S. 2538–2541, doi:10.1039/JR9640002538.
- ↑ E. K. Byrne, D. S. Richeson, K. H. Theopold: Tetrakis(1-norbornyl)cobalt, a low spin tetrahedral complex of a first row transition metal. In: Journal of the Chemical Society, Chemical Communications, 1986, S. 1491–1492, doi:10.1039/C39860001491.
- ↑ В. Г. Кузнецов, П. А. Козьмин: Исследование структуры (РyН)НReCl4. In: Журнал структурной химии, 1963, Band 4, Nr. 1, S. 55–62. Online bei der sibirischen Abteilung der Russischen Akademie der Wissenschaften.
- ↑ Frank A. Cotton: My Life in the Golden Age of Chemistry: More Fun Than Fun. Elsevier, Oxford 2014, ISBN 978-0-12-801338-0 (E-Book), S. 121 ff.
- ↑ B. Bleaney, K. D. Bowers: Anomalous paramagnetism of copper acetate. In: Proceedings of the Royal Society, 1952, Band A214, Nr. 1119, S. 451–465, doi:10.1098/rspa.1952.0181.
- ↑ M. Gerloch, J. H. Harding: Superexchange in copper acetates. In: Proceedings of the Royal Society, 1978, Band A360, Nr. 1701, S. 211–227, doi:10.1098/rspa.1978.0064.
- ↑ Ayahan Elmali: The Magnetic Super-Exchange Coupling in Copper(II) Acetate Monohydrate and a Redetermination of the Crystal Structure. In: Turk. J. Phy., 2000, Band 24, S. 667–672. Online auf der Website von TÜBITAK.
- ↑ a b F. A. Cotton, Z. C. Mester, T. R. Webb: Dimolybdenum tetraacetate. In: Acta Crystallographica, 1974, Band B30, S. 2768–2770, doi:10.1107/S0567740874008053.
- ↑ F. A. Cotton, L. M. Daniels, E. A. Hillard, C. A. Murillo: The Lengths of Molybdenum to Molybdenum Quadruple Bonds: Correlations, Explanations, and Corrections. In: Inorganic Chemistry, 2002, Band 41, Nr. 9, S. 2466–2470, doi:10.1021/ic025508c.

![{\displaystyle \mathrm {[Mo(CH_{3}COO)_{2}]_{2}+12\ CO+2\ H_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/6f4df8c44e1c2eebde29deddf4c2b6449b4e398e)













