Paclitaxel
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
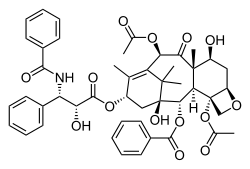
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Paclitaxel | |||||||||||||||||||||
| Andere Namen |
(2α,4α,5β,7β,10β,13α)-4,10-Bis(acetyloxy)-13-{[(2R,3S)-3-(benzoylamino)-2-hydroxy-3-phenylpropanoyl]oxy}-1,7-dihydroxy-9-oxo-5,20-epoxytax-11-en-2-yl-benzoat (IUPAC) | |||||||||||||||||||||
| Summenformel | C47H51NO14 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 853,92 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
abhängig von der Modifikation und der Messmethode werden Löslichkeiten von ca. 0,1 mg·l−1 bis zu 30 mg·l−1 in Wasser angegeben.[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Paclitaxel (Taxol) wird als Arzneistoff zur Behandlung verschiedener Krebsarten (z. B. Brustkrebs) eingesetzt.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Paclitaxel ist eine in der Rinde der Pazifischen Eibe (Taxus brevifolia) vorkommende Substanz aus der Gruppe der Taxane.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Paclitaxel ist bei Raumtemperatur ein farbloser Feststoff. In Wasser ist er kaum löslich. Es gibt mindestens drei kristalline Formen, eine davon ist ein Dihydrat. Es sind auch glasig erstarrte Modifikationen mit einem Glasübergang um 152 °C beschrieben. Die verschiedenen Angaben zur Löslichkeit können auf das Vorliegen unterschiedlicher Kristallstrukturen bzw. die Bildung eines schwerer löslichen Dihydrates in wässriger Lösung zurückgeführt werden.
Gewinnung
[Bearbeiten | Quelltext bearbeiten]

Paclitaxel kann aus der Pazifischen Eibe (Taxus brevifolia) gewonnen werden. Da diese Eibenart nur sehr wenig verbreitet und der Taxolgehalt gering ist, kann der Weltbedarf an Paclitaxel so nicht gedeckt werden. Dieser ursprüngliche Herstellungsprozess benötigt für 1 Gramm Paclitaxel die Rinde von 12 gefällten Bäumen und eine Nachbehandlungszeit von etwa 9 Wochen.[6] Seit einigen Jahren wird daher Paclitaxel partialsynthetisch aus Baccatin III gewonnen, das in den Nadeln der Europäischen Eibe (Taxus baccata) vorkommt. Dies geschieht nach dem Ojima-Holton-Verfahren, das unter anderem von Iwao Ojima entwickelt wurde. Eine weitere Methode zur industriellen Herstellung ist die biotechnologische Gewinnung von Paclitaxel aus Eibenzellkulturen.[7]
Eine Totalsynthese von Paclitaxel wurde erstmals im Jahr 1994 von Kyriacos C. Nicolaou beschrieben, fand jedoch keine industrielle Verwendung. Eine weitere Synthesemöglichkeit mithilfe der Chan-Umlagerung wurde im selben Jahr von Robert A. Holton gefunden.
Entdeckung
[Bearbeiten | Quelltext bearbeiten]Monroe E. Wall und Mansukh C. Wani führten in den späten 1960er-Jahren gemeinsam eine umfassende Suche nach Anti-Krebs-Wirkstoffen durch. Dabei konnten sie im Jahre 1971 die Substanz Paclitaxel durch Extraktion der Rinde der Pazifischen Eibe (Taxus brevifolia) erstmals isolieren, charakterisieren und seine wucherungshemmende Wirkung auf Zellen, u. a. Krebszellen, feststellen.[8]
Analytik
[Bearbeiten | Quelltext bearbeiten]Zur zuverlässigen qualitativen und quantitativen Bestimmung von Paclitaxel kann nach adäquater Probenvorbereitung die Kopplung der HPLC mit der Massenspektrometrie eingesetzt werden. Die Methodik eignet sich sowohl zum Nachweis in Blut- oder Plasmaproben als auch in Urinproben.[9] Auch der Nachweis in getrockneten Blutproben ist mit dieser analytischen Technik möglich.[10]
Pharmakologie
[Bearbeiten | Quelltext bearbeiten]Anwendungsgebiete
[Bearbeiten | Quelltext bearbeiten]Paclitaxel wird in der Therapie maligner Tumoren (Chemotherapie) eingesetzt. Zu seinen Anwendungsgebieten gehören:
- Ovarialkarzinom (in Kombination mit Cisplatin oder Carboplatin),
- Mammakarzinom[11] (ggf. in Kombination mit Trastuzumab)
- Nicht-kleinzelliges Bronchialkarzinom (in Kombination mit oder Carboplatin)[11]
- Adenokarzinom der Bauchspeicheldrüse (in Kombination mit Gemcitabin)[11]
- Prostatakarzinom (hier vor allem die synthetische Variante Docetaxel).
Ferner wird es neben Sirolimus bei der Herzkatheterisierung (perkutane transluminale Koronarangioplastie, PTCA) zur Beschichtung von Stents („drug-eluting stents“) und Medikament-freisetzender Ballonkatheter (Drug-Eluting Ballons) verwendet, wodurch das Risiko eines erneuten Verschlusses der Koronararterie vermindert werden soll.
Wirkmechanismus
[Bearbeiten | Quelltext bearbeiten]Paclitaxel wirkt, indem es die Teilung von Zellen (Mitose) stört. Es gehört damit zur Familie der Zytoskelett-Inhibitoren. Es bindet an β-Tubulin und stört den Abbau von Mikrotubuli, die bei der Mitose Bestandteil der essenziellen Mitosespindel sind. Im Gegensatz zu Colchicin, Vinblastin und Nocodazol, die direkt den Aufbau der Mikrotubuli hemmen, inhibiert Paclitaxel deren Abbau.
Es wirkt somit auf alle sich teilenden Zellen und kann dementsprechende Nebenwirkungen verursachen. Da sich Krebszellen im Vergleich zu gesunden Zellen schnell teilen, sind diese jedoch stärker betroffen.
Eine verbesserte Pharmakokinetik wird durch die Formulierung von Paclitaxel als Paclitaxel-Albumin-Nanopartikel erreicht (siehe Abschnitt nab-Paclitaxel).
Nebenwirkungen
[Bearbeiten | Quelltext bearbeiten]Unter der Therapie mit Paclitaxel konnten folgende Nebenwirkungen beobachtet werden, die charakteristisch für die meisten Zytostatika sind: Knochenmarksuppression mit Blutbildveränderungen (Thrombozytopenie, Neutropenie, Anämie), Neuropathien (insbesondere Parästhesien), Myalgien, Haarausfall, gastrointestinale Nebenwirkungen (z. B. Übelkeit, Erbrechen, Durchfall).
Pharmazeutische Informationen
[Bearbeiten | Quelltext bearbeiten]Paclitaxel ist schwer wasserlöslich und muss durch geeignete Lösungsvermittler wie z. B. Ethanol und Macrogolglycerolricinoleat (Cremophor) für die therapeutisch erforderlichen Konzentrationen in Lösung gebracht werden. Macrogolglycerolricinoleat führt häufig zu Überempfindlichkeitsreaktionen (allergische Reaktionen). Alternative, macrogolglycerolricinoleatfreie Darreichungsformen stellen nanopartikuläre Formulierungen wie an Humanalbumin gebundenes oder in Liposomen verkapseltes Paclitaxel dar.
Im sogenannten nab-Paclitaxel (nanoparticle albumin bound paclitaxel) liegt Paclitaxel an Albumin-Nanopartikel einer mittleren Größe von ungefähr 130 Nanometer gebunden vor. Das als Lyophilisat formulierte Pulver (Handelsname Abraxane, EU-weit zugelassen im Januar 2008) wird unmittelbar vor der Anwendung mit isotonischer Kochsalzlösung zu einer infundierbaren Suspension rekonstituiert. Aufgrund der fehlenden Lösungsvermittler ist keine Prämedikation gegen Hypersensitivitätsreaktionen (HSR) erforderlich. Die Nanopartikel selbst bewirken auch eine bessere Verteilung des Wirkstoffs im Körper, was zu einer linearen Pharmakokinetik führt. Im Gegensatz zu konventionell formulierten Taxanen sind höhere Dosierungen möglich.[12][13][14]
Der Transport als hydrophiles Makromolekül im Blutstrom ist verantwortlich für einen verstärkt tumorgerichteten Wirkmechanismus. Durch den caveolären Transportmechanismus kommt es zu einem selektiven Austritt aus dem Blutstrom. Paclitaxel diffundiert direkt in die Tumorzellen und führt zur Apoptose der Tumorzellen. Insgesamt kommt es dadurch zu mehr Wirkstoffanreicherung am Tumor und weniger im gesunden Gewebe.[15][16]
nab-Paclitaxel ist – unter dem Handelsnamen Abraxane® – in der EU in den Indikationen metastasierter Brustkrebs (Mammakarzinom), metastasierter Bauchspeicheldrüsenkrebs (Pankreaskarzinom) und nicht kleinzelliger Lungenkrebs (Bronchialkarzinom) zugelassen und wird in verschiedenen Indikationen weiterentwickelt u. a. auch bei Hautkrebs (Melanom).[14][17]
Liposomal verkapseltes Paclitaxel wird in China (Handelsname Lipusu) zur Behandlung des Eierstockkrebses eingesetzt, ferner begleitend zur Radiotherapie des Brustkrebs sowie in der Therapie des inoperablen nicht-kleinzelligen Bronchialkarzinoms. In Europa wird als EndoTAG-1 eine liposomale Paclitaxelformulierung zur Behandlung des Bauchspeicheldrüsenkrebses (Pankreaskarzinom) entwickelt, der 2006 der Status als Orphan-Arzneimittel zugewiesen wurde.[18]
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Monopräparate
Abraxane (EU), Celltaxel (D), Ebetaxel (A), NeoTaxan (D), Paxene (A), Ribotax (D), Taxol (D, A, CH), Taxomedac (D), weitere Generika (D, A, CH)[19][20][21]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Literatur
[Bearbeiten | Quelltext bearbeiten]- Eckhard Leistner: Die Biologie der Taxane. In: Pharmazie in unserer Zeit, Band 34, 2005. S. 98–103. doi:10.1002/pauz.200400108
- Hans-Peter Lipp, Carsten Bokemeyer: Therapie solider Tumoren: Wirksamkeit und Toxizität der Taxane. In: Pharmazie in unserer Zeit, Band 34, 2005. S. 128–137. doi:10.1002/pauz.200400113
- Volker Bartsch: Das Taxol-Buch: 55 Tabellen. 2., erw. und aktualisierte Auflage. Thieme, Stuttgart / New York 2004, ISBN 3-13-105462-X.
- William J. Gradishar, Sergei Tjulandin, Neville Davidson, Heather Shaw, Neil Desai, Paul Bhar, Michael Hawkins, Joyce O’Shaughnessy: Phase III Trial of Nanoparticle Albumin-Bound Paclitaxel Compared With Polyethylated Castor Oil–Based Paclitaxel in Women With Breast Cancer. In: Journal of Clinical Oncology. Band 23, Nr. 31, 1. November 2005, S. 7794–7803, doi:10.1200/JCO.2005.04.937 (ascopubs.org).
- William J. Gradishar, Dimitry Krasnojon, Sergey Cheporov, Anatoly N. Makhson, Georgiy M. Manikhas, Alicia Clawson, Paul Bhar: Significantly Longer Progression-Free Survival With nab-Paclitaxel Compared With Docetaxel As First-Line Therapy for Metastatic Breast Cancer. In: Journal of Clinical Oncology. Band 27, Nr. 22, 1. August 2009, S. 3611–3619, doi:10.1200/JCO.2008.18.5397 (ascopubs.org).
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Mehr zu Taxol
- Biosynthese des Paclitaxel
- Wissenschaftliche Literatur. Pubmed.
- Öffentlicher Beurteilungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) zu: Paclitaxel
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu Paclitaxel bei Thermo Fisher Scientific, abgerufen am 13. Oktober 2023.
- ↑ Datenblatt Paclitaxel, Semi-Synthetic (PDF) bei Calbiochem, abgerufen am 7. Dezember 2015.
- ↑ Liggins u. a.: Solid-state characterization of paclitaxel. In: J. Pham. Sci., Band 86, 1997. S. 1458–1463. PMID 9423162.
- ↑ a b Datenblatt Paclitaxel from Taxus brevifolia, ≥95% (HPLC) bei Sigma-Aldrich, abgerufen am 22. Oktober 2016 (PDF).
- ↑ B. D. Tarr, T. G. Sambandan, S. H. Yalkowsky: A new parenteral emulsion for the administration of taxol. In: Pharmaceutical research, Band 4, Nummer 2, April 1987. S. 162–165, doi:10.1023/a:1016483406511, PMID 2908138.
- ↑ K. V. Rao: Taxol and related taxanes. I. Taxanes of Taxus brevifolia bark. In: Pharmaceutical Research. Band 10, Nr. 4, 1. April 1993, S. 521–524, PMID 8097872.
- ↑ Paclitaxel aus Fermentern. In: Pharmazeutische Zeitung, Ausgabe 34/2002, (online).
- ↑ M. C. Wani, H. L. Taylor, M. E. Wall, P. Coggon, A. T. McPhail: Plant antitumor agents. VI. Isolation and structure of taxol, a novel antileukemic and antitumor agent from Taxus brevifolia. In: J. Am. Chem. Soc., Band 93, Nr. 9, 1971. S. 2325–2327, doi:10.1021/ja00738a045.
- ↑ S. Malhi, N. Stesco, S. Alrushaid, T. M. Lakowski, N. M. Davies & X. Gu: Simultaneous quantification of reparixin and paclitaxel in plasma and urine using ultra performance liquid chromatography-tandem mass spectroscopy (UHPLC-MS/MS): Application to a preclinical pharmacokinetic study in rats. In: J Chromatogr B Analyt Technol Biomed Life Sci., Bd. 1046, 1. März 2017. S. 165–171. PMID 28187377
- ↑ F. Xie, E. De Thaye, A. Vermeulen, J. Van Bocxlaer & P. Colin: A dried blood spot assay for paclitaxel and its metabolites. In: J Pharm Biomed Anal., Bd. 148, 30. Januar 2018. S. 307–315. PMID 29078175
- ↑ a b c Fachinfo Abraxane. Juli 2015.
- ↑ Zusammenfassung der Merkmale des Arzneimittels. European Medicines Agency, EMA (deutsch).
- ↑ Summary of the European Public Assessment Report (EPAR) European Medicines Agency, EMA (englisch).
- ↑ a b Zusammenfassung des EPAR für die Öffentlichkeit. (PDF; 116 kB) European Medicines Agency, EMA (deutsch).
- ↑ V. T. G. Chuang u. a.: Pharmaceutical Strategies Utilizing Recombinant Human Serum Albumin. In: Pharmaceutical Research, Bd. 19, Nr. 5, 2002. S. 569–577. doi:10.1023/A:1015396825274.
- ↑ N. Desai u. a.: Increased antitumor activity, intratumor paclitaxel concentrations, and endothelial cell transport of cremophor-free, albumin-bound paclitaxel, ABI-007, compared with cremophor-based paclitaxel. In: Clin Cancer Res., Bd. 12, 2006; doi:10.1158/1078-0432.CCR-05-1634
- ↑ ABRAXANE® Demonstrates Significant Improvement in Progression-Free Survival Compared to Standard Chemotherapy in Advanced Melanoma Patients. Celgene International Sàrl, Pressemeldung zu Melanom (englisch).
- ↑ Orphan designation EU/3/06/419
- ↑ Rote Liste Online, Stand: August 2009.
- ↑ Arzneimittelkompendium der Schweiz, Stand: August 2009.
- ↑ AGES-PharmMed, Stand: August 2009.