Phosphonate

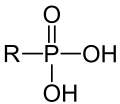
Als Phosphonate werden die Salze und Ester der Phosphonsäure H-P(O)(OH)2 – oder daraus abgeleitete organische Phosphonsäuren R-PO(OH)2 (R = Alkyl-Rest oder Aryl-Rest) — bezeichnet.[1] Es existieren primäre und sekundäre Phosphonate, bei denen entsprechend ein bzw. beide Wasserstoffatome der OH-Gruppen durch eine Metallion, bzw. durch einen organischen Rest ersetzt wurden: H-P(O)(OH)(OM') bzw. H-P(O)(OH)(OR') und H-P(O)(OM')2 bzw. H-P(O)(OR')2 (M'=einwertiges Metall, R'=organischer Rest).[2][1] Wie bei organischen Phosphaten liegen bei den Estern C-O-P-Bindungen vor, die sich im Vergleich zu C-P-Bindungen viel leichter hydrolysieren lassen. In Verbindungen dieses Typs sind die Eigenschaften eines Salzes (bzw. einer Säure) mit den Eigenschaften von organischen Verbindung verknüpft. So gibt es viele Verbindungen dieses Typs, die in Wasser löslich sind. Formal sind Verbindungen vom Typ R-PO(OH)2 keine Phosphonate, sondern zählen zu den organische Phosphonsäuren.[3]
Technische Anwendungen
[Bearbeiten | Quelltext bearbeiten]Ein wichtiger industrieller Gebrauch von Phosphonsäuren und Phosphonaten ist in Kühlwassersystemen, Entsalzungsanlagen und bei der Ölförderung, wo sie die Ausfällung von Salzen verhindern. In der Papier- und Textilindustrie werden sie als Stabilisator für die Peroxidbleiche eingesetzt und komplexieren dort Metalle, welche sonst das Peroxid inaktivieren würden.[4] In Waschmitteln werden sie als eine Kombination von Komplexbildnern, zur Verhinderung von Ausfällungen und als Bleichmittelstabilisator eingesetzt. Sie können ähnliche Eigenschaften wie EDTA haben und als Ersatz von Pentanatriumtriphosphat dienen. Sie sind Komplexbildner und dienen vor allem als Wasserenthärter. Als Builder können sie den Ionentauscher bzw. den Enthärter Zeolith A als Carrier unterstützen. Sie können als Korrosionsinhibitoren mitwirken oder als Stabilisator für Peroxide (z. B. in Bleichmitteln) dienen.[4] 1998 wurden weltweit etwa 56.000 Tonnen Phosphonate verwendet – 40.000 Tonnen in den USA, 15.000 Tonnen in Europa und weniger als 800 Tonnen in Japan.[4]
In der Medizin
[Bearbeiten | Quelltext bearbeiten]
Phosphonate werden in der Medizin verwendet, vor allem zur Behandlung von Knochenkrankheiten und von Ca-Metabolismus-Störungen.[4] Unter Bisphosphonaten wird in der Medizin Verbindungen der Phosphonsäure mit der allgemeinen Konstitutionsformel ((O3P)2-C-R1R2)4− verstanden. Sie sind Analoga zu Diphosphaten (Pyrophosphate) (O3P-O-PO3)4− und greifen in die Calcium-Homöostase ein. Sie werden daher unter anderem zur Behandlung der Osteoporose und von Knochenmetastasen eingesetzt.
Synthese
[Bearbeiten | Quelltext bearbeiten]Halogenierte Phosphonate können durch die Michaelis-Becker-Reaktion dargestellt werden.[5] Silylphosphonate können durch eine Kinnear-Perren-Reaktion erzeugt werden.[6]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Philippe Savignac, Bogdan Iorga: Modern Phosphonate Chemistry. CRC Press, 2003, ISBN 0-203-50367-8.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag zu Phosphonate und Phosphite. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. November 2021.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 794–795.
- ↑ Eintrag zu Phosphor-organische Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. November 2021.
- ↑ a b c d Eugenia Valsami-Jones: Phosphorus in Environmental Technology: Principles and Applications. IWA Publishing, 2004, ISBN 978-1-84339-001-5, S. 149 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Robert Engel: Handbook of organophosphorus Chemistry. CRC Press, 1992, ISBN 0-8247-8733-1, S. 280 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Philippe Savignac, Bogdan Iorga: Modern Phosphonate Chemistry. CRC Press, 2003, ISBN 0-203-50367-8, S. 521 (eingeschränkte Vorschau in der Google-Buchsuche).