Photorespiration
| Übergeordnet |
|---|
| Rückgewinnungsprozess |
| Gene Ontology |
| QuickGO |

Die Photorespiration (altgriechisch φῶς phōs „Licht“, lateinisch respiratio „Atmung“), auch oxidativer photosynthetischer Kohlenstoffzyklus bzw. (oxidativer) C2-Zyklus, ist ein Stoffwechselweg in Organismen, die eine oxygene Photosynthese betreiben (Pflanzen, Algen, Cyanobakterien). Hierbei wird Kohlenstoffdioxid in einer lichtabhängigen Reaktion freigesetzt und Sauerstoff wie in der Atmung verbraucht. Daher bezeichnet man den Stoffwechselweg auch als „Lichtatmung“.[1] Diese Bezeichnung lehnt an die der Zellatmung („Dunkelatmung“) an, da dort ebenso Kohlenstoffdioxid entsteht und Sauerstoff verbraucht wird. Jedoch haben beide Vorgänge nichts miteinander zu tun.
Die Photorespiration kann im Zuge der Kohlenstoffdioxidfixierung im Calvin-Zyklus während der Photosynthese auftreten. Normalerweise nutzt das beteiligte Schlüsselenzym RuBisCO als Substrat Kohlenstoffdioxid, alternativ akzeptiert es aber auch Sauerstoff. Dadurch entsteht das toxische Stoffwechselprodukt 2-Phosphoglycolat, das nicht mehr im Calvin-Zyklus verwendet werden kann und daher durch andere biochemische Reaktionen umgewandelt werden muss. In höheren Pflanzen finden diese Reaktionen in drei eng benachbarten Zellkompartimenten statt: den Chloroplasten, den Peroxisomen und den Mitochondrien. Es handelt sich im Wesentlichen um einen Rückgewinnungsprozess.
Der photorespiratorische Stoffwechselweg gilt als einer der verschwenderischsten Prozesse auf der Erde.[2]
Entdeckungsgeschichte
[Bearbeiten | Quelltext bearbeiten]
Die ersten Aufzeichnungen über die Auswirkung der Photorespiration stammen von Otto Warburg. Er beobachtete 1920 in der Süßwasseralge Chlorella, dass die Kohlenstoffdioxidaufnahme durch Sauerstoff gehemmt werden kann.[3] Der Wissenschaftler John P. Decker konnte hierbei nachweisen, dass bei Anwesenheit von Licht und Sauerstoff vermehrt Kohlenstoffdioxid freigesetzt wird.[4] Ohne die biochemischen Prozesse zu kennen, konnten die beiden Wissenschaftler damit auf die Bedeutung von Sauerstoff in der Photorespiration schließen.

Weitere Schritte in der Aufklärung beschäftigten sich mit der Rolle von Glycolat als einer der ersten Stoffwechselprodukte der Photorespiration und behandelten den Einfluss von Sauerstoff und Kohlenstoffdioxid auf diesen Prozess.
So konnten Warburg und Günter Krippahl 1960 zeigen, dass hohe Sauerstoffkonzentrationen die Bildung von Glycolat verursachen.[5] Dies wurde zwei Jahre später von James A. Bassham und Martha Kirk in Chlorella bestätigt, die ebenfalls einen sauerstoffabhängigen Anstieg an Glycolat bzw. 2-Phosphoglycolat messen konnten.[6] Israel Zelitch vermutete 1964, dass Glycolat ein wichtiges Intermediat bei der Photorespiration darstelle.[7] Außerdem beobachteten Bassham und Kirk, dass Sauerstoff die Photosynthese hemmen (inhibieren) kann.
Die durch Sauerstoff hervorgerufene Bildung von Glycolat wird durch hohe Kohlenstoffdioxidkonzentrationen umgekehrt, wie im Folgejahr durch Bermingham und Mitarbeiter demonstriert wurde.[8] Das zeigt, dass Sauerstoff und Kohlenstoffdioxid miteinander konkurrieren. Im Jahr 1966 wurden diese Ergebnisse durch die Arbeitsgruppe um Gleb Krotkov validiert: Die sauerstoffabhängige Inhibition der Photosynthese verringert sich durch steigende CO2-Konzentrationen.[9]
Die erste Theorie über den photorespiratorischen Stoffwechselweg wurde 1971 von Nathan E. Tolbert vorgeschlagen.[10]
Basierend auf den vorausgegangenen Beobachtungen und eigenen Untersuchungen konnten George E. Bowes und William L. Ogren im selben Jahr mit dem aus Sojabohnen isolierten Enzym RuBisCO (Ribulose 1,5-Bisphosphat Carboxylase/Oxygenase) demonstrieren, dass sowohl Kohlenstoffdioxid als auch Sauerstoff als Substrate für RuBisCO dienen.[11] Zu diesem Zeitpunkt nannte man RuBisCO noch „Ribulosebisphosphatcarboxylase“, da nur ihre carboxylierende, also kohlenstoffassimilierende Funktion bekannt war. Reagiert RuBisCO mit Sauerstoff anstatt mit Kohlenstoffdioxid, wird 2-Phosphoglycolat gebildet.[12] Damit hat das Enzym sowohl eine Carboxylase-, als auch eine Oxygenasefunktion, wodurch der heute verwendete Name zustande kommt. Die Abkürzung RuBisCO für das Enzym wurde 1979 von David Eisenberg bei einem Seminar eingeführt.[13]
Diese Schlussfolgerungen wurden zunächst nur zögerlich akzeptiert. Die Arbeitsgruppe um Tolbert konnte 1973 jedoch mit isotopenmarkierten Substraten (14C-Ribulose-1,5-bisphosphat und 18O2) den Nachweis für die Oxygenasereaktion von RuBisCO zweifelsfrei belegen.[14][15] Aufgrund dieser Ergebnisse und der vorausgegangenen Arbeiten und Theorien wird in der Literatur Tolbert als der Entdecker der Photorespiration geführt.
Weitere Untersuchungen in den Folgejahren behandelten die Messungen der Reaktionskinetiken von RuBisCO, den Einfluss der Temperatur auf die Photorespiration sowie die Charakterisierung aller beteiligten Enzyme. Kenntnisse über die Translokatoren für den Austausch der Metabolite zwischen den Organellen sind dagegen noch begrenzt und bleiben weiterhin Gegenstand der Forschung.
Biochemie der Oxygenasefunktion
[Bearbeiten | Quelltext bearbeiten]
Grüne Pflanzen, Algen sowie Cyanobakterien („Blaualgen“) nehmen Kohlenstoffdioxid auf, um daraus im Calvin-Zyklus Kohlenhydrate aufzubauen. Der erste Schritt erfolgt durch das Enzym Ribulose-1,5-bisphosphat-Carboxylase/-Oxygenase (RuBisCO), das die Addition von CO2 an Ribulose-1,5-bisphosphat (1, vgl. Abbildung oberer Zweig) katalysiert. Dadurch werden zwei Moleküle 3-Phosphoglycerat (3, obere Abbildung) gebildet und im Calvin-Zyklus weiter prozessiert.
Als Nebenreaktion akzeptiert RuBisCO auch Sauerstoff („Oxygenasereaktion“), wodurch neben 3-Phosphoglycerat (3) das 2-Phosphoglycolat (4) entsteht (vgl. Abbildung unterer Zweig). 3-Phosphoglycerat fließt regulär in den Calvin-Zyklus ein. Jedoch kann 2-Phosphoglycolat weder direkt zu einem Kohlenhydrat aufgebaut werden, noch wird es für den Metabolismus in irgendeiner Form benötigt. Grünalgen beispielsweise scheiden dessen dephosphorylierte Form, Glycolat, bei guter CO2-Versorgung aus (photosynthetische Glycolatexkretion).[16]
Die Photorespiration ist ein Stoffwechselweg, der 2-Phosphoglycolat durch eine Reihe von Reaktionen in 3-Phosphoglycerat überführt und damit dem Kohlenstoffverlust entgegenwirkt. Für diese Regeneration werden neun Enzyme benötigt; in höheren Pflanzen findet sie unter Beteiligung des Cytosols im Chloroplast, im Peroxisom sowie im Mitochondrium statt.
Die Bildung von 2-Phosphoglycolat im Chloroplasten erfolgt durch RuBisCO ausschließlich im Licht, da das Enzym im Dunkeln nicht aktiv ist. So erklärt sich der erste Teil im Namen Photorespiration. Damit läuft die Photorespiration immer parallel zum Calvin-Zyklus ab.
Ursache und Temperaturabhängigkeit
[Bearbeiten | Quelltext bearbeiten]Die Nebenreaktion des Enzyms RuBisCO und das damit verbundene Auftreten des photorespiratorischen Stoffwechselweges liegt daran, dass RuBisCO sowohl CO2 wie auch O2 als Substrat umsetzt. Zwar ist die Affinität von RuBisCO zu CO2 höher als zu O2, der KM-Wert beträgt für CO2 9 µMol/l, für O2 350 µMol/l[17] und damit wird CO2 gegenüber O2 bevorzugt, jedoch ist die Konzentration von Sauerstoff im Wasser 20-mal höher als die von CO2.[18] Dadurch wird jedes vierte bis jedes zweite Molekül Ribulose-1,5-bisphosphat mit Sauerstoff anstatt Kohlenstoffdioxid umgesetzt.
| Temperatur | CO2-Konzentration im Wasser in µM | O2-Konzentration im Wasser in µM | Konzentrationenverhältnis CO2 / O2 |
|---|---|---|---|
| 5 °C | 21,93 | 401,2 | 0,0515 |
| 15 °C | 15,69 | 319,8 | 0,0462 |
| 25 °C | 11,68 | 264,6 | 0,0416 |
| 35 °C | 9,11 | 228,2 | 0,0376 |
Da RuBisCO sowohl Kohlenstoffdioxid als auch Sauerstoff als Substrat verwenden kann, tritt die Oxygenasereaktion von RuBisCO umso häufiger auf, je niedriger die Kohlenstoffdioxidkonzentration im Verhältnis zur Sauerstoffkonzentration ist. Dieses Verhältnis sinkt mit der Temperatur. Die Löslichkeit eines Gases fällt mit steigender Temperatur, bei CO2 jedoch stärker als bei O2 (vgl. Tabelle). Bei gleichem Verhältnis der Partialdrucke beider Gase verringert sich deshalb das Verhältnis von gelöstem CO2 zu gelöstem O2 mit steigender Temperatur. Für eine CO2-Fixierung wird es damit ungünstiger. Außerdem werden bei höheren Temperaturen die Spaltöffnungen des Blattes geschlossen, um den Wasserverlust der Pflanze zu verringern. Dies bedeutet, dass auch weniger CO2 in die Zelle gelangt, während der lokale O2-Gehalt durch Photolyse ansteigt.[20] Hohe Temperaturen begünstigen infolgedessen die Photorespiration.
Ablauf der Photorespiration
[Bearbeiten | Quelltext bearbeiten]Der Glycolatweg
[Bearbeiten | Quelltext bearbeiten]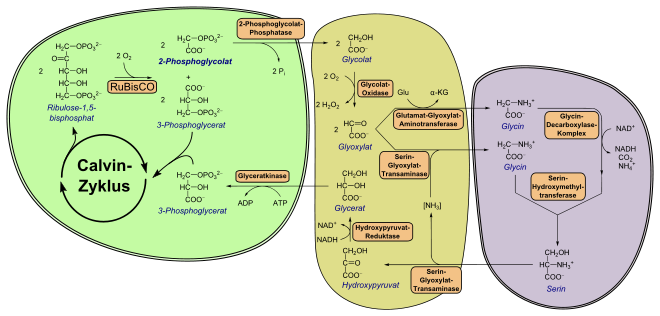
Das im Chloroplasten gebildete 2-Phosphoglycolat wird zunächst durch eine Phosphoglycolat-Phosphatase (PGP, EC 3.1.3.18) zu Glycolat umgesetzt. Die Enzymaktivität ist für Pflanzen essentiell, falls das Enzym beispielsweise fehlt, können diese unter natürlichen CO2-Konzentrationen nicht wachsen. Obwohl Pflanzen auch über eine cytosolische PGP verfügen, spielt nur das plastidäre Isoenzym eine Rolle in der Photorespiration.[21]
Glycolat wird durch einen Glycolat-Glycerat-Antiporter aus dem Chloroplasten transportiert und gelangt durch Porin-ähnliche Kanäle in das Peroxisom. In assimilierenden Blattzellen höherer Pflanzen liegt ein besonderer Typ von Peroxisom vor, weswegen es als Blattperoxisom bezeichnet wird.[16]
Im Peroxisom wird Glycolat durch eine Flavinmononukleotid (FMN)-abhängige Glycolat-Oxidase (EC 1.1.3.15) irreversibel zu Glyoxylat oxidiert.[22] Das Enzym liegt als Tetra- oder Oktamer identischer Untereinheiten vor. Während Mais nur über eine Genkopie dieses Enzyms verfügt, wurden in der Ackerschmalwand fünf Kopien identifiziert. Falls diese Genkopien entfernt werden, können diese Pflanzen nur unter hohen CO2-Konzentrationen wachsen. Bei der Oxidation zu Glyoxylat wird Sauerstoff verbraucht, was auf den zweiten Teil des Begriffs Photorespiration hinweist: Wie allgemein in der aeroben Atmung wird Sauerstoff konsumiert, und später Kohlenstoffdioxid freigesetzt (siehe weiter unten).
Bei dem Schritt entsteht Wasserstoffperoxid (H2O2), welches für die Zelle giftig ist. Daher wird H2O2 durch eine Katalase zu Wasser und Sauerstoff (O2) abgebaut.

Das Glyoxylat wird durch zwei Enzyme umgesetzt:
- als α-Ketosäure wird Glyoxylat durch die Serin-Glyoxylat-Transaminase (EC 2.6.1.45), ein Homodimer, zu Glycin transaminiert; der Donor der NH2-Gruppe ist das erst nachfolgend entstehende L-Serin. Das Enzym bevorzugt als Stickstoffdonor L-Serin; für den photorespiratorischen Weg ist es essentiell.
- ein weiteres Molekül Glyoxylat wird durch eine Glutamat-Glyoxylat-Aminotransferase (EC 2.6.1.4) zu Glycin umgesetzt, wobei als Aminogruppendonor L-Glutamat (Glu) dient. Dabei entsteht α-Ketoglutarat. Diese Aminotransferase kann neben L-Glutamat auch L-Alanin als N-Donor verwenden.[21]
Die beiden erzeugten Moleküle Glycin werden schließlich ins Mitochondrium transportiert. Dort vereinigen sie sich in einer Tetrahydrofolsäure (THF)-abhängigen Reaktion zu einem Molekül L-Serin. Hierbei sind sowohl ein Glycin-Decarboxylase-Komplex (GDC) als auch eine Serin-Hydroxymethyltransferase (SHMT, EC 2.1.2.1) beteiligt (vgl. Abbildung oben). GDC besteht funktionell aus drei Enzymen, einer decarboxylierenden Glycindehydrogenase (EC 1.4.4.2), einer Aminomethyltransferase (EC 2.1.2.10) und einer Dihydrolipoyldehydrogenase (EC 1.8.1.4). GDC desaminiert und decarboxyliert Glycin unter Verbrauch von NAD+. Das bei diesem Schritt entstehende CO2 gelangt möglicherweise in Form von Bicarbonat aus dem Mitochondrium. In C3-Pflanzen werden 30–50 % des freigesetzten Kohlenstoffdioxids wieder durch RuBisCO refixiert, der Rest entweicht. SHMT verknüpft schließlich die Methylengruppe der ersten Glycins, Wasser und ein weiteres Molekül Glycin zu L-Serin.
Beide Enzymkomplexe, GDC und SHMT, liegen hochkonzentriert in der Matrix von Pflanzenzellenmitochondrien vor und sind oxidationsempfindlich. Das freigesetzte Ammonium (NH4+) geht nicht verloren und wird noch im photorespiratorischen Stickstoffkreislauf regeneriert (vgl. Abschnitt unten).
L-Serin wird nach Transport ins Peroxisom durch die oben beschriebene Serin-Glyoxylat-Transaminase zu Hydroxypyruvat desaminiert. Dieses wird unter Verbrauch von NADH zu D-Glycerat reduziert, was eine NAD+-abhängige Hydroxypyruvat-Reduktase (EC 1.1.1.81) katalysiert. Zurück im Chloroplasten wird D-Glycerat zu 3-Phosphoglycerat durch eine Glyceratkinase (GKK, EC 2.7.1.31) umgesetzt, dabei wird ein Molekül ATP investiert. 3-Phosphoglycerat tritt dann regulär in den Calvin-Zyklus ein. Interessanterweise ist die GKK das einzig bekannte Enzym, das 3-Phosphoglycerat bildet; Bakterien verwenden dagegen eine Kinase, bei der 2-Phosphoglycerat entsteht.
Der Austausch der beteiligten Metabolite erfolgt entweder durch Translokatoren oder durch Porine (in Peroxisomen).[1]
Regeneration von Glutamat (photorespiratorischer Stickstoffkreislauf)
[Bearbeiten | Quelltext bearbeiten]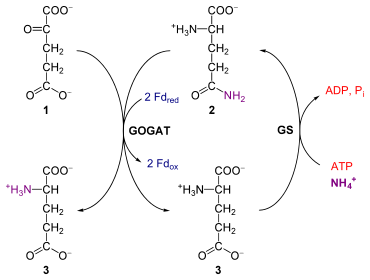
1: α-Ketoglutarat
2: L-Glutamin
3: L-Glutamat
GS: Glutamin-Synthetase
GOGAT: Glutamat-Synthase
Im photorespiratorischen Weg wird Glutamat zu α-Ketoglutarat im Peroxisom umgesetzt. Die Aminogruppe wird aber später im Mitochondrium durch den Glycin-Decarboxylasekomplex in Form von NH4+ (Ammonium) abgespalten. Ammonium selbst wirkt in höheren Konzentrationen cytotoxisch, darf aber nicht einfach ausgeschieden werden. Denn das Pflanzenwachstum wird häufig durch die Verfügbarkeit an Stickstoff limitiert.[18]
Damit Ammonium als wertvolle Stickstoffquelle nicht verloren geht und Glutamat regeneriert wird, folgen weitere Reaktionen im Chloroplasten. Dorthin gelangt NH4+ durch einen Ammoniumtransporter, möglicherweise auch durch einfache Diffusion. L-Glutamat (3, vgl. Abbildung) und NH4+ werden dann unter ATP-Verbrauch durch die Glutamin-Synthetase (GS, EC 6.3.1.2) zu L-Glutamin (2) umgesetzt. Letzteres wird mit α-Ketoglutarat (1) durch eine Ferredoxin-abhängige Glutamin-Oxoglutarat-Aminotransferase (GOGAT, auch Glutamat-Synthase, EC 1.4.7.1) zu zwei Molekülen L-Glutamat umgesetzt. Gleichzeitig werden zwei Moleküle Ferredoxin oxidiert (Fdox). α-Ketoglutarat gelangt im Austausch gegen Malat in den Chloroplasten (DiT1-Translokator), während Glutamat durch einen Malat-Glutamat-Translokator (DiT2) wieder zurück in das Peroxisom transportiert wird. Dort steht es wieder zur Transaminierung von Glyoxylat zur Verfügung.
Nahezu alles freigesetzte Ammonium wird durch diesen Zyklus refixiert, nur etwa 0,1 ‰ gehen verloren.[21] Diese Regenerierung verbraucht insgesamt zwei Moleküle Ferredoxin und ein Molekül ATP:
Metabolismus in Cyanobakterien
[Bearbeiten | Quelltext bearbeiten]Cyanobakterien (Blaugrünbakterien, veraltet „Blaualgen“ genannt) sind die einzig bekannten Bakterien, die eine oxygene Photosynthese betreiben. Sie nutzen den Calvin-Zyklus zur Fixierung von Kohlenstoffdioxid. Lange Zeit wurde aus zwei Gründen angenommen, dass die Photorespiration in Cyanobakterien nicht auftritt. Erstens reichern Cyanobakterien Kohlenstoffdioxid aktiv durch Carboxysomen an,[24] so dass RuBisCO kaum mit Sauerstoff reagiert und die Photorespiration daher ohnehin nicht in nennenswerten Ausmaß auftritt. Zweitens glaubte man, dass wenn sich geringe Mengen an Glycolat bilden sollten, dieses wie in Grünalgen ausgeschieden werde und nicht in irgendeiner Form regeneriert werden müsste.[25]
Nun ist bekannt, dass Cyanobakterien ebenfalls über einen 2-Phosphoglycolat-Stoffwechselweg verfügen.[26] Dieser beginnt analog wie bei Pflanzen mit der Umsetzung von 2-Phosphoglycolat über Glycolat zu Glyoxylat. Für den zweiten Schritt verwenden das filamentöse, stickstofffixierende Cyanobakterium Anabaena sowie der im Meer vorkommende Prochlorococcus marinus bei der Oxidation von Glycolat zu Glyoxylat eine pflanzenähnliche Glycolatoxidase. Dagegen nutzt Synechocystis eine Glycolatdehydrogenase, die NADH verbraucht und bei der kein Wasserstoffperoxid entsteht.
Glyoxylat kann – je nach Art des Cyanobakteriums – unterschiedlich verstoffwechselt werden; es wurden drei sich zum Teil überlappende Stoffwechselwege identifiziert. So wird es in manchen wenigen Cyanobakterien durch eine Glyoxylatoxidase unter Sauerstoffverbrauch zu Oxalat oxidiert. Oxalat wird anschließend durch eine Oxalatdecarboxylase und eine Formatdehydrogenase zu zwei Molekülen Kohlenstoffdioxid umgesetzt, dabei wird auch ein Molekül NADH gebildet (Decarboxylierungsweg). Dieser Weg dient damit nicht der Rückführung von Kohlenstoff, im Gegenteil, er wird hierdurch freigesetzt.
Andere Cyanobakterien bilden Hydroxypyruvat aus Glyoxylat. Dies erfolgt entweder über einen pflanzenähnlichen Mechanismus (pflanzenähnlicher Stoffwechselweg, vgl. Abschnitt oben). Alternativ können manche Cyanobakterien zwei Moleküle Glyoxylat durch eine Glyoxylatcarboligase und eine Tartronsäuresemialdehydreduktase unter NADH-Verbrauch zu Hydroxypyruvat umformen, dabei entsteht auch Kohlenstoffdioxid und als Zwischenprodukt Tartronatsemialdehyd (Glyceratweg).
In Synechocystis und Anabaena wird Hydroxypyruvat – wie auch in Pflanzen – durch eine pflanzenähnliche Glyceratkinase zu 3-Phosphoglycerat unter ATP-Verbrauch phosphoryliert. Andere Cyanobakterien bilden aber zuerst 2-Phosphoglycerat, das anschließend zu 3-Phosphoglycerat isomerisiert wird.
In Synechocystis treten diese drei sich überlappenden Stoffwechselwege sogar gemeinsam auf. Nur wenn alle drei Wege unterbrochen werden, benötigt Synechocystis hohe Kohlenstoffdioxidkonzentrationen zum Überleben – analog wie in Pflanzen, bei denen der photorespiratorische Weg unterbrochen wird.[27][28]
Biologische Vermeidung
[Bearbeiten | Quelltext bearbeiten]Die Photorespiration ist ein kostspieliger Prozess, in dem vermehrt ATP und Reduktionsmittel investiert werden. Ohne Photorespiration würden pro fixiertem mol CO2 3 mol ATP und 2 mol NADPH verstoffwechselt. Für den Fall, dass das Verhältnis von Carboxylierung zu Oxygenierung 1 zu 0,25 beträgt, erhöht sich der Verbrauch pro fixiertem mol CO2 auf 5,375 mol ATP und 3,5 mol NADPH.
Dieser Mehrverbrauch reduziert die Effizienz der Photosynthese. Nur unter ausreichend hohen CO2-Partialdrücken (z. B. 1 % CO2) findet keine Oxygenasereaktion und damit kein Effizienzverlust der Photosynthese statt. Somit stellt die Photorespiration per se eine energetisch ungünstige Mehrinvestition für die C3-Pflanze dar. Man schätzt, dass der Kohlenstoffgewinn im Calvin-Zyklus ohne Photorespiration um etwa 30 % höher sein könnte.[29] Da RuBisCO das häufigste Protein auf der Erde ist, wird die Photorespiration sogar als einer der verschwenderischsten Prozesse auf der Erde eingestuft.
Im Laufe der Evolution haben sich verschiedene Mechanismen entwickelt, um die kostspielige Nebenreaktion von RuBisCO insbesondere in Hinblick auf gesunkene CO2-Konzentrationen zu vermeiden. So verfügen die im Wasser lebenden Grünalgen und Cyanobakterien über kohlenstoffdioxidkonzentrierende Mechanismen wie Pyrenoide bzw. Carboxysomen. Diese haben die Funktion, Kohlenstoffdioxid um das RuBisCO-Molekül herum anzureichern. Dadurch entsteht eine hohe lokale CO2-Konzentration, bei der RuBisCO kaum noch mit Sauerstoff reagiert.
In Landpflanzen entstanden aufgrund geänderter Klimabedingungen der C4− und CAM-Stoffwechsel. Diesen liegt eine ATP-getriebene CO2-Pumpe zu Grunde, mit der sie die CO2-Konzentration im Gewebe aktiv erhöhen und damit RuBisCO mit Kohlenstoffdioxid sättigen. Sie erleiden bei einer Temperaturerhöhung kaum Einbußen der Photosyntheseeffizienz, da die Photorespiration nur in geringen Maßen auftritt. Sie haben infolgedessen eine höhere Nettofixierungsrate als C3-Pflanzen.[30] Zu C4-Pflanzen zählen beispielsweise Zuckerrohr, Sorghum, Mais und viele Unkräuter, welche an heißen Standorten anzutreffen sind.
Bedeutung
[Bearbeiten | Quelltext bearbeiten]Durch den photorespiratorischen Weg verfügen alle Organismen, die eine oxygene Photosynthese betreiben (Pflanzen, Algen, Cyanobakterien), über einen Stoffwechselweg, um den Kohlenstoffverlust infolge der Oxygenasereaktion von RuBisCO so gering wie möglich zu halten.
In dem mehrstufigen Prozess werden aus zwei Molekülen 2-Phosphoglycolat drei C-Atome für den Calvin-Zyklus wieder bereitgestellt und ein Molekül CO2 freigesetzt. Falls dieses CO2-Molekül im Calvin-Zyklus nicht refixiert wird, liegt der Verlust an Kohlenstoffatomen durch die Photorespiration bei 25 %.
Damit liegt die Primärfunktion der Photorespiration in der Rückgewinnung des Kohlenstoffes. In den meisten grünen C3-Pflanzen, auch C4-Pflanzen wie Mais, sowie in Cyanobakterien ist der Stoffwechselweg sogar essentiell, also unverzichtbar.[27][31]
C4-Pflanzen sowie Cyanobakterien reichern Kohlenstoffdioxid zwar aktiv an, so dass die Photorespiration nicht so stark auftritt wie in C3-Pflanzen. Dennoch kann man auch dort den photorespiratorischen Weg beobachten. Dies bedeutet, dass die Photorespiration im Laufe der Evolution trotz kohlenstoffdioxidkonzentrierender Mechanismen nicht verschwunden ist und daher einige weitere Vorteile bieten muss:
- Hohe Konzentrationen an 2-Phosphoglycolat, Glyoxylat oder Glycin wirken metabolisch toxisch.[25] So hemmt 2-Phosphoglycolat die Triosephosphatisomerasen[32] und Glyoxylat die RuBisCO.[33] Landpflanzen können diese Metabolite nicht wie Grünalgen ausscheiden. Durch die Photorespiration bleiben die Konzentrationen aber unterhalb schädlicher Grenzwerte.
- Während der Photorespiration werden Aminosäuren wie Glycin und L-Serin gebildet, in höheren Pflanzen ist sie die Hauptquelle dieser Aminosäuren.[34] Jedoch könnten diese Aminosäuren auch auf anderen Stoffwechselwegen synthetisiert werden, insbesondere wenn die Photorespiration unterdrückt wird.
- In Acker-Schmalwand und im Weichweizen wurde gezeigt, dass bei unterdrückter Photorespiration (2 % atmosphärische Sauerstoffkonzentration) auch die Nitratassimilation inhibiert wurde.[35]
- Ein in der Literatur häufig diskutierter Vorteil liegt in der Bewältigung gewisser Stresssituationen. Bei hohen Lichtintensitäten, geringen bzw. hohen Temperaturen und insbesondere Wassermangel kommt es vermehrt zu photooxidativen Schäden des Photosyntheseapparates.[36] Dies liegt daran, dass die photosynthetischen Reaktionszentren überlastet sind, weil die bereitgestellten Elektronen nicht schnell genug im Calvin-Zyklus (in der „Dunkelreaktion“) verbraucht werden können – der Elektronentransport „stockt“. Durch den Mehrverbrauch an Reduktantien während der Photorespiration, besonders unter niedrigen CO2-Partialdrücken, könnte dieser Stoffwechselweg als eine Art „Schutzventil“ gedeutet werden. So dient der Decarboxylierungsweg weniger Cyanobakterien ausschließlich der Beseitigung überschüssiger Energie, da 2-Phosphoglycerat nicht wiederverwertet wird.[25] Für Landpflanzen muss aber angemerkt werden, dass der Hauptteil dieser überschüssigen Energie (50–70 % aller absorbierten Photonen) im sogenannten Xanthophyllzyklus beseitigt wird.[37]
- Bei einer seit kurzem diskutierten Möglichkeit nimmt man an, dass das während der Photorespiration erzeugte Wasserstoffperoxid (H2O2) für Signalprozesse wichtig ist.[2] H2O2 wird als wichtiges Signalmolekül betrachtet, da es unter anderem andere Redoxsignale beeinflusst. Damit werden beispielsweise Prozesse des Pflanzenwachstums und Stressantworten (Schädlingsbefall) gesteuert. Da H2O2 in photosynthetisch aktiven Zellen durch Photorespiration am schnellsten gebildet wird, könnte das Molekül beispielsweise das pflanzliche Verteidigungssystem aktivieren.
Evolution
[Bearbeiten | Quelltext bearbeiten]| Organismus | |
|---|---|
| Rhodopseudomonas sphaeroides (Bakterien) | 9 |
| Cyanobakterien (Blaualgen) | 50 |
| Euglena (Euglenozoa) | 54 |
| Chlorococcales (Grünalgen) | 62 |
| C3-Angiospermen | 80 |
| C4-Angiospermen | 64–80 |
Vorläufer der heutigen Cyanobakterien waren die ersten Lebewesen mit einer oxygenen Photosynthese. Damit war bei ihnen RuBisCO auch Sauerstoff ausgesetzt. Wahrscheinlich wurde auch dort 2-Phosphoglycolat erzeugt, da die CO2-konzentrierenden Mechanismen, wie z. B. das Carboxysom, in der Evolution erst viel später auftraten (vermutlich vor 360–300 Millionen Jahren, als die Sauerstoffkonzentration in der Atmosphäre anstieg).[25] Pflanzen haben im Laufe der Zeit Enzyme für den Glyceratweg verloren, der heute in vielen Cyanobakterien noch vorkommt. Die Photorespiration ist aber erhalten geblieben. Selbst in Picoplankton, dessen Genom stark verkleinert ist (z. B. Prochlorococcus oder Synechococcus), sind die Gene für die Photorespiration erhalten geblieben. Der C2-Zyklus der heutigen Cyanobakterien war entweder bereits zu Beginn vorhanden, oder entwickelte sich recht früh in den ersten Protocyanobakterien.
Nach der Endosymbiontentheorie gehen die Chloroplasten der heutigen Pflanzen und Algen auf Vorläufer der Cyanobakterien zurück, so dass auch RuBisCO in diese Organismen gelangt ist. RuBisCO aller Organismen (Bakterien, Algen, Pflanzen) ist gemeinsam, dass sie sowohl Kohlenstoffdioxid als auch Sauerstoff als Substrat akzeptieren.[39] Durch eine Spezifitätskonstante kann man angeben, wie sehr RuBisCO CO2 als Substrat gegenüber O2 bevorzugt. Diese Konstante ist das Produkt aus zwei Verhältnissen: den Michaeliskonstanten KM und den maximalen Geschwindigkeitskonstanten vmax (vgl. Tabelle).
Im Laufe der Evolution wurde die Affinität der RuBisCO gegenüber CO2 nur etwas verbessert.[18] Wahrscheinlich wurde das katalytische Zentrum des Enzyms in der Zeit optimiert, als die atmosphärische O2-Konzentration noch sehr gering war und damit keinen selektiven Druck ausüben konnte. Infolgedessen konnte RuBisCO durch den späteren Anstieg der Sauerstoffkonzentration nicht mehr signifikant verbessert werden.[1]
Einfluss auf die Welternährung
[Bearbeiten | Quelltext bearbeiten]In C3-Pflanzen tritt die Photorespiration besonders unter warmen und trockenen Umweltbedingungen auf, was die Ernteerträge in jenen Regionen – besonders in Hinblick auf die Klimaerwärmung und die wachsende Weltbevölkerung – mindert. Daher orientiert sich ein Teil der Forschung auf eine gentechnische Reduzierung der Photorespiration oder auf eine Einführung neuer Stoffwechselwege, wodurch die Ernteerträge gesteigert werden könnten.[40][41] Hierbei konnte durch einen Abbau des 2-Phosphoglycolat direkt im Chloroplasten die Effizienz der Lichtausnutzung in Tabakpflanzen um 17 % gesteigert und Ernteerträge um mehr als 40 % gesteigert werden.[42]
Verschiedene Versuche, um die Spezifität von RuBisCO gegenüber Kohlenstoffdioxid zu erhöhen, führten zu niedrigeren Umsatzraten. Damit verschlechterte sich die Photosyntheserate. Eine weitere Strategie verfolgt das Ziel, andere RuBisCO-Arten, wie das bakterielle Typ II-RuBisCO, in C3-Pflanzen einzubringen. Dies scheiterte aber deshalb, da sich das neueingebrachte RuBisCO nicht zu einem funktionellen Enzym zusammensetzt.
Ein anderer Teil der Forschung versucht daher, nicht die Photorespiration in C3-Pflanzen zu unterdrücken. Stattdessen folgt sie dem Ziel, C3-Pflanzen in C4-Pflanzen umzuwandeln, da dort die Photorespiration kaum auftritt und C4-Pflanzen bei Wasser- und Stickstoffmangel C3-Pflanzen übervorteilen, besonders bei steigenden Temperaturen. Eines dieser Projekte ist der sogenannte C4-Reis, bei dem in handelsüblichen Reis, eine C3-Pflanze, die C4-Photosynthese eingebracht werden soll.[43]
Literatur
[Bearbeiten | Quelltext bearbeiten]- H. Bauwe, M. Hagemann, A. R. Fernie: Photorespiration: players, partners and origin. In: Trends Plant Sci. Band 15, Nr. 6, 2010, S. 330–336. PMID 20403720; doi:10.1016/j.tplants.2010.03.006
- S. Reumann, A. P. Weber: Plant peroxisomes respire in the light: some gaps of the photorespiratory C2 cycle have become filled – others remain. In: Biochim Biophys Acta. Band 1763, Nr. 12, 2006, S. 1496–1510. PMID 17046077; doi:10.1016/j.bbamcr.2006.09.008
- C. H. Foyer et al.: Photorespiratory metabolism: genes, mutants, energetics, and redox signaling. In: Annu Rev Plant Biol. Band 60, 2009, S. 455–484. PMID 19575589; doi:10.1146/annurev.arplant.043008.091948
- H. Bauwe: Recent developments in photorespiration research. In: Biochem Soc Trans. Band 38, Nr. 2, 2010, S. 677–682. PMID 20298242; doi:10.1042/BST0380677
- Hans W. Heldt, Birgit Piechulla: Pflanzenbiochemie. 4. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1961-3.
- Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Plant Biochemistry. Garland Pub, New York 2008, ISBN 978-0-8153-4121-5.
- David L. Nelson, Michael M. Cox, Albert L. Lehninger (Begr.): Lehninger Biochemie. 4., vollst. überarb. u. erw. Auflage. Springer, Berlin 2009, ISBN 978-3-540-68637-8.
- Andreas Bresinsky, Christian Körner, Joachim W. Kadereit, G. Neuhaus, Uwe Sonnewald: Strasburger – Lehrbuch der Botanik. 36. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1455-7.
- Ulrich Lüttge, Manfred Kluge, Gabriela Bauer: Botanik. 5., vollst. überarb. Auflage. Wiley-VCH, Weinheim 2005, ISBN 3-527-31179-3.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Andreas Bresinsky, Christian Körner, Joachim W. Kadereit, G. Neuhaus, Uwe Sonnewald: Strasburger – Lehrbuch der Botanik. 36. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1455-7, S. 304 ff.
- ↑ a b C. H. Foyer et al.: Photorespiratory metabolism: genes, mutants, energetics, and redox signaling. In: Annu Rev Plant Biol. Band 60, 2009, S. 455–484. PMID 19575589; doi:10.1146/annurev.arplant.043008.091948.
- ↑ O. Warburg: Über die Geschwindigkeit der photochemischen Kohlenäurezersetzung in lebenden Zellen. II. In: Biochem. Z. Band 103, 1920, S. 188–217.
- ↑ J. P. Decker: A rapid, postillumination deceleration of respiration in green leaves. In: Plant Physiol. Band 30, Nr. 1, 1955, S. 82–84. PMID 16654735; PMC 540603 (freier Volltext).
- ↑ Warburg, O. und Krippahl, G.: Glykolsäurebildung in Chlorella. In: Zeitschrift für Naturforschung B. 15, 1960, S. 197–199 (PDF, freier Volltext).
- ↑ J. A. Bassham, M. Kirk: The effect of oxygen on the reduction of CO2 to glycolic acid and other products during photosynthesis by Chlorella. In: Biochem Biophys Res Commun. Band 9, Nr. 5, 1962, S. 376–380. PMID 13969890; doi:10.1016/0006-291X(62)90019-0.
- ↑ I. Zelitch: Organic acids and respiration in photosynthetic tissues. In: Ann. Rev. Plant Physiol. Band 15, 1964, S. 121–142; doi:10.1146/annurev.pp.15.060164.001005.
- ↑ C. P. Whittingham, R. G. Hiller, M. Bermingham: The production of glycollate during photosynthesis. In: Photosynthesis mechanisms in green plants. B. Kok und AT. Jagendorf, S. 675–683. Washington: Natl. Acad. Sci.-Natl. Res. Counc. Publ. 1145 1963.
- ↑ M. L. Forrester, G. Krotkov, C. D. Nelson: Effect of oxygen on photosynthesis, photorespiration and respiraion in detached leaves. I. Soybean. In: Plant Physiol. Band 41, Nr. 3, 1966, S. 422–427. PMID 16656271; PMC 1086359 (freier Volltext).
- ↑ N. E. Tolbert: Microbodies Peroxisomes and glyoxysomes. In: Ann. Rev. Plant Physiol. Band 22, 1971, S. 45–74; doi:10.1146/annurev.pp.22.060171.000401.
- ↑ W. L. Ogren, G. Bowes: Ribulose diphosphate carboxylase regulates soybean photorespiration. In: Nature New Biol. Band 230, Nr. 13, 1971, S. 159–160. PMID 5279476; doi:10.1038/newbio230159a0
- ↑ G. Bowes, W. L. Ogren, R. H. Hageman: Phosphoglycolate production catalyzed by ribulose diphosphate carboxylase. In: Biochem. Biophys. Res. Commun. Band 45, 1971, S. 716–722; PMID 4331471; doi:10.1016/0006-291X(71)90475-X.
- ↑ A. R. Portis, Jr., M. A. Parry: Discoveries in Rubisco (Ribulose 1,5-bisphosphate carboxylase/oxygenase): a historical perspective. In: Photosynth Res. Band 94, Nr. 1, 2007, S. 121–143. PMID 17665149; doi:10.1007/s11120-007-9225-6.
- ↑ T. J. Andrews, G. H. Lorimer, N. E. Tolbert: Ribulose diphosphate oxygenase. I. Synthesis of phosphoglycolate by fraction-1 protein of leaves. In: Biochemistry Band 12, Nr. 1, 1973, S. 11–18. PMID 4683476; doi:10.1021/bi00725a003.
- ↑ G. H. Lorimer, T. J. Andrews, N. E. Tolbert: Ribulose diphosphate oxygenase. II. Further proof of reaction products and mechanism of action. In: Biochemistry. Band 12, Nr. 1, 1973, S. 18–23. PMID 4683482; doi:10.1021/bi00725a004.
- ↑ a b Peter Schopfer, Axel Brennicke: Pflanzenphysiologie. Elsevier, München 2006, ISBN 3-8274-1561-6, S. 227–231.
- ↑ David Nelson, Michael Cox: Lehninger Biochemie. 4., vollst. überarb. u. erw. Auflage. Springer, Berlin 2009, ISBN 978-3-540-68637-8, S. 787.
- ↑ a b c S. Reumann, A. P. Weber: Plant peroxisomes respire in the light: some gaps of the photorespiratory C2 cycle have become filled – others remain. In: Biochim Biophys Acta. Band 1763, Nr. 12, 2006, S. 1496–1510. PMID 17046077; doi:10.1016/j.bbamcr.2006.09.008
- ↑ Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Plant Biochemistry. Garland Pub, New York 2008, ISBN 978-0-8153-4121-5, S. 118.
- ↑ Peter H. Raven, Ray F. Evert, Susan E. Eichhorn: Biologie der Pflanzen. 4. Auflage. de Gruyter, Berlin / New York 2006, ISBN 3-11-018531-8, S. 149ff.
- ↑ a b c Hermann Bauwe: Photorespiration: The Bridge to C4 Photosynthesis. In: Agepati S. Raghavendra, Rowan F. Sage (Hrsg.): C4 Photosynthesis and Related CO2 Concentrated Mechanisms (Advances in Photosynthesis and Respiration). Springer Netherlands, 2011, ISBN 978-90-481-9406-3, S. 81–108.
- ↑ Florian A. Busch: Photorespiration in the context of Rubisco biochemistry, CO2 diffusion and metabolism. In: The Plant Journal. Band 101, Nr. 4, 2020, ISSN 1365-313X, S. 919–939, doi:10.1111/tpj.14674 (wiley.com [abgerufen am 12. März 2021]).
- ↑ David Nelson, Michael Cox: Lehninger Biochemie. Springer, Berlin; 4., vollst. überarb. u. erw. Auflage 2009, ISBN 978-3-540-68637-8, S. 1042.
- ↑ Dieter Sültemeyer, Thomas Stuhlfauth, Heinrich P. Fock: Is pseudocyclic ATP formation involved in providing energy for the HCO3−-concentrating mechanism in blue green algae? In: Annual Meeting of the American Society of Pant Physiologists. St. Louis, Plant Physiology, April 1987, 83 (4 Suppl.), S. 161, abstract 967, PMC 1056509 (freier Volltext).
- ↑ a b c d H. Bauwe, M. Hagemann, A. R. Fernie: Photorespiration: players, partners and origin. In: Trends Plant Sci. Band 15, Nr. 6, 2010, S. 330–336. PMID 20403720; doi:10.1016/j.tplants.2010.03.006.
- ↑ H. Bauwe: Recent developments in photorespiration research. In: Biochem Soc Trans. Band 38, Nr. 2, 2010, S. 677–682. PMID 20298242; doi:10.1042/BST0380677.
- ↑ a b M. Eisenhut et al.: The photorespiratory glycolate metabolism is essential for cyanobacteria and might have been conveyed endosymbiontically to plants. In: Proc Natl Acad Sci USA. Band 105, Nr. 44, November 2008, S. 17199–17204, doi:10.1073/pnas.0807043105. PMID 18957552, PMC 2579401 (freier Volltext).
- ↑ V. G. Maurino, C. Peterhänsel: Photorespiration: current status and approaches for metabolic engineering. In: Curr Opin Plant Biol. Band 13, Nr. 3, 2010, S. 249–256. PMID 20185358; doi:10.1016/j.pbi.2010.01.006.
- ↑ Ulrich Lüttge, Manfred Kluge, Gabriela Bauer: Botanik. 5., vollst. überarb. Auflage. Wiley-VCH, Weinheim 2005, ISBN 3-527-31179-3, S. 157.
- ↑ Elmar Weiler, Lutz Nover, Wilhelm Nultsch: Allgemeine und molekulare Botanik. Thieme Verlag, Stuttgart 2008, ISBN 978-3-13-147661-6, S. 286.
- ↑ I. Zelitch et al.: High glycolate oxidase activity is required for survival of maize in normal air. In: Plant physiology. Band 149, Nr. 1, Januar 2009, S. 195–204, doi:10.1104/pp.108.128439. PMID 18805949, PMC 2613714 (freier Volltext).
- ↑ L. E. Anderson: Chloroplast and cytoplasmic enzymes. II. Pea leaf triose phosphate isomerases. In: Biochim Biophys Acta. Band 235, Nr. 1, 1971, S. 237–244. PMID 5089710; doi:10.1016/0005-2744(71)90051-9
- ↑ L. A. Kleczkowski: Inhibitors of Photosynthetic Enzymes/Carriers and Metabolism. In: Annual Review of Plant Physiology and Plant Molecular Biology. Band 45, 1994, S. 339–367; doi:10.1146/annurev.pp.45.060194.002011.
- ↑ Ulrich Lüttge, Manfred Kluge, Gabriela Bauer: Botanik. 5., vollst. überarb. Auflage. Wiley-VCH, Weinheim 2005, ISBN 3-527-31179-3, S. 158.
- ↑ C. Peterhänsel et al.: Photorespiration. In: Arabidopsis Book. Band 8, 2010, S. e0130. PMID 22303256; doi:10.1199/tab.0130.
- ↑ Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Plant Biochemistry. Garland Pub, New York, NY 2008, ISBN 978-0-8153-4121-5, S. 86ff.
- ↑ Hans W. Heldt, Birgit Piechulla: Pflanzenbiochemie. 4. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1961-3, S. 110.
- ↑ Ulrich Lüttge, Manfred Kluge, Gabriela Bauer: Botanik. 5., vollst. überarb. Auflage. Wiley-VCH, Weinheim 2005, ISBN 3-527-31179-3, S. 139.
- ↑ I. Andersson: Catalysis and regulation in Rubisco. In: Journal of experimental botany. Band 59, Nr. 7, 2008, S. 1555–1568, doi:10.1093/jxb/ern091. PMID 18417482 (Review). PDF (freier Volltextzugriff, engl.)
- ↑ C. Peterhänsel, M. Niessen, R. M. Kebeish: Metabolic engineering towards the enhancement of photosynthesis. In: Photochem Photobiol. Band 84, Nr. 6, 2008, S. 1317–1323. PMID 18764897; doi:10.1111/j.1751-1097.2008.00427.x.
- ↑ C. Peterhänsel, V. G. Maurino: Photorespiration redesigned. In: Plant physiology. Band 155, Nummer 1, Januar 2011, S. 49–55, doi:10.1104/pp.110.165019. PMID 20940347, PMC 3075789 (freier Volltext) (Review).
- ↑ Donald R. Ort, Helen W. Liu, Amanda P. Cavanagh, Paul F. South: Synthetic glycolate metabolism pathways stimulate crop growth and productivity in the field. In: Science. Band 363, Nr. 6422, 4. Januar 2019, ISSN 1095-9203, S. eaat9077, doi:10.1126/science.aat9077, PMID 30606819 (sciencemag.org [abgerufen am 6. Januar 2019]).
- ↑ Homepage des Projektes C4-Reis.


