Phyllochinon
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| Allgemeines | |||||||||
| Trivialname | Vitamin K1 | ||||||||
| Andere Namen |
| ||||||||
| Summenformel | C31H46O2 | ||||||||
| CAS-Nummer | 84-80-0 | ||||||||
| ATC-Code | |||||||||
| Kurzbeschreibung | gelbe bis grüne, klare, viskose Flüssigkeit[1] | ||||||||
| Vorkommen | Kohl, Spinat, Rosenkohl, Kohlsprossen | ||||||||
| Physiologie | |||||||||
| Funktion | Blutgerinnung, Knochenstoffwechsel, Photosynthese, Vitamin-K-Zyklus | ||||||||
| Täglicher Bedarf | etwa 80 µg | ||||||||
| Folgen bei Mangel | Verlangsamung der Blutgerinnung, bei Säuglingen Hirnblutungen, Verdauungsstörungen | ||||||||
| Überdosis | nicht bekannt | ||||||||
| Eigenschaften | |||||||||
| Molare Masse | 450,71 g·mol−1 | ||||||||
| Aggregatzustand | flüssig[1] | ||||||||
| Dichte | 0,984 g·cm−3 (20 °C)[1] | ||||||||
| Schmelzpunkt |
−20 °C[1] | ||||||||
| Löslichkeit | fettlöslich, auch in Ethanol, Benzol, Chloroform, Ether löslich | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Phyllochinon oder Vitamin K1 gehört zu den fettlöslichen K-Vitaminen. Im menschlichen Organismus spielt es unter anderem bei der Blutgerinnung eine wichtige Rolle. Zusammen mit Vitamin K2 zählt es als Vitamer zu den K-Vitaminen.
Es kommt vor allem in den Chloroplasten von Grünpflanzen vor, aber auch in Grünalgen und manchen Cyanobakterien.[2] Als normaler Bestandteil des Photosyntheseapparates und zum Teil in den Früchten tritt es in unterschiedlichen Konzentrationen auf. Bei der Photosynthese der Pflanzen ist es in der Elektronenübertragungskette im Photosystem I beteiligt.[3]
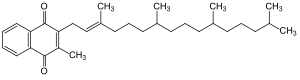
Das Molekül besteht aus einem Methylnaphthochinon (Menadion) mit einer Phytylseitenkette. Bei Raumtemperatur stellt es eine viskose Flüssigkeit dar.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Die Entdeckung des Vitamin K geht auf die Arbeiten des dänischen Forschers Henrik Dam zurück. Im Jahre 1943 erhielten er und Edward Adelbert Doisy – für die Aufdeckung der chemischen Natur des Vitamins K – den gemeinsamen Nobelpreis für Medizin. Die künstliche Synthese von Vitamin K1 gelang erstmals Louis Frederick Fieser im Jahr 1939.
Namen
[Bearbeiten | Quelltext bearbeiten]Vitamin K1 ist die triviale Bezeichnung für 2-Methyl-3-phytyl-1,4-naphthochinon (auch α-Phyllochinon). Seinen Ursprung hat der Name Phyllochinon von dem Wort Phyllos, das Blatt. Der Buchstabe K wurde eingesetzt, nach dem Henrik Dam um 1935 aus getrockneten Luzerne-Blättern eine fettlösliche Substanz isolierte, die eine ausgleichende Wirkung auf die Blutgerinnung zeigte (Koagulations-Vitamin) und man es der Einfachheit halber dann Vitamin K nannte. Es ist ein Terpenoid.
Aufgabe/Funktion
[Bearbeiten | Quelltext bearbeiten]Die biologische Aktivität von Vitamin K ist auf seine Fähigkeit zurückzuführen, zwischen seinen oxidierten (Chinon) und reduzierten (Hydrochinon) Formen im Vitamin-K-Zyklus zu wechseln. Die wesentliche Bedeutung von Vitamin K liegt in seinem Beitrag zur posttranslationalen Einführung einer Carboxygruppe in die γ-Position von Glutamylresten spezifischer Proteine, wodurch sich deren Eigenschaften ändern. Seine wichtigste Funktion ist die Beteiligung an der Synthese verschiedener Blutgerinnungsfaktoren.
Photosynthese
[Bearbeiten | Quelltext bearbeiten]Phyllochinon ist im Photosynthese-Reaktionszentrum Photosystem I enthalten, wo es in der Elektronenübertragungskette als sekundärer Elektronenakzeptor beteiligt ist.[3] Es ist fest gebunden und entspricht funktionell QA im Photosystem II.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Vitamin K1 findet sich in den Lamellarmembranen der Chloroplasten in grünen Pflanzen. Der aromatische Ring der K-Vitamine wird im Shikimisäureweg gebildet. Im Körper ist das Vitamin K im Blutplasma vorhanden und in der Leber, Niere und Milz gespeichert.
Phyllochinon kommt insbesondere in grünen, blattförmigen Pflanzen vor, z. B. in grünem Gemüse (Rosenkohl, Grünkohl, Spinat, Brokkoli) oder Salaten.[4] Auch Öle tragen zur Vitamin K1-Versorgung bei.[5] Dagegen haben Fleisch und Fisch mittlere Gehalte, Früchte sind eher Vitamin K1-arm. Der angegebene Gehalt schwankt in verschiedenen Tabellenwerken zum Teil erheblich. Neben Problemen in der Analytik hängt der gemessene Gehalt auch von der Jahreszeit ab.[4]
| Nahrungsmittel | Tabellenwerk
Schek[5] |
Tabellenwerk
Souci/Fachmann/Kraut[6] |
|---|---|---|
| Nattō | 34,7 | kA |
| Hartkäse | 10,4 | 2,6[7] |
| Weichkäse | 2,6 | kA |
| Sauerkraut | 25,1 | 7,7 |
| Schweinesteak | 0,3 | kA |
| Eigelb | 2,1 | (8,9)[8] |
| Butter | 14,9 | 7,0 |
| Salami | 2,3 | kA |
| Schlagsahne | 5,1 | kA |
| Eiklar | 0 | kA |
| Milch | 0 | 0,5 |
| Schwarzer Tee | 0,3 | 262 |
| Makrele | 2,2 | 7,1 |
| Grünkohl | 817 | 817 |
| Spinat | 387 | 305 |
| Brokkoli | 156 | 155 |
| Margarine | 93,2 | kA |
| Sojaöl | 193 | 138 |
| Rapsöl | 127 | 150 |
| Olivenöl | 53,7 | 33 |
| Schokolade | 6,6 | kA |
| Apfel | 3,0 | 3,7 |
| Banane | 0,3 | 0,3 |
Bedarf
[Bearbeiten | Quelltext bearbeiten]Die EFSA gibt als empfohlene Tagesdosis (Adequate Intake) für alle Alters- und Geschlechtsgruppen eine Aufnahmemenge von 1 µg/kg Körpergewicht Phyllochinon an.[9] Sie differenziert hierbei aber nicht weiter zwischen der Aufnahme von Vitamin K1 und K2. Anhand Referenzkörpergewichte empfiehlt die EFSA Säuglingen zwischen 7 und 11 Monaten täglich etwa 10 µg Vitamin K, bei Personen über 18 Jahren etwa 70 µg.[10] Anfang des Jahres 2017 wurde diese bereits im Jahre 1993[5] formulierte Zufuhrempfehlung erneut bestätigt. Das Bundesinstitut für Risikobewertung (BfR) gibt ähnliche Werte für die D-A-CH-Region an, unterscheidet aber bei Jugendlichen und Erwachsenen nach Geschlecht. So werden von 15 bis 51 Jahren 70 µg (Männer) bzw. 60 µg (Frauen) empfohlen. Im Alter erhöht sich der Bedarf: Bei ab 65-Jährigen liegt die Tagesempfehlung bei 80 µg (Männer) bzw. 65 µg (Frauen). Schwangere und Stillende sollen 60 µg täglich einnehmen.
Bei Neugeborenen wird zur Vermeidung von lebensbedrohlichen Blutungen durch einen möglichen Vitamin-K-Mangel so bald wie möglich die Gabe von Vitamin K1 nach der Geburt, also noch im Kreißsaal, dringend empfohlen.[11]
Das Bundesinstitut für Risikobewertung gibt eine Tagesverzehrempfehlung von Vitamin K1 in Nahrungsergänzungsmitteln von maximal 80 µg an.[9] Zudem sollen Personen, die gerinnungshemmende Medikamente (vom Cumarintyp) einnehmen, vor dem Verzehr von Vitamin K-haltigen Nahrungsergänzungsmitteln ärztlichen Rat einholen.
Mangelerscheinungen und Überdosierungen
[Bearbeiten | Quelltext bearbeiten]Insgesamt sind bei normaler Ernährung ernstere Hypovitaminosen und Avitaminosen selten (wenn man den Bedarf nicht nach den Erfordernissen einer Osteoporoseprophylaxe etc. bemisst, die wesentlich höhere Dosen erfordert).[12][5]
Eine tolerierbare obere Einnahmemenge (Tolerable Upper Intake Level) wurde aufgrund unzureichender Daten nicht abgeleitet.[9]
Bei Überdosierung können selten allergische Überempfindlichkeitsreaktionen auftreten.[12]
Antagonisten
[Bearbeiten | Quelltext bearbeiten]

Vitamin K ist zur Synthese von Gerinnungsfaktoren (Prothrombin) unerlässlich. Die Gegenwart von Vitamin-K-Antagonisten (z. B. Warfarin, Dicumarol) klärte die Wirkungsweise dieses Vitamins erstmals auf. So führte das in verdorbenem Klee vorhandene Dicumarol zu lebensgefährlichen Blutungen bei Rindern. Warfarin findet auch als Rattengift Verwendung. Mit Dicumarol gefütterte Kühe besitzen ein abnormes Prothrombin, das anders als das normale Prothrombin kein Ca2+ mehr bindet. Dies kommt durch die Änderung einer Aminosäure im Prothrombin zustande.
Als Medikament zur Blutgerinnungshemmung wird häufig Phenprocoumon als Antagonist verwendet.
Biosynthese
[Bearbeiten | Quelltext bearbeiten]
Nur Landpflanzen, Grünalgen und manche Cyanobakterien können die Biosynthese von Phyllochinon durchführen.[2]
- In Pflanzen entsteht das aromatische Grundgerüst im Zuge des Shikimisäureweges aus Chorismat, die Reaktionen finden in den Plastiden und Peroxisomen statt und münden in der Bildung von 1,4-Dihydroxy-2-naphthoat. Insgesamt ähnelt die Biosynthese Phyllochinons der von Menachinon (Vitamin K2) in E. coli.
- Die Phytylseitenkette kann aus zwei metabolischen Zweigen erzeugt werden. Entweder werden Dimethylallylpyrophosphat und drei Molekülen Isopentenylpyrophosphat über Zwischenschritte zu Geranylgeranylpyrophosphat umgesetzt, nach Reduktion mittels NADPH entsteht Phytylpyrophosphat. Dieses wird an den Aromaten kondensiert, so dass eine Vorstufe zum Phyllochinon entsteht. Weitere Reduktionen und die Anlagerung von Methyl aus SAM bilden daraus Phyllochinon. Alternativ kann Phytylpyrophosphat auch aus dem Abbau von Chlorophyllen gewonnen werden.
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]KA-Vit (D), Konakion (D, A, CH)
FrekaVit (D), Vitalipid (D, A, CH)
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Vitamin K in Lebensmitteln (PDF), Deutsche Herzstiftung, Mai 2020[14]
- Vitamin K-Produkte – was ist sinnvoll?, Verbraucherzentrale, 11. Oktober 2021
- Uwe Gröber und Klaus Kisters: Ein altes Vitamin in neuem Licht, Deutsche Apotheker Zeitung, 22. Mai 2014
Literatur
[Bearbeiten | Quelltext bearbeiten]- O. Isler: Über die Vitamine K1 und K2. In: Angewandte Chemie. Band 71, Nr. 1, 1959, S. 7–15, doi:10.1002/ange.19590710103.
- Dietary reference values for vitamin K (PDF, englisch), EFSA, 22. Mai 2017, doi:10.2903/j.efsa.2017.4780.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt Phylloquinone (K1), analytical standard bei Sigma-Aldrich, abgerufen am 25. Juni 2017 (PDF).
- ↑ a b Gilles J. Basset et al.: Phylloquinone (Vitamin K1): Occurrence, Biosynthesis and Functions. In: Mini Reviews in Medicinal Chemistry. Band 17, Nr. 12, 2017, S. 1028–1038, doi:10.2174/1389557516666160623082714, PMID 27337968.
- ↑ a b Hans-Walter Heldt, Birgit Piechulla: Pflanzenbiochemie. 5. Auflage. Springer-Verlag, 2014, ISBN 978-3-662-44398-9, S. 96, doi:10.1007/978-3-662-44398-9.
- ↑ a b Klaus Pietrzik, Ines Golly, Dieter Loew: Handbuch Vitamine: Für Prophylaxe, Therapie und Beratung. 1. Auflage. Urban&Fischer, Elsevier, München 2008, ISBN 978-3-437-55361-5, S. 365.
- ↑ a b c d Alexandra Schek: Vitamin K – ein Update, Teil 1. In: Ernährungs-Umschau. 14. November 2017, abgerufen am 31. März 2022.
- ↑ Souci/Fachmann/Kraut: Die Zusammensetzung der Lebensmittel, Nährwert-Tabellen. Hrsg.: Deutsche Forschungsanstalt für Lebensmittelchemie im Auftrag des Bundesministeriums für Ernährung und Landwirtschaft. 8. Auflage. MedPharm Scientific Publishers, Stuttgart 2016, ISBN 978-3-8047-5072-2.
- ↑ Emmentalerkäse
- ↑ Gesamt-Ei
- ↑ a b c Höchstmengenvorschläge für Vitamin K in Lebensmitteln inklusive Nahrungsergänzungsmitteln. (PDF) BfR, abgerufen am 30. März 2022.
- ↑ Dominique Turck et al.: Dietary reference values for vitamin K. In: EFSA Journal. Band 15, Nr. 5, Mai 2017, doi:10.2903/j.efsa.2017.4780, PMID 32625486, PMC 7010012 (freier Volltext).
- ↑ Prophylaxe von Vitamin-K-Mangel-Blutungen (VKMB) bei Neugeborenen. (PDF) In: AWMF. März 2016, S. 10, abgerufen am 31. März 2022.
- ↑ a b Vitamin K-Produkte – was ist sinnvoll? In: Verbraucherzentrale. 11. Oktober 2021, abgerufen am 31. März 2022.
- ↑ Sigrun Reumann: Biosynthesis of Vitamin K1 (Phylloquinone) by Plant Peroxisomes and Its Integration into Signaling Molecule Synthesis Pathways. In: Luis A. del Río (Hrsg.): Peroxisomes and their Key Role in Cellular Signaling and Metabolism. Springer, Dordrecht 2013, doi:10.1007/978-94-007-6889-5_12.
- ↑ gemäß dort verwendeter Quelle (Souci/Fachmann/Kraut: Die Zusammensetzung der Lebensmittel – Nährwert-Tabellen, 8., revidierte und ergänzte Auflage 2016, ISBN 978-3-8047-5072-2, hrsg. von der Deutschen Forschungsanstalt für Lebensmittelchemie im Auftrag des Bundesministeriums für Ernährung und Landwirtschaft) S. XVII handelt es sich um Vitamin K1