Plasmodium malariae
| Plasmodium malariae | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
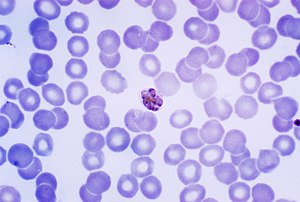
Reifer Schizont von Plasmodium malariae im gefärbten Blutausstrich | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Plasmodium malariae | ||||||||||||
| (Grassi & Feletti, 1890) |
Plasmodium malariae ist ein einzelliger Parasit aus der Gattung der Plasmodien und der Krankheitserreger der Malaria quartana beim Menschen, einer vergleichsweise gutartigen Form der Erkrankung, die selten lebensgefährlich verläuft. Wie andere Malariaerreger auch wird Plasmodium malariae von Anopheles-Mücken übertragen. Der Parasit kommt heute vorwiegend in tropischen Ländern vor.
Entdeckung und Beschreibung
[Bearbeiten | Quelltext bearbeiten]Geschichte
[Bearbeiten | Quelltext bearbeiten]Malaria-Erreger wurden erstmals 1880 von Alphonse Laveran beschrieben. Angelo Celli untersuchte zusammen mit Ettore Marchiafava den Parasiten und nannte ihn 1885 Plasmodium malariae.[1] Laveran ging allerdings von nur einer Art des Erregers aus, die er Oscillaria malariae nannte; es wird angenommen, dass Laveran in Algier sowohl Erreger der Malaria tropica, der Malaria tertiana als auch der Malaria quartana beobachtet hat. Diese unterschiedlichen Krankheitsverläufe und ihre Erreger konnte erst 1886 Camillo Golgi differenzieren. 1890 schlugen Grassi und Feletti nach Sichtung der Literatur für den Erreger der Quartana-Malaria den Namen Haemamoeba malariae vor; eine Reihe weiterer Namensvorschläge von anderen Autoren folgten. 1885 hatten bereits Marchiafava und Celli den Gattungsnamen Plasmodium vorgeschlagen. 1954 wurde die gängige Kombination Plasmodium malariae durch die Internationale Kommission für Zoologische Nomenklatur für gültig erklärt.
Morphologie
[Bearbeiten | Quelltext bearbeiten]Wie bei allen Plasmodien kommt auch P. malariae in verschiedenen Entwicklungsstadien vor. Sporozoiten aus der Mücke sind mit 12 Mikrometern Durchmesser vergleichsweise groß. Leberschizonten erreichen einen Durchmesser von zirka 50 Mikrometern und enthalten viele Tausend Merozoiten. Bei der Vermehrung des Parasiten in Erythrozyten sind diese normalerweise nicht vergrößert. Reife Blutschizonten enthalten 6 bis 14, typischerweise 8 Merozoiten. Unreife Gametozyten sind mikroskopisch nicht von den ungeschlechtlichen Formen zu unterscheiden. Die reifen Gametozyten füllen die Wirtszelle vollständig aus. Makrogametozyten zeigen nach Färbung ein tiefblaues Zytoplasma mit einem kleinen, am Rand gelegenen Kern und verteiltes Pigment, während die Mikrogametozyten ein leichtblaues Zytoplasma mit einem diffusen Kern zeigen.
Die Differenzierung verschiedener Malariaerreger lediglich über die Morphologie im Blutausstrich kann schwierig bis unmöglich sein. In Südostasien wurden Infektionen mit Plasmodium knowlesi fälschlich als solche mit P. malariae identifiziert. Um solche Fehler zu vermeiden, werden vermehrt molekulare DNA-Techniken zur Differenzierung eingesetzt.
Systematik
[Bearbeiten | Quelltext bearbeiten]Traditionell wird Plasmodium malariae mit vielen anderen Primaten infizierenden Plasmodien in der Untergattung Plasmodium eingeordnet. Sehr nah verwandt oder identisch mit P. malariae ist P. brasilianum, ein bei verschiedenen Neuweltaffen in Mittel- und Südamerika beschriebener Parasit, der mikroskopisch und molekular nicht von P. malariae zu unterscheiden ist. Es wird angenommen, dass P. malariae in den letzten 500 Jahren durch infizierte Menschen nach Südamerika gelangte und von diesen durch Moskitos auch auf Affen übertragen wurde. In Westafrika wurde in Schimpansen und Gorillas mit P. rodhaini ein weiterer Parasit beschrieben, der nicht von P. malariae zu unterscheiden ist. Allgemein wird P. rodhaini als Synonym von P. malariae angesehen. Außer diesen beiden Plasmodien zeigen keine anderen Arten besonders nahe Verwandtschaft zu P. malariae. Der evolutionäre Ursprung von P. malariae ist ungeklärt.
Verbreitung und Wirtstiere
[Bearbeiten | Quelltext bearbeiten]Plasmodium malariae kommt in tropischen und subtropischen Gebieten vor und ist in Afrika südlich der Sahara weit verbreitet, aber auch in Südostasien und auf Inseln im westlichen Pazifik sowie im Amazonasbecken anzutreffen. Ursprünglich kam P. malariae auch in Europa und im Süden der Vereinigten Staaten vor.
Ob infizierte Affen ein epidemiologisch relevantes Reservoir für Infektionen von Menschen darstellen wird seit Langem diskutiert. Jüngste Untersuchungen zeigen, dass Malaria-quartana-Parasiten zwischen Affe und Mensch leicht hin und her wechseln und keine Spezifität für Säugerwirte zeigen. Quartane Malaria kann als echte Anthropozoonose betrachtet werden.[2][3]
Eine ganze Reihe von Anopheles-Arten kommen als Vektor für P. malariae in Frage, darunter auch in Europa vorkommende Arten wie Anopheles atroparvus oder Anopheles messeae.
Lebenszyklus
[Bearbeiten | Quelltext bearbeiten]Der Lebenszyklus von P. malariae gleicht im Wesentlichen dem anderer Plasmodien. Der Parasit zeigt einen obligaten Wirtswechsel. Die Sporozoiten gelangen durch infizierte Stechmücken in die Blutbahn des Menschen, wandern von dort in die Leber und dringen in Hepatozyten ein, in denen sie sich ungeschlechtlich vermehren. Im Vergleich zu anderen Malariaerregern ist die Inkubationszeit dieser Leberphase mit mindestens 15 Tagen vergleichsweise lang. Die Leberschizonten produzieren jeweils tausende von Merozoiten, die freigesetzt werden und Erythrozyten befallen, wo eine weitere ungeschlechtliche Vermehrung stattfindet. Die Generationszeit bei der Vermehrung in den Erythrozyten beträgt zirka 72 Stunden. Da die Entwicklung synchron verläuft, kommt es am Ende jedes Vermehrungszyklus zu einer massenhaften Freisetzung neuer Parasiten, die mit einem Fieberschub verbunden ist. Aus der Periodizität der Fieberschübe leitet sich die Bezeichnung Malaria quartana ab. Einige wenige Plasmodien entwickeln sich in den Erythrozyten zu Geschlechtsformen. Diese Mikrogametozyten und Makrogametozyten können von Mücken bei einer Blutmahlzeit aufgenommen werden und im Darm des Insekts einen neuen Entwicklungszyklus in Gang setzen. Nach einer Verschmelzung der Gameten werden im Darm neue Sporozoiten gebildet, die in die Speicheldrüse wandern, von wo sie auf einen neuen Wirt übertragen werden können. Die Entwicklungszeit in der Mücke beträgt 15 bis 21 Tage.
Eine Besonderheit im Lebenszyklus von P. malariae ist das Auftreten von Rekrudeszenzen, das sind Rückfälle, die aus persistierenden erythrozytären Formen hervorgehen. In Einzelfällen treten diese auch nach Jahrzehnten auf, wenn die Parasiten nicht durch eine geeignete Therapie eliminiert wurden. Rezidive, die aus Hypnozoiten in der Leber entstehen, gibt es bei P. malariae dagegen nicht.
Literatur
[Bearbeiten | Quelltext bearbeiten]- G. Robert Coatney, William E. Collins, McWilson Warren, Peter G. Contacos: The primate malarias. Bethesda: U.S. National Institute of Allergy and Infectious Diseases, 1971. Kapitel 18, S. 209 ff.: Plasmodium malariae
- William E. Collins, Geoffrey M. Jeffery: Plasmodium malariae: Parasite and Disease. In: Clin. Microbiol. Rev. Bd. 20, Nr. 4, 2007, S. 579–592, PMID 17934075.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Manfred Vasold: Celli, Angelo. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 234.
- ↑ Albert Lalremruata, Magda Magris, Sarai Vivas-Martínez, Maike Koehler, Meral Esen: Natural infection of Plasmodium brasilianum in humans: Man and monkey share quartan malaria parasites in the Venezuelan Amazon. In: EBioMedicine. Band 2, Nr. 9, September 2015, S. 1186–1192, doi:10.1016/j.ebiom.2015.07.033.
- ↑ Wolfram Metzger, Sarai Vivas-Martínez: Plasmodium brasilianum ist Plasmodium malariae: Malaria-quartana-Parasiten im venezolanischen Amazonas. In: Flugmedizin · Tropenmedizin · Reisemedizin – FTR. Band 24, Nr. 06, Dezember 2017, ISSN 1864-4538, S. 285–291, doi:10.1055/s-0043-122728.