Plasmodium vivax
| Plasmodium vivax | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

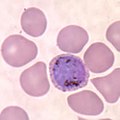
Trophozoiten von Plasmodium vivax im gefärbten Blutausstrich | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Plasmodium vivax | ||||||||||||
| (Grassi & Feletti, 1890) |
Plasmodium vivax ist ein einzelliger Parasit aus der Gattung Plasmodium und ein Krankheitserreger der Malaria tertiana. Infektionen durch Plasmodium vivax sind häufig, und obwohl die Erkrankung als meist relativ gutartig verlaufend angesehen wird, trägt der Erreger mit geschätzten 132 bis 391 Millionen Infektionen pro Jahr in den betroffenen Ländern erheblich zur Morbidität bei.[1] Historisch hat P. vivax unter anderem auch in Europa, vermutlich im Zusammenspiel mit anderen Faktoren, signifikant zur Sterblichkeit beigetragen, und auch heute wird die Schwere der Erkrankung leicht unterschätzt.[2] Wie andere Malariaerreger wird Plasmodium vivax von weiblichen Anopheles-Mücken übertragen. Das Hauptverbreitungsgebiet ist heute in Asien und im Westpazifik, aber auch in Mittel- und Südamerika ist die vivax-Malaria bedeutend, während der Parasit in Afrika relativ selten ist.
Entdeckung und Beschreibung
[Bearbeiten | Quelltext bearbeiten]Geschichte
[Bearbeiten | Quelltext bearbeiten]Malaria-Erreger wurden erstmals 1880 von Alphonse Laveran beschrieben. Laveran ging allerdings von nur einer Art des Erregers aus, die er Oscillaria malariae nannte; es wird angenommen, dass Laveran in Algerien sowohl Erreger der Malaria tropica, der Malaria tertiana als auch der Malaria quartana beobachtet hat. Diese unterschiedlichen Krankheitsverläufe und ihre Erreger konnte erst wenige Jahre später Camillo Golgi differenzieren. 1890 schlugen Grassi und Feletti nach Sichtung der Literatur für den Erreger der Tertiana-Malaria den Namen Haemamoeba vivax vor. Die Bezeichnung vivax bezieht sich auf die lebhafte amöboide Form junger Trophozoiten im Erythrozyten, eine Eigenschaft, die die anderen klassischen Malariaerreger nicht zeigen. 1885 hatten bereits Marchiafava und Celli den Gattungsnamen Plasmodium vorgeschlagen. 1954 wurde die gängige Kombination Plasmodium vivax durch die Internationale Kommission für Zoologische Nomenklatur für gültig erklärt.
Morphologie
[Bearbeiten | Quelltext bearbeiten]Wie bei allen Plasmodien kommt auch P. vivax in verschiedenen Entwicklungsstadien vor. Leberschizonten haben oft eine ovale Form, erreichen Größen von zirka 44 mal 52 Mikrometern und enthalten eine große Zahl von Merozoiten, die jeweils 0,8 bis 1,2 Mikrometer groß sind. Bei der Vermehrung des Parasiten in Erythrozyten sind mehrfache Infektionen einer Zelle nicht ungewöhnlich. Im Verlauf der Entwicklung der Trophozoiten sind die Erythrozyten normalerweise deutlich vergrößert und weisen eine charakteristische Schüffnersche Tüpfelung auf, die aber nicht so prominent ist wie bei Plasmodium ovale. Die Trophozoiten selber zeigen ein amöboid geformtes Zytoplasma. Reife Blutschizonten enthalten 8 bis maximal 24, typischerweise 16 Merozoiten.
- Entwicklungsformen im gefärbten Blutausstrich
-
Trophozoit mit amöboidem Zytoplasma
-
Gametozyt
-
Gametozyt
Unreife Gametozyten sind mikroskopisch leicht von den ungeschlechtlichen Formen zu unterscheiden, da ihr Zytoplasma nicht amöboid geformt ist. Reife Makrogametozyten füllen die Wirtszelle vollständig aus; das Zytoplasma ist nach Färbung hellblau gefärbt mit verteiltem dunklem Pigment, der Zellkern relativ klein. Reife Mikrogametozyten zeigen ein blaugraues Zytoplasma mit einem großen Zellkern.
Systematik
[Bearbeiten | Quelltext bearbeiten]Traditionell wird Plasmodium vivax mit vielen anderen Primaten infizierenden Plasmodien in die Untergattung Plasmodium eingeordnet. Eine sehr nahe mit P. vivax verwandte Art ist P. simium, die bei Affen in Brasilien gefunden wurde. Nach bisher vorliegenden Gensequenzen sind beide Arten praktisch identisch, und es wird vermutet, dass P. simium durch einen Wirtswechsel von P. vivax vom Menschen zu den Affen entstanden ist.[3]
Nah verwandt, aber eindeutig zu unterscheiden sind eine Reihe von Plasmodienarten, die in Asien verschiedene Makaken infizieren, darunter P. cynomolgi und P. simiovale, aber auch Plasmodium knowlesi. Es wird angenommen, dass P. vivax seinen Ursprung bei diesen Plasmodien hat und vor mehreren 100.000 Jahren in Asien von Makaken auf den Menschen übergegangen ist.[3] Die Nähe von P. vivax zu P. knowlesi wurde auch durch Analysen der vollständig sequenzierten Genome beider Arten bestätigt, die eine weitgehende Syntänie der Chromosomen zeigten.[4] Ein in der Literatur „P. vivax-like“ genannter seltener Malariaerreger sieht zwar mikroskopisch aus wie P. vivax, ist aber molekular sehr ähnlich dem P. simiovale, möglicherweise sogar identisch mit diesem.[5]
Verbreitung und Wirtstiere
[Bearbeiten | Quelltext bearbeiten]Grundsätzlich kann Plasmodium vivax weltweit in gemäßigten und tropischen Regionen vorkommen, vor allem in Küstengebieten, Marschen und ähnlichen Gegenden. Beispielsweise existierte der Parasit bis ins 20. Jahrhundert in Deutschland als Erreger des Marschenfiebers.[6] Heute beschränkt sich die Verbreitung auf tropische und subtropische Länder. Die größte Zahl an Erkrankungen haben ihren Ursprung in Südostasien und im Westpazifik. In Mittel- und Südamerika sind die absoluten Fallzahlen geringer, P. vivax verursacht aber dort mehr als 70 % aller Malariafälle.[1] In Afrika sind Infektionen mit P. vivax vergleichsweise selten, da große Teile der dortigen Bevölkerung gegen den Parasiten resistent sind. P. vivax benötigt zum Eindringen in die Erythrozyten ein Wirtsprotein, das Duffy-Antigen; dieses Antigen fehlt bei mehr als 90 % der Bevölkerung in West-, Zentral- und Ostafrika.[7]
Der Mensch gilt als der einzige relevante Reservoirwirt für Plasmodium vivax. Experimentell konnten Schimpansen und Gibbons sowie eine Reihe von Neuweltaffen, aber keine Makaken infiziert werden. Ob mit dem sehr ähnlichen, vermutlich identischen P. simium infizierte Affen ein epidemiologisch relevantes Reservoir für Infektionen des Menschen darstellen, ist unklar. Wirte für P. simium sind der Braune Brüllaffe und selten auch der Südliche Spinnenaffe; das Verbreitungsgebiet von P. simium beschränkt sich auf Wälder in der Küstenregion im südlichen und südöstlichen Brasilien.[8] Inzwischen wurden P. vivax/P. simium auch mittels PCR in wilden Brüllaffen gefunden.[9]
Eine Vielzahl von Arten aus der Gattung Anopheles kann P. vivax übertragen; dies ist auch die Ursache für das große potentielle Verbreitungsgebiet des Parasiten. Unter anderem ist auch die in Europa heimische Art Anopheles atroparvus P. vivax ein geeigneter Vektor für den Parasiten.
Lebenszyklus
[Bearbeiten | Quelltext bearbeiten]Der Lebenszyklus von P. vivax gleicht im Wesentlichen dem anderer Plasmodien. Der Parasit zeigt einen obligaten Wirtswechsel. Die Sporozoiten gelangen durch infizierte Stechmücken in die Blutbahn des Menschen, wandern von dort in die Leber und dringen in Hepatozyten ein, in denen sie sich ungeschlechtlich durch Schizogonie vermehren. Die Inkubationszeit dieser Leberphase beträgt mindestens acht Tage. Die Leberschizonten produzieren jeweils große Zahlen von Merozoiten, die freigesetzt werden und Erythrozyten befallen, üblicherweise solche im Retikulozyten-Stadium. In diesen Zellen findet eine weitere ungeschlechtliche Vermehrung statt. Die Generationszeit bei der Vermehrung in den Erythrozyten beträgt im Mittel 48 Stunden oder etwas weniger. Da die Entwicklung oft synchron verläuft, kommt es am Ende jedes Vermehrungszyklus zu einer massenhaften Freisetzung neuer Parasiten, die mit einem Fieberschub verbunden ist. Aus der Periodizität der Fieberschübe leitet sich die Bezeichnung Malaria tertiana ab.
Einige wenige Plasmodien entwickeln sich in den Erythrozyten zu Geschlechtsformen, den Gametozyten. Im Gegensatz zum ebenfalls weit verbreiteten Malariaerreger Plasmodium falciparum entstehen bei P. vivax Gametozyten schon vor dem Ausbruch der Krankheit.[2] Dadurch können Stechmücken die Parasiten schon weiterverbreiten, noch bevor die Krankheit erkannt und behandelt wird. Die Mikrogametozyten und Makrogametozyten können von Mücken bei einer Blutmahlzeit aufgenommen werden und im Darm des Insekts einen neuen Entwicklungszyklus in Gang setzen. Nach einer Verschmelzung der Gameten werden im Darm neue Sporozoiten gebildet, die in die Speicheldrüse der Mücke wandern, von wo sie auf einen neuen Wirt übertragen werden können. Die Entwicklungszeit in der Mücke beträgt bei 25 °C zirka 11 bis 12 Tage. Selbst bei 16 °C kann P. vivax seine Entwicklung in der Mücke vollenden.
Nicht alle Leberparasiten werden in die Blutbahn freigesetzt. Es verbleiben Ruheformen, sogenannte Hypnozoiten, in der Leber, die nach Wochen oder Monaten zu auch Rezidiven genannten Rückfällen führen können. Diese Rezidive tragen erheblich zur Morbidität bei. Die Hypnozoiten müssen durch eine Behandlung mit Primaquin eliminiert werden.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b R. N. Price, E. Tjitra, C. A. Guerra, S. Yeung, N. J. White, N. M. Anstey: Vivax malaria: neglected and not benign. In: Am J Trop Med Hyg. 77(6 Suppl), Dez 2007, S. 79–87. PMID 18165478
- ↑ a b K. Mendis, B. J. Sina, P. Marchesini, R. Carter: The neglected burden of Plasmodium vivax malaria. In: Am. J. Trop. Med. Hyg. 64(1, 2)S, 2001, S. 97–106. PMID 11425182
- ↑ a b O. E. Cornejo, A. A. Escalante: The origin and age of Plasmodium vivax. In: Trends Parasitol. 22(12), Dez 2006, S. 558–563. PMID 17035086
- ↑ J. M. Carlton, J. H. Adams, J. C. Silva, S. L. Bidwell, H. Lorenzi, E. Caler, J. Crabtree, S. V. Angiuoli, E. F. Merino, P. Amedeo, Q. Cheng, R. M. Coulson, B. S. Crabb, H. A. Del Portillo, K. Essien, T. V. Feldblyum, C. Fernandez-Becerra, P. R. Gilson, A. H. Gueye, X. Guo, S. Kang'a, T. W. Kooij, M. Korsinczky, E. V. Meyer, V. Nene, I. Paulsen, O. White, S. A. Ralph, Q. Ren, T. J. Sargeant, S. L. Salzberg, C. J. Stoeckert, S. A. Sullivan, M. M. Yamamoto, S. L. Hoffman, J. R. Wortman, M. J. Gardner, M. R. Galinski, J. W. Barnwell, C. M. Fraser-Liggett: Comparative genomics of the neglected human malaria parasite Plasmodium vivax. In: Nature. 455(7214), 9. Okt 2008, S. 757–763. PMID 18843361
- ↑ S. H. Qari, Y. P. Shi, I. F. Goldman, V. Udhayakumar, M. P. Alpers, W. E. Collins, A. A. Lal: Identification of Plasmodium vivax-like human malaria parasite. In: Lancet. 341(8848), 27. Mar 1993, S. 780–783. PMID 8095999
- ↑ W. Köhler, M. Köhler: Zentralblatt für Bakteriologie – 100 years ago: malaria in north-west Germany. In: Int J Med Microbiol. 298(5-6), Jul 2008, S. 339–343. PMID 17897879
- ↑ R. Rosenberg: Plasmodium vivax in Africa: hidden in plain sight? In: Trends Parasitol. 23(5), Mai 2007, S. 193–196. Epub 2007 Mar 13. PMID 17360237
- ↑ L. M. Deane: Simian malaria in Brazil. In: Mem Inst Oswaldo Cruz. 87 Suppl 3, 1992, S. 1–20. PMID 1343676
- ↑ A. M. Duarte, S. Malafronte Rdos, C. Cerutti Jr, I. Curado, B. R. de Paiva, A. Y. Maeda, T. Yamasaki, M. E. Summa, V. Neves Ddo, S. G. de Oliveira, C. Gomes Ade: Natural Plasmodium infections in Brazilian wild monkeys: reservoirs for human infections? In: Acta Trop. 107(2), Aug 2008, S. 179–185. PMID 18620330
Literatur
[Bearbeiten | Quelltext bearbeiten]- G. Robert Coatney, William E. Collins, McWilson Warren, Peter G. Contacos: The primate malarias. U.S. National Institute of Allergy and Infectious Diseases, Bethesda 1971. Kapitel 5, S. 43 ff.: Plasmodium vivax PDF