Retrosynthese
Die Retrosynthese oder auch retrosynthetische Analyse ist eine Technik beim Planen einer chemischen Synthese von komplexen organischen Molekülen. Dabei wird das Molekül gedanklich in einfachere Bausteine zerlegt, für deren Verknüpfung Synthesebeispiele bekannt sind. Auf diese Weise gelangt man schrittweise zu käuflichen oder literaturbekannten Bausteinen. Dies führt zu einem Schema, welches sich wie ein Baum nach unten verzweigt. E. J. Corey hat diesen Formalismus eingeführt[1] und wurde aufgrund dieser Arbeiten im Jahr 1990 mit dem Nobelpreis für Chemie geehrt.[2][3] Die Mächtigkeit der Retrosynthese zeigt sich, wenn eine neue Syntheseroute entworfen werden soll. Ziel ist es, die gewünschte Struktur immer weiter zu vereinfachen. Dabei ergeben sich in der Regel mehrere mögliche Routen, welche in ihrer Gesamtheit den Synthese-Baum ausmachen. Die Aufgabe des Chemikers ist es nun, den idealen Weg auszuwählen, der jedoch nicht immer der kürzeste sein muss.[4]
Definitionen
[Bearbeiten | Quelltext bearbeiten]Für diese formalen Schnitte hat Corey ein einfaches Bausteinmodell entwickelt, welches sogar über ein Computerprogramm (LHASA) mit Hilfe einer Reaktionsdatenbank das Retrosyntheseschema liefern kann. Hierzu wurden mehrere mögliche Reaktionsschritte abstrahiert und in folgenden Definitionen formuliert.
- Disconnections: Ein retrosynthetischer Schritt, der den Bruch einer oder mehrerer Bindungen zu mehreren Synthons bedeutet
- Retron: Das Startmolekül am unteren Ende des Retrosynthesebaums
- Retrosynthetic tree: Retrosynthesebaum
- Synthon: Siehe eigener Artikel Synthon
- Target: Das Zielmolekül
- Transform: Der umgekehrte Schritt wie bei der eigentlichen Syntheseoperation, welches auch Schritte sein dürfen, die eine beteiligte funktionelle Gruppe aktivieren (functional group transformation)
Beispiel
[Bearbeiten | Quelltext bearbeiten]Am einfachen Beispiel der Phenylessigsäure kann das Konzept der Retrosynthese anschaulich gemacht werden:
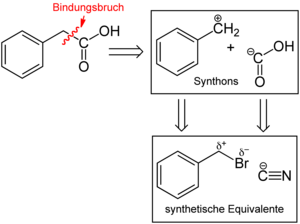
Bei der Planung der Synthese können zwei Synthons erkannt werden. Das eine Synthon ist die Carboxygruppe −COOH als nucleophiles Synthon. Als komplementäres elektrophiles Synthon kann man die PhCH2+-Gruppe, also das Benzylkation, erkennen. Beide Synthons sind als Verbindung nicht stabil. Dazu werden nun synthetische Äquivalente gesucht. Ein Äquivalent für das −COOH ist das Cyanid-Anion, das andere, für das Benzylkation, wäre Benzylbromid. Bezeichnend für ein synthetisches Äquivalent ist, dass es die elektronischen Eigenschaften des Synthons widerspiegelt, also dessen Reaktivität aufweisen sollte, und dass das durch Verknüpfung der Synthons erhaltene Molekül chemisch später durch Manipulation der funktionellen Gruppe (hier der Nitrilgruppe) in das Target, also Phenylessigsäure, umgewandelt werden kann. Die Umwandlung wäre in diesem Beispiel durch saure oder basische Hydrolyse möglich:

Alternativ könnte die retrosynthetische Analyse zur Herstellung von Phenylessigsäure auch zwei andere Synthons ergeben, die PhCH2−-Gruppe und +COOH. Auch diese beiden Synthons sind als Verbindung nicht stabil. Deshalb werden nun synthetische Äquivalente gesucht. Ein Äquivalent zur PhCH2−-Gruppe ist Benzylmagnesiumbromid (PhCH2MgBr) mit dem negativ polarisierten benzylischen Kohlenstoffatom, das synthetische Äquivalent zu +COOH ist Kohlendioxid, CO2:

Durch die Verknüpfung dieser beiden Synthons würde PhCH2CO2MgBr resultieren, dessen Hydrolyse dann das Zielmolekül Phenylessigsäure liefert.
Strategien
[Bearbeiten | Quelltext bearbeiten]- Funktionelle-Gruppen-Strategie: Veränderungen der funktionellen Gruppe führt zu einer Verringerung der Komplexität des Moleküls.
- Stereochemische Strategie: Viele Targets sind stereochemisch komplexe Moleküle. Stereochemische Transformationen können durch stereospezifische Reaktionen übertragen oder verändert werden. Beispiele hierfür wären die Diels-Alder-Reaktion, die Claisen-Umlagerung oder die Mitsunobu-Reaktion. Dadurch kann das Target stereochemisch vereinfacht werden.
- Struktur-Ziel-Strategie: Diese bidirektionale Strategie nähert sich dem Zielmolekül von beiden Seiten, also von der retrosynthetischen als auch von der synthetischen Seite zu einem gemeinsamen Intermediat. Diese Strategie kann der Auswahl bzw. das Finden eines geeigneten Syntheseweges vereinfachen.
- Transformations-Strategie: Die Transformationen können die Komplexität eines Moleküls deutlich verringern. Leider sind gute Retrone selten und dies kann bedeuten, dass man zusätzliche Syntheseschritte einplanen muss, die das Retron hierzu aktivieren.
- Topologische Strategie: Das Auffinden von einer oder mehreren strategischen Schnitten kann zu einem Schlüsselintermediat führen, bei welchem eine Umlagerungstransformation des Gerüstes leicht zu erkennen ist. Hierbei gilt in der Regel, dass Ringstrukturen bevorzugt gebildet werden und dass Ringgrößen mit mehr als sieben Atomen nicht mehr bevorzugt sind.
LHASA
[Bearbeiten | Quelltext bearbeiten]Die Entwicklung von LHASA (Logic and Heuristic Applied to Synthesis Analysis) wird derzeit von drei Arbeitsgruppen betrieben. LHASA berechnet Synthesebäume ausschließlich auf retrosynthetischer Basis. Es verfügt derzeit über eine Datenbank von 2000 Transformationen. Beurteilt werden die Transformationen durch von Corey entwickelte Synthesestrategien.
- Zwischenschritt-Transform ('Subgoal Transform'): LHASA beschränkt sich nur auf das Umwandeln von funktionellen Gruppen.
- Strategisches Transform ('Goal Transform'): LHASA versucht als Ziel jedes Retrosyntheseschrittes das Retron eines strategischen Transforms zu erreichen. Dies führt zu einer Vereinfachung des Syntheseziels und bedeutet meist den Bruch einer oder mehrerer Bindungen.
- Taktische Kombination ('Tactical Combination'): Es besteht eine feste Reihenfolge strategischer Transformationen oder Zwischenschritt-Transformationen die das Syntheseziel vereinfachen sollen.
- Weitreichendes Transform ('Long-range Transform'): Mit dieser Strategie versucht LHASA möglichst komplexe Transformationen anzuwenden die zu einer maximalen Vereinfachung des Syntheseintermediates führen sollen.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ E. J. Corey, X-M. Cheng: The Logic of Chemical Synthesis. Wiley, New York 1995, ISBN 0-471-11594-0.
- ↑ Nobelpreiskomitee.
- ↑ The Logic of Chemical Synthesis: Multistep Synthesis of Complex Carbogenic Molecules (Nobel Lecture) (PDF-Datei) auf nobelprize.org. Abgerufen am 23. Mai 2024.
- ↑ E. J. Corey: "Retrosynthetic Thinking – Essentials and Examples". In Chem. Soc. Rev. 1988, 17, 111–133. doi:10.1039/CS9881700111.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Retrosynthese beim Vernetzten Studium Uni Erlangen
- Centre for Molecular and Biomolecular Informatics
- Presentation on ARChem Route Designer, ACS, Philadelphia, September 2008