Ruthenium(V)-fluorid
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| _ Ru5+ _ F− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ruthenium(V)-fluorid | ||||||||||||||||||
| Andere Namen |
Rutheniumpentafluorid | ||||||||||||||||||
| Verhältnisformel | RuF5 | ||||||||||||||||||
| Kurzbeschreibung |
smaragdgrüner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 196 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
3,9 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt |
86,5 °C[2] | ||||||||||||||||||
| Siedepunkt |
227 °C[2] | ||||||||||||||||||
| Löslichkeit |
in Wasser Hydrolyse[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Ruthenium(V)-fluorid ist eine chemische Verbindung des Rutheniums und zählt zu den Fluoriden. Es handelt sich um einen smaragdgrünen Feststoff.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Ruthenium(V)-fluorid wurde erstmals 1925 von Otto Ruff und Ernst Vidic synthetisiert. Sie suchten eigentlich ein dem Osmium(VI)-fluorid entsprechendes Rutheniumanalogon, konnten es bei den für sie erreichbaren Temperaturen jedoch nicht synthetisieren. Stattdessen war das Pentafluorid das einzige Reaktionsprodukt.[5]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Ruthenium(V)-fluorid lässt sich direkt aus den Elementen bei etwa 300 °C erhalten.[1]
Eigenschaften
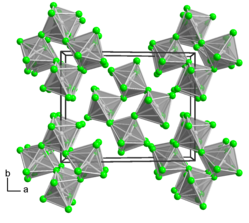
[Bearbeiten | Quelltext bearbeiten]Ruthenium(V)-fluorid kristallisiert im monoklinen Kristallsystem in der Raumgruppe P21/a (Raumgruppen-Nr. 14, Stellung 3) mit den Gitterparametern a = 12,47 Å, b = 10,01 Å, c = 5,42 Å und β = 99,5° sowie acht Formeleinheiten pro Elementarzelle. Es bildet Tetramere, in denen benachbarte Rutheniumatome über Fluorbrücken miteinander verbunden sind.[1]
Mit Wasser erfolgt eine Hydrolyse, dabei bildet sich zunächst eine Mischung aus drei- und vierwertigen Rutheniumhydroxiden und Fluor. Dieses oxidiert das Ruthenium zu Ruthenium(VIII)-oxid.[3] Mit Xenondifluorid als Fluoriddonor werden in einer Fluoridtransferreaktion je nach Mischungsverhältnis verschiedene ionische Verbindungen gebildet.[6]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c J. H. Holloway, R. D. Peacock, R. W. H. Small: The crystal structure of ruthenium pentafluoride. In: Journal of the Chemical Society. 1964, S. 644–648, doi:10.1039/JR9640000644.
- ↑ a b c Ruthenium(V)-fluorid bei Webelements.com
- ↑ a b Tsutomu Sakurai, Akira Takahashi: Behavior of ruthenium in fluoride-volatility processes—V conversions of RuOF4, RuF4, and RuF5 into RuO4. In: Journal of Inorganic and Nuclear Chemistry. 1979, 41, 5, S. 681–685, doi:10.1016/0022-1902(79)80354-1.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Otto Ruff, Ernst Vidic: Das Rutheniumpentafluorid und ein Verfahren zur Trennung von Platin und Ruthenium. In: Zeitschrift für anorganische und allgemeine Chemie. 1925, 143, 1, S. 163–182, doi:10.1002/zaac.19251430112.
- ↑ Ralf Steudel: Chemie der Nichtmetalle, Synthesen - Strukturen - Bindung - Verwendung, 4. Auflage, 2014 Walter de Gruyter GmbH & Co. KG, Berlin/Boston, ISBN 978-3-11-030439-8, S. 570, (abgerufen über De Gruyter Online).

![{\displaystyle \mathrm {2\,XeF_{2}+RuF_{5}\rightarrow [Xe_{2}F_{3}][RuF_{6}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ea016adf0a91345736adf6f20d1a3def25817b5e)
![{\displaystyle \mathrm {XeF_{2}+RuF_{5}\rightarrow [XeF][RuF_{6}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/3644575b410948382b62048ba730902ca068ff19)
![{\displaystyle \mathrm {XeF_{2}+2\,RuF_{5}\rightarrow [XeF][Ru_{2}F_{11}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/3781ea4b0aa96ada6e297932f002f59c868f07a0)