Sauerstoffdifluorid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Sauerstoffdifluorid | |||||||||||||||
| Andere Namen |
Difluoroxid | |||||||||||||||
| Summenformel | OF2 | |||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit widerlichem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 54,00 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte |
2,42 g·l−1 (0 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
schlecht in Wasser (68 cm3/l bei 0 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 0,05 ml·m−3 bzw. 0,1 mg·m−3[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Sauerstoffdifluorid ist ein Fluorid des Sauerstoffs mit der Summenformel OF2. Es gehört zu den Sauerstofffluoriden und ist einer von sehr wenigen Stoffen, in dem Sauerstoff mit einer positiven Oxidationszahl auftritt. Der manchmal verwendete Name Difluoroxid für diese Verbindung ist falsch, weil Sauerstoff in Oxiden eine negative Oxidationszahl besitzt.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Über Sauerstoffdifluorid wurde 1929 das erste Mal berichtet, dargestellt wurde es bei der Elektrolyse von geschmolzenem Kaliumfluorid und Fluorwasserstoff in Wasser. Heutzutage wird Sauerstoffdifluorid durch Einleiten von Fluor in Natronlauge oder Kalilauge gewonnen:[5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Sauerstoffdifluorid ist eines der stärksten bekannten Oxidationsmittel, das sogar mit dem Edelgas Xenon zu Xenontetrafluorid (XeF4) reagieren kann:
Grund für diese Reaktion ist die starke Elektronegativität von Fluor und Sauerstoff, welcher in Sauerstoffdifluorid eine positive Partialladung hat.
In Wasser ist es wenig löslich,[3] gelöst reagiert Sauerstoffdifluorid mit Wasser zu Fluorwasserstoff und Sauerstoff (Komproportionierung)[2]:
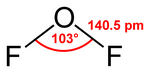
Es kondensiert bei −144,8 °C zu einer orangefarbenen Flüssigkeit, die von der Struktur her an Wasser erinnert. Der Bindungswinkel, den die beiden O-F-Bindungen einschließen, beträgt 103°, die Bindungslänge der O-F-Bindungen jeweils 140,5 pm.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Sauerstoffdifluorid wurde als Oxidationsmittel für Raketentreibstoffe[6] untersucht, da es einen hohen spezifischen Impuls liefert (z. B. zusammen mit Lithiumhydrid 4112 m/s.[7]).
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Aufgrund seiner extrem starken oxidierenden Wirkung ist Sauerstoffdifluorid ein für Mensch und Tier gefährlicher Stoff. Es erzeugt nach Einatmung heftige Atembeschwerden, die oft erst nach mehreren Stunden einsetzen und stundenlang anhalten.[8]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Eintrag zu Sauerstoffdifluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Februar 2017. (JavaScript erforderlich)
- ↑ a b c Eintrag zu Sauerstoff-Fluoride. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. Juni 2017.
- ↑ a b Holleman/Wiberg: Grundlagen und Hauptgruppenelemente Band 1: Grundlagen und Hauptgruppenelemente. Walter de Gruyter GmbH & Co KG, 2016, ISBN 3-11-049585-6, S. 532 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7783-41-7 bzw. Sauerstoffdifluorid), abgerufen am 2. November 2015.
- ↑ Eintrag zu Sauerstoff-Fluoride. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juli 2014.
- ↑ Liste von als Kriegsmaterial dienenden Stoffen der schweizerischen Eidgenossenschaft.
- ↑ Raketentreibstoffe bei Bernd Leitenbergers Raumfahrt Homepage.
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 179.





