Tetrachlorsilan
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
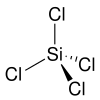
| |||||||||||||||||||
| Keile zur Verdeutlichung der Geometrie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tetrachlorsilan | ||||||||||||||||||
| Andere Namen |
Siliciumtetrachlorid | ||||||||||||||||||
| Summenformel | SiCl4 | ||||||||||||||||||
| Kurzbeschreibung |
stechend riechende, farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 169,90 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,48 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
57 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
reagiert heftig mit Wasser[1] | ||||||||||||||||||
| Brechungsindex |
1,41156 (25 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Tetrachlorsilan (auch Siliciumtetrachlorid, Siliziumtetrachlorid) ist das perchlorierte Derivat von Monosilan. Es ist eine chemische Verbindung aus der Gruppe der Siliciumtetrahalogenide mit der Summenformel SiCl4. Es ist eine farblose, flüchtige, an feuchter Luft rauchende Flüssigkeit, die aus den Elementen Silicium und Chlor besteht.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Tetrachlorsilan wurde zuerst 1823 von Jöns Jacob Berzelius hergestellt.[4] Dazu leitete dieser Chlorgas über erhitztes Silicium oder ein Kieselsäure/Kohle-Gemisch und isolierte das entstandene Tetrachlorsilan in einer gekühlten Vorlage.[5]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Tetrachlorsilan wird üblicherweise durch die chemische Reaktion von Chlor mit heißem Silicium gewonnen:
- .
Da bei der weiteren Verarbeitung zu Siliciumdioxid Chlorwasserstoff entsteht, wird dieser ebenfalls genutzt, um so durch den Verbund Rohstoffe zu sparen:
- .
Der dabei entstehende Wasserstoff kann für die Herstellung pyrogener Kieselsäure genutzt werden.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Tetrachlorsilan ist eine sehr reaktive Verbindung. Anders als die entsprechende Kohlenstoffverbindung Tetrachlormethan reagiert Tetrachlorsilan heftig mit Wasser:
Die Hydrolyse von Tetrachlorsilan erfolgt dabei über die Zwischenstufen SiCl3(OH), SiCl2(OH)2 und SiCl(OH)3, welche bei niedrigeren Temperaturen isoliert werden können. Diese Zwischenprodukte können, wie bei anderen Silanolen, miteinander unter Wasserabspaltung z. B. zu linearen Verbindungen vom Typ SinO(n-1)Cl(2n+2) dimerisieren oder polymerisieren, wobei der gebildete Chlorwasserstoff die Polymerisation beschleunigt. Das erste Zwischenprodukt das Trichlormonosilanol dimerisiert analog anderen Monosilanolen, wie Trimethylsilanol, unter Bildung von Hexachlordisiloxan.[6] Die Triebkraft der Reaktion ist in jedem Fall die Ausbildung der besonders stabilen Si–O–Si-Bindung.
Oxidationsmittel, Säuren, Alkohole, Basen, Ketone, Aldehyde u. v. a. reagieren ebenfalls mit Siliciumtetrachlorid. Es besitzt eine starke korrodierende Wirkung und wirkt ätzend auf Haut, Augen und Lungen.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Bei der Reinigung von Silicium wird Siliciumtetrachlorid zuweilen als Zwischenstufe verwendet. Durch Umsetzung mit Butyllithium in Diethylether kann Tetrabutylsilan hergestellt werden:[7]
In ähnlicher Weise kann auch Tetramethylorthosilicat und Tetraethylorthosilicat hergestellt werden.[8] Das meiste Siliziumtetrachlorid wird aber zur Produktion von Kieselsäuren verwendet.[8]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- International Chemical Safety Card (ICSC) für Tetrachlorosilane bei der International Labour Organization (ILO)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i Eintrag zu Siliciumtetrachlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Index of Refraction of Inorganic Liquids, S. 4-140.
- ↑ Eintrag zu Silicon tetrachloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Gustav Rauter: Ueber das Siliciumtetrachlorid. In: Justus Liebig’s Annalen der Chemie. Band 270, Nr. 1-2, 1892, S. 235–266, doi:10.1002/jlac.18922700114.
- ↑ Jöns Jacob Berzelius: Chlorkiesel. In: Lehrbuch der Chemie. 5. Auflage. Band 1. Arnold-Verlag, Dresden 1856, S. 325–326 (digitale-sammlungen.de).
- ↑ Joseph Goubeau, Rudolf Warncke: Zur Hydrolyse von Halogeniden. I. Die Hydrolyse des Siliciumtetrachlorids. In: Zeitschrift für anorganische und allgemeine Chemie. Band 259, Nr. 1-4, Oktober 1949, S. 109–120, doi:10.1002/zaac.19492590109.
- ↑ Stephan Pawlenko: Organosilicon Chemistry. Walter de Gruyter, 1986, ISBN 978-3-11-086238-6, S. 18 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Siliziumtetrachlorid (Silicon tetrachloride). In: www.products.pcc.eu. PCC Gruppe, abgerufen am 10. September 2021.







![{\displaystyle {\ce {SiCl4{}+4LiC4H9->[\mathrm {Et_{2}O} ][]Si(C4H9)4{}+4LiCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a859a6a384018c457f148f79360c67b1ad47ba89)