Trifluormethansulfonsäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Trifluormethansulfonsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | CF3SO3H | ||||||||||||||||||
| Kurzbeschreibung |
farblose, stechend riechende, hygroskopische Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 150,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt |
−40 °C[1] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
−20[3] | ||||||||||||||||||
| Löslichkeit |
löslich in Wasser[2] und polaren organischen Lösungsmitteln wie DMF, DMSO, Sulfolan, Acetonitril[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Die Trifluormethansulfonsäure CF3SO3H ist eine sogenannte Supersäure und spielt in der organischen Chemie eine Rolle.[6] Auch ihr Anion, das Trifluormethansulfonat CF3SO3−, meist Triflat genannt, ist von Bedeutung. Als konjugierte Base einer Supersäure ist es ein sehr stabiles Anion.[7] Trifluormethylsulfonsäure findet in der organischen Chemie vielfältige Verwendung, die Triflatgruppe wird gern als Abgangsgruppe benutzt und ihre Salze kommen in Katalysatoren zum Einsatz. Für die Triflatgruppe wird in Fachpublikationen zumeist die Abkürzung „OTf“ verwendet; die Abkürzung „Tf“ steht für die Trifluormethansulfonylgruppe –SO2CF3, auch Triflylgruppe genannt.
Darstellung und Gewinnung
[Bearbeiten | Quelltext bearbeiten]Trifluormethansulfonsäure wurde erstmals 1954 von Haszeldine und Kidd durch die folgende Reaktion dargestellt:[8][6]
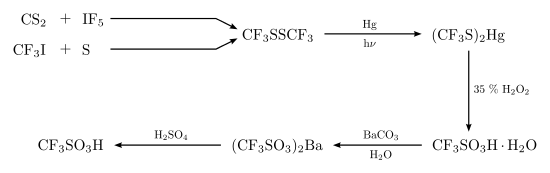
Weitere Synthesemöglichkeiten sind die elektrochemische Fluorierung (ECF):

oder die Oxidation von Methyltrifluormethylsulfid:[6]
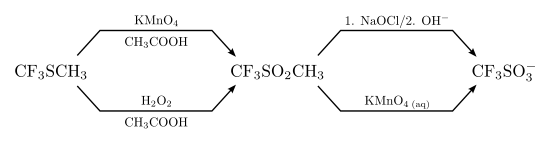
Die industrielle Herstellung geschieht über die elektrochemische Fluorierung von Methansulfonylchlorid. Diese Synthese ist teuer, daher werden Alternativen gesucht. So ist es beispielsweise gelungen, Trifluormethansulfonsäure aus Trifluormethan in stark saurer oder stark basischer Lösung herzustellen. Dabei handelt es sich um eine radikalische Reaktion, beispielsweise mit SO3 oder SO2Cl2. Die Ausbeuten sind allerdings gering.[9] Nach günstigeren Synthesen wird weiterhin gesucht.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Trifluormethansulfonsäure ist eine bei Standardbedingungen klare, farblose Flüssigkeit mit einem Siedepunkt von 162 °C. Die Verbindung raucht an der Luft, wobei sich das stabile Monohydrat (eigentlich: Oxoniumtrifluormethylsulfonat) bildet, welches einen Schmelzpunkt von 36 °C besitzt und stark hygroskopisch ist. Neben dem Monohydrat sind noch weitere Hydrate, ein Dihydrat, ein Tetrahydrat und ein Hexahydrat bekannt, die allerdings schon unterhalb der Raumtemperatur schmelzen.[10]
| Hydrate der Trifluormethansulfonsäure (TfOH) – Schmelzpunkte und Eutektika[10] | ||||||||||||
| Verbindung | Wasser | Hexahydrat | Tetrahydrat | Dihydrat | Monohydrat | Trifluormethansulfonsäure | ||||||
| Zusammensetzung | H2O | TfOH·6H2O | TfOH·4H2O | TfOH·2H2O | TfOH·H2O | TfOH | ||||||
| Gehalt TfOH | in Mol% | 0 | 13,3 | 14,5 | 16,5 | 20,0 | 22,7 | 33,3 | 37,0 | 50,0 | 68,5 | 100 |
| in Ma% | 0 | 56,1 | 58,5 | 62,2 | 67,6 | 71,0 | 80,6 | 83,0 | 89,3 | 94,8 | 100 | |
| Schmelzpunkt | in °C | 0 | −47,5 | −49,5 | −6,5 | 36,0 | −43,53 | |||||
| Eutektikum | in °C | −84 | −76,5 | −60 | −12 | −17,5[A 1] | ||||||
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Trifluormethansulfonsäure ist in allen polaren Lösungsmitteln löslich. Allerdings kann in Estern, Ethern, Alkoholen oder Ketonen nicht immer davon ausgegangen werden, dass sich Trifluormethansulfonsäure inert gegenüber dem Lösungsmittel verhält.[4] Sowohl die Säure als auch die konjugierte Base, das Triflatanion, sind resistent gegen die meisten Oxidations- und Reduktionsmittel, während viele andere starke Säuren oxidierend wirken, wie z. B. Perchlorsäure oder Salpetersäure. Das Triflatanion widersteht selbst starken Nucleophilen. Zudem sulfoniert die Trifluormethansulfonsäure keine Substrate, was bei Schwefelsäure durchaus passieren kann.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Trifluormethansulfonsäure und Triflate (s. u.) werden in der organischen Chemie verbreitet benutzt, die Säure selbst vor allem als Katalysator in der Polymer-, Brennstoff-, Pharma- und Zuckerindustrie. Für Protonierungen ist die Säure besonders gut geeignet, da die konjugierte Base, das Triflat, nicht weiterreagiert.
Salzbildung
[Bearbeiten | Quelltext bearbeiten]Trifluormethansulfonsäure reagiert unter anderem mit Metallcarbonaten und -hydroxiden in wässriger Lösung exotherm unter Bildung der Triflatsalze. Als Beispiel sei die Synthese von Kupfer(II)-triflat aus Kupfer(II)-carbonat genannt:
Reaktionen in der organischen Chemie
[Bearbeiten | Quelltext bearbeiten]Die Reaktionen dieser Verbindung sind vielfältig und können hier nur zu einem kleinen Teil dargestellt werden. Für weitergehende Informationen sei auf die Literatur verwiesen.
Aus Trifluormethansulfonsäure können durch Zugabe von Säureanhydriden oder -chloriden gemischte Anhydride gewonnen werden. Diese sind starke Acylierungsreagenzien und können zum Beispiel bei Friedel-Crafts-Acylierungen[11] eingesetzt werden:
Trifluormethansulfonsäure katalysiert die Reaktion von Aromaten mit Sulfonylchloriden, vermutlich ebenfalls über eine intermediäre Anhydridbildung.
Bei säurekatalysierten Dehydratisierungen bewirkt ein Zusatz von Trifluormethansulfonsäure eine sofortige Isomerisierung der gebildeten Alkene zugunsten des thermodynamisch stabileren Alkens.
Triflate
[Bearbeiten | Quelltext bearbeiten]Die Triflatgruppe findet in der organischen Chemie verbreitete Verwendung als Abgangsgruppe. Grund dafür ist extreme Stabilität des Triflatanions, zum einen durch mesomere Verteilung der negativen Ladung über die drei Sauerstoffatome und den Schwefel:

Zusätzlich wird diese Ladung durch den kräftigen elektronenziehenden Effekt (hohe Elektronegativität der drei Fluoratome) der Trifluormethylgruppe stabilisiert. Triflat ist damit eine bessere Abgangsgruppe als beispielsweise die verwandten Nukleofuge Tosylat und Mesylat.
Triflatsalze sind thermisch häufig sehr stabil; die Schmelzpunkte der kristallwasserfreien Salze liegen teilweise über 350 °C (Na-, Ba-, Ag-Salze). Wie oben bereits erwähnt, können sie direkt aus der Reaktion der Säure mit Metallhydroxiden oder Metallcarbonaten in wässriger Lösung gewonnen werden. Triflatsalze werden in den letzten Jahren verstärkt und erfolgreich als Lewis-Säuren in vielen Reaktionen eingesetzt. Der Vorteil dieser Salze ist ihre Stabilität in Wasser, die für viele klassische Lewissäuren wie z. B. AlCl3 nicht gegeben ist. Besonders geeignet sind Lanthanoidsalze des Typs Ln(OTf)3, im Speziellen das Scandiumsalz Sc(OTf)3. Diese Verbindung kann für ein breites Feld von Reaktionen verwendet werden, so Aldolreaktionen und Diels-Alder-Reaktionen (weitere Reaktionen siehe Namensreaktion oder Lewis-Säure).
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Trifluormethansulfonsäure raucht an der Luft, ist ätzend und muss dementsprechend vorsichtig gehandhabt werden. Arbeit unter dem Abzug ist unbedingt erforderlich.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Eintrag zu Trifluormethansulfonsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Juli 2016.
- ↑ a b c d e Datenblatt Trifluormethansulfonsäure bei Merck, abgerufen am 24. April 2011.
- ↑ Patentanmeldung EP0955562A1: Chemisch verstärkter Resist. Angemeldet am 26. April 1999, veröffentlicht am 10. November 1999, Anmelder: Siemens AG, Erfinder: Stefan Hien (Abschnitt 0010).
- ↑ a b e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999–2013, John Wiley and Sons, Inc., Eintrag für Trifluoromethanesulfonic Acid, abgerufen am 6. Januar 2015.
- ↑ a b Eintrag zu Trifluormethansulfonsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- ↑ a b c R. D. Howells, J. D. Mc Cowna: Trifluoromethanesulfonic Acid and Derivatives, Chemical Reviews 77 (1977) 69–92. doi:10.1021/cr60305a005.
- ↑ A. Streitwieser Jr., C. L. Wilkins, E. Kiehlmann: Kinetics and Isotope Effects in Solvolyses of Ethyl Trifluoromethanesulfonate, Journal of the American Chemical Society 90 (1968) 1598–1601. doi:10.1021/ja01008a601.
- ↑ Haszeldine, R.N.; Kidd, J.M.: Perfluoroalkyl derivatives of sulphur. Part I. Trifluoromethanesulphonic acid in J. Chem. Soc. 1954, 4228–4232, doi:10.1039/JR9540004228.
- ↑ S. Mukhopadhyay, A. T. Bell, R. V. Srinivas, G. S. Smith: Synthesis of Trifluoromethanesulfonic Acid from CHF3. In: Organic Process Research & Development 4/8/2004. S. 660–662, doi:10.1021/op040007r.
- ↑ a b Corkum, R.; Milne, J.: The density, electrical conductivity, freezing point, and viscosity of mixtures of trifluoromethanesulfonic acid and water. in Can. J. Chem. 56 (1978) 1832–1835, doi:10.1139/v78-297, PDF-Datei.
- ↑ E. Vedejs, D. A. Engler, M. J. Mullins: Reactive Triflate Alkylating Agents. In: The Journal of Organic Chemistry 19/42/1977. S. 3109–3113, doi:10.1021/jo00439a001.




