Verapamil
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| 1:1-Gemisch aus (S)-Form (oben) und (R)-Form (unten) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Verapamil | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C27H38N2O4 (Verapamil) | |||||||||||||||||||||
| Kurzbeschreibung |
hellgelbes, viskoses Öl[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 454,60 g·mol−1(Verapamil) | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| pKS-Wert |
8,6 (Verapamil·Hydrochlorid)[2] | |||||||||||||||||||||
| Löslichkeit |
Verapamil: unlöslich in Wasser (4,47 mg·l−1 bei 25 °C), löslich in Benzol, Diethylether, sehr leicht löslich in niederen Alkoholen, Aceton und Chloroform[1] | |||||||||||||||||||||
| Brechungsindex |
1,5448 (25 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Verapamil ist ein Arzneistoff aus der Gruppe der Calciumantagonisten oder Calciumkanalblocker, der gefäßerweiternd und im AV-Knoten des Herzens leitungsverzögernd wirkt. Verapamil gehört zur Klasse IV der Vaughan/Williams-Klassifikation der Antiarrhythmika und zählt zu den Phenylalkylaminen. Es wird eingesetzt zur Behandlung:
- der koronaren Herzkrankheit,
- von Störungen der Herzschlagfolge (Arrhythmie),
- des Bluthochdrucks,
- von Cluster-Kopfschmerz (Off-Label-Use)[5] und
- der hypertrophen Kardiomyopathie (Off-Label-Use).
Seit 1983 wird Verapamil in der Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation geführt. Pharmazeutisch wird der Wirkstoff als Verapamilhydrochlorid eingesetzt.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Um 1960 begann die Firma Knoll AG mit der Forschung nach einer neuen Substanz, die die Herzkranzarterien weitstellt und so Durchblutung des Herzmuskels verbessert. Als Ausgangssubstanz verwendete sie dafür Papaverin, dessen Wirkung schon bekannt war. Daraus entwickelte Ferdinand Dengel eine Gruppe ähnlicher Verbindungen. Aus dieser wählte er final die Substanz D 365 aus, die heutzutage als Verapamil bekannt ist. In verschiedenen Untersuchungen belegten Hans Haas (1907–1996) und G. Härtfelder erstmals, dass Verapamil tatsächlich, wie gewünscht, die Herzkranzgefäße weitstellt. Darüber hinaus konnte eine Verlangsamung des Herzschlags festgestellt werden. Allerdings gab es zu dieser Zeit kein Wissen über den genauen Wirkmechanismus. Aufgrund der Senkung der Herzfrequenz vermutete man eine β-rezeptorblockierende Wirkung, ohne dass es einen klaren Beleg dafür gab, und in der Folge kam es zu heftigen Diskussionen über das therapeutische Wirkprinzip. In dieser Situation war aber das Mittel unter dem Handelsnamen Isoptin bereits auf den westdeutschen Markt gelangt, der wirtschaftliche Erfolg blieb jedoch angesichts der bestehenden Unklarheiten zunächst weitgehend aus. So beauftragten die Firmen Knoll und Hoechst noch im November desselben Jahres Albrecht Fleckenstein damit, die beiden Substanzen Verapamil und Prenylamin[S 1] auf ihren spezifischen Wirkmechanismus hin zu untersuchen. 1964 entdeckte Fleckenstein, dass die Substanzen nach einem bis dato unbekannten Mechanismus den Einstrom von Calcium-Ionen in die Herzmuskelzellen hemmen, indem sie deren spezifische Kanäle blockieren. Dies war die Geburtsstunde der Calciumantagonisten, die man auch anschaulich Kalziumkanalblocker nennt. 1967 grenzte Fleckenstein die Substanzen Verapamil (Isoptin) und Gallopamil (Procorum) deutlich von den Betablockern ab und ordnete sie in die neue Substanzklasse ein, die 1969 offiziell zu ihrem Namen kam.[6]
Anwendung
[Bearbeiten | Quelltext bearbeiten]Bei Patienten mit koronarer Herzkrankheit wird Verapamil bei chronisch stabiler Angina pectoris, bei instabiler Angina pectoris und insbesondere bei vasospastischer Angina pectoris (Prinzmetal-Angina) eingesetzt, bei Patienten nach einem Herzinfarkt nur, wenn keine Herzinsuffizienz besteht und Betablocker nicht indiziert sind.
Als Antiarrhythmikum zur Behandlung von Herzrhythmusstörungen kann Verapamil vorbeugend gegen paroxysmale supraventrikuläre Tachykardien über mindestens zwei Minuten[7] bei Erwachsenen zur Verlangsamung der Pulsfrequenz bei Vorhofflimmern und Vorhofflattern mit erhöhter Kammerfrequenz verordnet werden.
Darüber hinaus wird Verapamil als Prophylaxe bei Cluster-Kopfschmerz eingesetzt. Da eine vergleichbar hohe Dosierung für die Unterdrückung von Cluster-Kopfschmerz-Attacken erforderlich ist, wird eine regelmäßige EKG-Überprüfung empfohlen.[8]
Seltener wird Verapamil ausschließlich zur Senkung des Blutdrucks bei arterieller Hypertonie verwendet.
Zur Behandlung der Induratio penis plastica (IPP) wird Verapamil in die Schwellkörper des Penis eingespritzt; eine Zulassung hierfür liegt nicht vor (Off-Label-Use). In kleineren Doppelblindstudien war der Effekt gering.[9] Eine Studie zeigte eine günstige Wirkung bezüglich der Schmerzsymptomatik, die sich nicht von der Vergleichsbehandlung mit extrakorporalen Stoßwellen unterschied, keine Verbesserung gab es bei IPP-Plaques und Deviation.[10]
Gegenanzeigen und Warnhinweise
[Bearbeiten | Quelltext bearbeiten]Verapamil darf nicht angewandt werden bei Schock, akutem Herzinfarkt mit Komplikationen wie Bradykardie, Hypotonie oder Linksherzinsuffizienz, ausgeprägten Erregungsleitungsstörungen wie SA- oder AV-Block II. und III. Grades, Sinusknotensyndrom, manifester Herzinsuffizienz, Vorhofflimmern bzw. -flattern bei WPW-Syndrom, bei bekannter Überempfindlichkeit gegenüber Verapamil sowie in den ersten sechs Monaten der Schwangerschaft. Die zusätzliche Einnahme von Betablockern (z. B. Bisoprolol) ist bei Einnahme von Verapamil kontraindiziert, da dies einen AV-Block verursachen kann.
Eine sorgfältige Überwachung ist bei AV-Block I. Grades, Hypotonie (systolisch < 90 mmHg), Bradykardie (Puls < 50 Schläge pro Minute), stark eingeschränkter Leberfunktion, Myasthenia gravis, Lambert-Eaton-Syndrom und fortgeschrittener Duchenne-Muskeldystrophie erforderlich.
Im letzten Drittel der Schwangerschaft darf Verapamil nur unter strenger Abwägung von Nutzen und Risiko eingesetzt werden. Da es in die Muttermilch übergeht, sollte es auch in der Stillzeit nicht eingenommen werden.
Grapefruitinhaltsstoffe können den Blutplasmaspiegel von Verapamil durch Hemmung des First-Pass-Effektes erhöhen, so dass vom Genuss dieser Früchte bei gleichzeitiger Verapamiltherapie abgeraten wird. Harntreibende Arzneimittel (Wassertabletten, Diuretika) verstärken den blutdrucksenkenden Effekt. Bei gleichzeitiger Anwendung von Verapamil und HMG-CoA-Reduktase-Hemmern (beispielsweise Simvastatin) in höheren Dosen ist das Risiko einer Myopathie/Rhabdomyolyse erhöht. Bei Rauchern wurden gegenüber Nichtrauchern um ca. 25 % reduzierte Verapamil-Blutplasmawerte festgestellt.[11]
Verapamil hat Wechselwirkungen mit vielen Medikamenten, weil es Cytochrom P450 3A4 und P-Glykoprotein hemmt. Es wird selbst über Cytochrom P450 3A4 abgebaut.
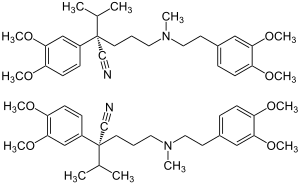
Stereoisomerie
[Bearbeiten | Quelltext bearbeiten]Verapamil ist chiral, enthält also ein Stereozentrum. Es gibt somit zwei Enantiomere, die (R)-Form, Dexverapamil,[S 2] und die (S)-Form.[S 3] Die Handelspräparate enthalten Verapamilhydrochlorid als Racemat (1:1-Gemisch der Enantiomere).[12]
Synthese
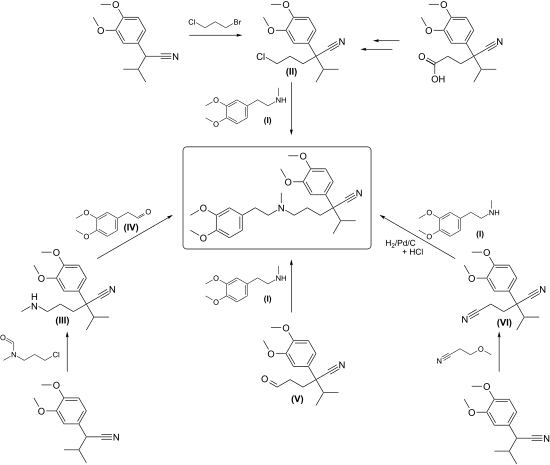
[Bearbeiten | Quelltext bearbeiten]Eine Zusammenfassung der Synthesen für Verapamil, ausgehend von 3,4-Dimethoxyphenylacetonitril[S 4] und 2-Chlorpropan, ist in einem Übersichtsartikel beschrieben.[13] Eine Vielzahl von Quellen steht für die Ausgangsmaterialien 3,4-Dimethoxyphenylacetonitril und N-Methylhomoveratrylamin[S 5] zur Verfügung. Zur Synthese der Endstufe Verapamil wird das in der Naturstoffsynthese bewährte Prinzip der konvergenten Synthese angewandt, d. h. zwei größere Bausteine werden zur Endstufe verknüpft. Die Kopplung der Bausteine erfolgt nach drei Strategien:
1.) N-Alkylierung von N-Methyl-homoveratrylamin der Formel (I) mit einem Alkylchlorid der Formel (II):
Dieser Weg wurde von den Erfindern[14] auch zur Synthese von chiralem Verapamil[15] angemeldet.
2.) Reduktive Alkylierung:
Patentanmeldungen für die Umsetzung vom 5-Methylaminovaleronitril-derivat der Formel (III) mit 3,4-Dimethoxy-phenylacetaldehyd der Formel (IV) wurden 1973[16] eingereicht, für N-Methyl-homoveratrylamin der Formel (I) mit einem Hexanal-Derivat der Formel (V) 1982[17] und für die Hydrierung eines Glutaronitrilderivats der Formel (VI), das über eine Cyanethylierung mit Methoxypropionitril gewonnen wird, in Gegenwart von Homoveratrylamin der Formel (I) 1984.[18]
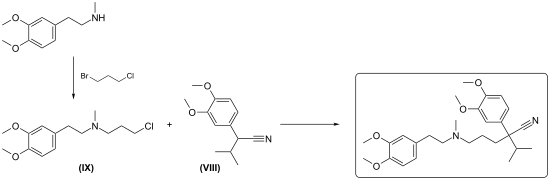
3.) Aufbau des quaternären Kohlenstoffatoms durch C-Alkylierung:
Hierzu werden starke Hilfsbasen benötigt. Isopropyl-homoveratronitril der Formel (VIII) wird durch 3-Chlorpropylamin der Formel (IX) in Gegenwart von Natriumamid alkyliert.[19] Unter Phasentransferkatalyse mit pulverisiertem Kaliumhydroxid soll die C-Alkylierung auch gelingen[20] .
Verbesserte Isolations- und Reinigungsmethoden wurden von zwei Arbeitskreisen 1993[21] und 2016[22] beansprucht.
Handelsnamen (Auswahl)
[Bearbeiten | Quelltext bearbeiten]Monopräparate
Isoptin (D, A, CH), Veragamma (D), Vera-Lich (D), Veramex (D), Veranorm (D), Verapabene (A), Verasal (D)[23]
- mit Trandolapril: Tarka (D, CH)
- mit Hydrochlorothiazid und Triamteren: Veratide (D)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Eintrag zu Verapamil. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. Mai 2014.
- ↑ a b The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage. 2006, ISBN 0-911910-00-X, S. 1710.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-518.
- ↑ a b Datenblatt (±)-Verapamil hydrochloride bei Sigma-Aldrich, abgerufen am 22. Oktober 2016 (PDF).
- ↑ Clusterkopfschmerz und trigeminoautonome Kopfschmerzen. In: Hans-Christoph Diener (Hrsg.): Leitlinien für Diagnostik und Therapie in der Neurologie. 4., überarb. Auflage. Herausgegeben von der Kommission „Leitlinien“ der Deutschen Gesellschaft für Neurologie. Georg Thieme Verlag, 2008, ISBN 978-3-13-132414-6, S. 567–572. Online-Version (PDF; 817 kB)
- ↑ Wolf-Dieter Müller-Jahncke, Christoph Friedrich, Ulrich Meyer: Arzneimittelgeschichte. 2., überarb. und erw. Auflage. Wiss. Verl.-Ges, Stuttgart 2005, ISBN 978-3-8047-2113-5, S. 172 f.
- ↑ Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. (1. Auflage 1986) 5. Auflage. Springer, Berlin/ Heidelberg/ New York u. a. 1999, ISBN 3-540-65024-5, S. 64 f.
- ↑ vergl. Deutsche Migräne- und Kopfschmerzgesellschaft
- ↑ Theodor Klotz, Michael J. Mathers, Frank Sommer: Induratio penis plastica – eine verschwiegene Erkrankung. In: Deutsches Ärzteblatt. 2. Februar 2007, S. A263-267, abgerufen am 19. Februar 2022.
- ↑ Rouslan Medov: Verapamil-Injektionen vs. ESWT in der Behandlung der IPP. (uni-frankfurt.de [abgerufen am 19. Februar 2022]).
- ↑ U. Fuhr, H. Müller-Peltzer, R. Kern u. a.: Effects of grapefruit juice and smoking on verapamil concentrations in steady state. In: Eur. J. Clin. Pharmacol. Band 58, Nr. 1, April 2002, S. 45–53, doi:10.1007/s00228-002-0436-7, PMID 11956673.(Free full text)
- ↑ Europäisches Arzneibuch, Deutscher Apotheker Verlag Stuttgart, 6. Ausgabe, 2008, S. 4298–4301, ISBN 978-3-7692-3962-1.
- ↑ Axel Kleemann, Jürgen Engel, Bernd Kutscher, Dietmar Reichert: Pharmaceutical Substances. 4. Auflage. 2 Bände. Thieme-Verlag, Stuttgart 2000, ISBN 1-58890-031-2; seit 2003 online mit halbjährlichen Ergänzungen und Aktualisierungen.
- ↑ DE1158083 (1963)[1]; Ferdinand Dengel (Knoll AG): Verfahren zur Herstellung basisch substituierter Phenylacetonitrile.
- ↑ DE2059923 (1972)[2]; Hans Jörg Trieber, Manfred Raschak Manfred, Ferdinand Dengel (Knoll AG): Optisch aktive, basisch substituierte Phenylacetonitrile.
- ↑ DE2263527 (1973)[3]; Kikuo Yasuda, Hiromu Mori, (Teikoku Hormone Manufg. Co., Ltd.): Alkylierung Phenylacetonitrile, Synthese Verapamil via Reduktive Alkylierung Amine.
- ↑ EP47888 (1982)[4]; Gerhard Kastner, Hardo Siegel, Karl Heinz Geiß (BASF AG): Phenylacetonitriles with basic substituents.
- ↑ EP165322 (1984) [5]; Lothar Kisielowski, Ingomar Grafe, Walter Liebenow, Kurt Henning Ahrens (Heumann Pharma): Verfahren zur Herstellung basisch substituierter Phenylacetonitrile
- ↑ DE1154810 (1963)[6]; Ferdinand Dengel (Knoll AG); Basisch substituierte Phenylacetonitrile.
- ↑ DE3121766 (1982)[7]; Werner Seitz, Klaus Scheib, Alfred Michel (BASF AG); Verfahren zur Herstellung basisch substituierter Phenylacetonitrile.
- ↑ PL162512 (1993)[8]; Chem. Abstr. 1995:328623; Hanna Klauze-Tomaszewska, Janina Szluker (Pabianickie Zaklady Farmaceutyczne „POLFA“, Polen); Method of isolating α-isopropyl-α-[(N-methyl-N-homoveratryl)-γ-aminopropyl]-3,4-dimethoxyphenylacetonitrile hydrochloride.
- ↑ WO 2016/181292 [9]; Dhileep Kumar Krishnamurthy, Millind Gharpure, Narender Rao Somisetti, Murali Rajappa, Rajshekkar Aareddy, Damodhar Kasireddy (Piramal Enterprises Ltd.): A process for the preparation of verapamil hydrochloride.
- ↑ ROTE LISTE 2017, Verlag Rote Liste Service GmbH, Frankfurt am Main, ISBN 978-3-946057-10-9, S. 225.
Anmerkungen
[Bearbeiten | Quelltext bearbeiten]- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Prenylamin: CAS-Nr.: 13822-06-5, PubChem: 166921, Wikidata: Q72439279.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Dexverapamil: CAS-Nr.: 38321-02-7, EG-Nr.: 253-878-4, ECHA-InfoCard: 100.048.963, PubChem: 65808, ChemSpider: 59223, DrugBank: DB14063, Wikidata: Q27147324.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu (S)-Verapamil: CAS-Nr.: 36622-29-4, EG-Nr.: 253-133-3, ECHA-InfoCard: 100.048.287, PubChem: 92305, ChemSpider: 83336, Wikidata: Q27147328.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 3,4-Dimethoxyphenylacetonitril: CAS-Nr.: 93-17-4, EG-Nr.: 202-225-1, ECHA-InfoCard: 100.002.024, GESTIS: 30500, PubChem: 66727, ChemSpider: 60093, Wikidata: Q27263471.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu N-Methylhomoveratrylamin: CAS-Nr.: 3490-06-0, EG-Nr.: 222-483-9, ECHA-InfoCard: 100.020.441, PubChem: 77039, ChemSpider: 69485, Wikidata: Q27262167.