Vicin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
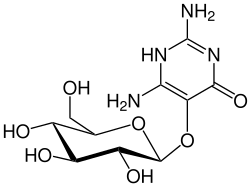
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Vicin | ||||||||||||||||||
| Andere Namen |
2,6-Diamino-5-(β-D-glucopyranosyloxy)pyrimidin-4(1H)-on | ||||||||||||||||||
| Summenformel | C10H16N4O7 | ||||||||||||||||||
| Kurzbeschreibung |
weißes Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 304,26 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt |
242–244 °C[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Vicin [2,4-Diamino-6-oxypyrimidin-5-(β-D-glucopyranosid)] ist ein Amino-Pyrimidinglykosid, das zusammen mit dem hydroxylierten Convicin u. a. in der Ackerbohne (Vicia faba) vorkommt.[2] Vicin und Convicin sind über ihre Aglycone Divicin und Isouramil giftig für Personen, die einen erblich bedingten Glucose-6-phosphat-Dehydrogenase-Mangel aufweisen. Diese können in Betroffenen eine hämolytische Anämie verursachen, den so genannten Favismus. Die natürliche Bildung von Vicin in Vicia faba konnte bisher nicht nachvollzogen werden.[3]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Vicin kommt in Ackerbohnen und in Saat-Platterbsen vor. Ackerbohnen sind insbesondere im Mittelmeer- und arabischen Raum als Delikatesse verbreitet, gewinnen aber insbesondere als Basis von Fleischersatzprodukten in Deutschland zunehmend an Verbreitung.[4]
Die Vicin-Konzentration von Ackerbohnen beträgt durchschnittlich 5 mg/g Trockengewicht. Durch in den Bohnen aktive Glucosidasen entsteht aus dem enthaltenen Vicin das Aglycon Divicin. Saat-Platterbsen werden in dürre- und hungeranfälligen Regionen Asiens und Ostafrikas häufig als "Versicherungspflanze" für den menschlichen Verzehr und als Viehfutter angebaut wird, wenn andere Pflanzen nicht gedeihen, obwohl die Gesundheitsrisiken des Verzehrs bekannt sind. Vicin bzw. Divicin sind zumindest teilweise für die Giftwirkung dieser Hülsenfrucht verantwortlich.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Vicin wurde erstmals im Jahr 1870 aus den Samen von Futterwicken isoliert, indem mit Schwefelsäure extrahiert und mit Quecksilbersulfat ausgefällt wurde. Später wurde Vicin auch in anderen Vicia-Arten wie Ackerbohnen und Erbsen-Wicken nachgewiesen, aber auch in anderen Arten wie Saat-Platterbsen. Die chemische Struktur der Verbindung wurde schrittweise ermittelt. Zunächst wurde 1896 die glykosidische Natur der Verbindung erkannt. Im selben Jahr wurde das Aglykon des Vicins, Divicin, isoliert. Zu Beginn des 20. Jahrhunderts wurde die Pyrimidinstruktur nachgewiesen. Trotz dieser anfänglichen Erfolge wurde die korrekte Formel von Vicin erst 1953 bestimmt.[3]
Metabolismus
[Bearbeiten | Quelltext bearbeiten]Vicin selbst ist im Körper inaktiv. Wird Vicin über die Nahrung aufgenommen, hydrolisiert die Darmmikroflora die β-glykosidische Bindung zwischen dem Glukoseteil und der Hydroxylgruppe am C5 des Pyrimidinrings. Dabei entsteht das hochreaktive, freie Radikale erzeugende Aglykon Divicin (2,6-Diamino-4,5-dihydroxypyrimidin).[3][5] Divicin weist ein hohes Oxidationspotential für Glutathion auf[6][7] und wird über das Darmepithel ins Blut und die Erythrozyten aufgenommen.[8][9] Divicin bzw. von diesem gebildete reaktive Sauerstoffspezies werden in den Erythrozyten von Glutathion reduziert. Glutathion wird durch das vom Enzym Glucose-6-Phosphat-Dehydrogenase bereitgestellte NADPH regeneriert.
Physiologische Wirkung beim Menschen
[Bearbeiten | Quelltext bearbeiten]Toxische Nebenwirkungen treten fast ausschließlich bei Menschen auf, die an einem Glucose-6-phosphat-Dehydrogenase-Mangel (G6PD-Mangel, Favismus) leiden. Dieser verursacht einen Mangel an Glutathion in den Erythrozyten, da Glutathion für die Neutralisierung der reaktiven Sauerstoffspezies benötigt wird, welche durch das stark reduzierende Divicin gebildet werden.[9] Personen mit G6PD-Mangel sind sehr häufig asymptomatisch. Allerdings können sehr plötzlich lebensbedrohliche Anfälle von akuter hämolytischer Anämie auftreten.[10] Anzeichen für solch einen plötzlichen Anfall von Favismus sind dunkler Urin, Blässe, Gelbsucht, Bauchschmerzen und in den meisten Fällen Fieber.[9]
Physiologische Wirkung bei Tieren
[Bearbeiten | Quelltext bearbeiten]Eine Diät mit 10 g Vicin/kg Körpergewicht bei Legehennen führte zu einer verringerten Futteraufnahme, einem geringeren Eigewicht, einem geringeren Hämoglobingehalt und einer geringeren Fruchtbarkeit sowie zu einer Erhöhung des Lebergewichts, des Leberglutathionspiegels und der Plasmalipidspiegel. Eine Ernährung mit vergleichbaren Vicinmengen pro kg Körpergewicht bei Schweinen zeigte nur geringe Auswirkungen auf die Verdauung von Proteinen und Kohlenhydraten.[11]
In einer anderen Studie wurden Lege- und Masthühner mit Körnern gefüttert, die unterschiedlich lange eingeweicht waren, wodurch das Vicin teilweise oder vollständig entfernt wurde. Hennen, die Körner erhalten hatten, in denen sich noch Vizin befand, wiesen einen signifikanten Rückgang des korpuskularen Hämoglobins auf, während dies bei der Vergleichsgruppe nicht der Fall war.[12]
Eine In-vivo-Studie an Ratten zeigte, dass die orale Verabreichung von Vicin nur zu einer geringen Verringerung der Glutathionkonzentration und zu keiner erhöhten Sterblichkeit führte. Die intraperitoneale-Verabreichung hingegen führte zu einem raschen Abfall des Glutathions, gefolgt vom Tod aufgrund von Anoxie.[13]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Cornell University: Vicin
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt Vicine bei Sigma-Aldrich, abgerufen am 15. Juni 2022 (PDF).
- ↑ Vincenzo Lattanzio, Vito V. Bianco, Giuseppie Crivelli, Vito Miccolis: Variability of Amino Acids, Protein, Vicine and Convicine in Vicia faba (L) Cultivars. In: Journal of Food Science. Band 48, Nr. 3, Mai 1983, S. 992–993, doi:10.1111/j.1365-2621.1983.tb14950.x (englisch).
- ↑ a b c Toxic constituents of plant foodstuffs. Academic Press, New York 1969, Favism, S. 293–312.
- ↑ deutschlandfunknova.de: Ackerbohne: Proteinreich, nachhaltig und unterschätzt. 22. September 2020.
- ↑ Carlo Giuseppe Rizzello, Ilario Losito, Laura Facchini, Kati Katina, Francesco Palmisano, Marco Gobbetti, Rossana Coda: Degradation of vicine, convicine and their aglycones during fermentation of faba bean flour. In: Scientific Reports. Band 6, Nr. 1, August 2016, S. 32452, doi:10.1038/srep32452, PMID 27578427, PMC 5006014 (freier Volltext).
- ↑ J. Mager, G. Glaser, A. Razin, G. Izak, S. Bien, M. Noam: Metabolic effects of pyrimidines derived from fava bean glycosides on human erythrocytes deficient in glucose-6-phosphate dehydrogenase. In: Biochemical and Biophysical Research Communications. Band 20, Nr. 2, Juli 1965, S. 235–240, doi:10.1016/0006-291x(65)90352-9, PMID 5850686.
- ↑ Carlo Giuseppe Rizzello, Ilario Losito, Laura Facchini, Kati Katina, Francesco Palmisano, Marco Gobbetti, Rossana Coda: Degradation of vicine, convicine and their aglycones during fermentation of faba bean flour. In: Scientific Reports. Band 6, Nr. 1, August 2016, S. 32452, doi:10.1038/srep32452, PMID 27578427, PMC 5006014 (freier Volltext).
- ↑ Margaret A. Baker, Amalia Bosia, Gianpiero Pescarmona, Franco Turrini, Paolo Arese: Mechanism of action of divicine in a cell-free system and in glucose-6-phosphate dehydrogenase-deficient red cells. In: Toxicologic Pathology. Band 12, Nr. 4, Juni 1984, S. 331–6, doi:10.1177/019262338401200405, PMID 6099911.
- ↑ a b c Lucio Luzzatto, Paolo Arese: Favism and Glucose-6-Phosphate Dehydrogenase Deficiency. In: The New England Journal of Medicine. Band 378, Nr. 1, Januar 2018, S. 60–71, doi:10.1056/NEJMra1708111, PMID 29298156.
- ↑ Marjo Pulkkinen, Xiao Zhou, Anna-Maija Lampi, Vieno Piironen: Determination and stability of divicine and isouramil produced by enzymatic hydrolysis of vicine and convicine of faba bean. In: Food Chemistry. Band 212, Dezember 2016, S. 10–19, doi:10.1016/j.foodchem.2016.05.077, PMID 27374500.
- ↑ D. Jezierny, R. Mosenthin, E. Bauer: The use of grain legumes as a protein source in pig nutrition: A review. In: Animal Feed Science and Technology. Band 157, Nr. 3-4, Mai 2010, S. 111–128, doi:10.1016/j.anifeedsci.2010.03.001.
- ↑ M. T. Farran, A. H. Darwish, M. G. Uwayjan, F. T. Sleiman, V. M. Ashkarian: Vicine and convicine in common vetch (Vicia sativa) seeds enhance beta-cyanoalanine toxicity in male broiler chicks. In: International Journal of Toxicology. Band 21, Nr. 3, Juni 2002, S. 201–209, doi:10.1080/10915810290096333, PMID 12055021.
- ↑ Mahmoud S. Arbid, Khaled M. M. Koriem, Gihan F. Asaad, Hoda A. Megahed: Effect of the antibiotic neomycin on the toxicity of the glycoside vicine in rats. In: Journal of Toxicology. Band 2013, 2013, S. e913128, doi:10.1155/2013/913128, PMID 23840205, PMC 3694484 (freier Volltext).
