Αντίδραση αφυδάτωσης
Στη χημεία, η αντίδραση αφυδάτωσης είναι χημική αντίδραση που περιλαμβάνει την απώλεια νερού από το μόριο ή το ιόν που αντιδρά. Οι αντιδράσεις αφυδάτωσης είναι κοινές διεργασίες, το αντίστροφο από μια αντίδραση ενυδάτωσης.
Αντιδράσεις αφυδάτωσης στην οργανική χημεία
[Επεξεργασία | επεξεργασία κώδικα]Εστεροποίηση
[Επεξεργασία | επεξεργασία κώδικα]Το κλασικό παράδειγμα μιας αντίδρασης αφυδάτωσης είναι η εστεροποίηση Fischer, η οποία περιλαμβάνει την επεξεργασία ενός καρβοξυλικού οξέος με μια αλκοόλη για να δώσει έναν εστέρα
- RCO2H + R′OH
 RCO2R′ + H2O
RCO2R′ + H2O
Συχνά, τέτοιες αντιδράσεις απαιτούν την παρουσία ενός παράγοντα αφυδάτωσης, δηλαδή μιας ουσίας που αντιδρά με το νερό.
Αιθεροποίηση
[Επεξεργασία | επεξεργασία κώδικα]Δύο μονοσακχαρίτες, όπως γλυκόζη και φρουκτόζη, μπορούν να ενωθούν μεταξύ τους (για να σχηματίσουν σακχαρόζη) χρησιμοποιώντας σύνθεση αφυδάτωσης. Το νέο μόριο, που αποτελείται από δύο μονοσακχαρίτες, ονομάζεται δισακχαρίτης.
Σχηματισμός νιτριλίου
[Επεξεργασία | επεξεργασία κώδικα]Τα νιτρίλια παρασκευάζονται συχνά με αφυδάτωση των πρωτογενών αμιδίων.
- RC(O)NH2 → RCN + H2O
Σχηματισμός κετένης
[Επεξεργασία | επεξεργασία κώδικα]Κετένη παράγεται με θέρμανση οξικού οξέος και παγίδευση του προϊόντος:[1]
- CH3CO2H → CH2=C=O + H2O
Σχηματισμός αλκενίου
[Επεξεργασία | επεξεργασία κώδικα]Τα αλκένια μπορούν να παραχθούν από αλκοόλες με αφυδάτωση. Αυτή η μετατροπή, μεταξύ άλλων, χρησιμοποιείται για τη μετατροπή της βιομάζας σε υγρά καύσιμα.[2] Η μετατροπή της αιθανόλης σε αιθυλένιο είναι ένα θεμελιώδες παράδειγμα:[3][4]
- CH3CH2OH → H2C=CH2 + H2O
Η αντίδραση επιταχύνεται από όξινους καταλύτες όπως θειικό οξύ και ορισμένοι ζεόλιθοι. Αυτές οι αντιδράσεις προχωρούν συχνά μέσω ενδιάμεσων καρβοκατιόντων όπως φαίνεται για την αφυδάτωση της κυκλοεξανόλης.[5]
Ορισμένες αλκοόλες είναι επιρρεπείς σε αφυδάτωση. Τα 3-υδροξυκαρβονύλια, που ονομάζονται αλδόλες, απελευθερώνουν νερό όταν παραμείνουν σε θερμοκρασία δωματίου:
- RC(O)CH2CH(OH)R' → RC(O)CH=CHR' + H2O
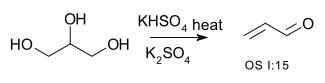
Η αντίδραση προκαλείται από αντιδραστήρια αφυδάτωσης. Για παράδειγμα, η 2-μεθυλ-κυκλοεξαν-1-όλη αφυδατώνεται σε 1-μεθυλκυκλοεξένιο παρουσία σουλφουρανίου του Martin (Martin's sulfurane), το οποίο αντιδρά μη αναστρέψιμα με το νερό.[6][7] Η διπλή αφυδάτωση απεικονίζεται με τη μετατροπή της γλυκερόλης σε ακρολεΐνη:[8][9]
Αντιδράσεις αφυδάτωσης στην ανόργανη χημεία
[Επεξεργασία | επεξεργασία κώδικα]Ο σχηματισμός του πυροφωσφορικού δεσμού είναι μια σημαντική αφυδάτωση που σχετίζεται με τη βιοενεργητική. Διάφορα υλικά κατασκευής παράγονται από την αφυδάτωση. Ο γύψος του Παρισιού παράγεται με αφυδάτωση γύψου σε κλίβανο:[10][11]
- heat (απελευθερώνεται ως ατμός).
Η προκύπτουσα ξηρή σκόνη είναι έτοιμη να αναμιχθεί με νερό για να σχηματιστεί μια σκληρή αλλά εύπλαστη πάστα που σκληραίνει.
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Miller, Raimund; Abaecherli, Claudio; Said, Adel; Jackson, Barry (2001). «Ullmann's Encyclopedia of Industrial Chemistry». Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:. ISBN 978-3527306732.
- ↑ Besson, Michèle; Gallezot, Pierre; Pinel, Catherine (2014-02-12). «Conversion of Biomass into Chemicals over Metal Catalysts» (στα αγγλικά). Chemical Reviews 114 (3): 1827–1870. doi:. ISSN 0009-2665. PMID 24083630. https://pubs.acs.org/doi/10.1021/cr4002269.
- ↑ Zimmermann, Heinz· Walz, Roland (2008). «Ethylene». Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a10_045.pub3. ISBN 978-3527306732.
- ↑ Zhang, Minhua; Yu, Yingzhe (2013-07-17). «Dehydration of Ethanol to Ethylene» (στα αγγλικά). Industrial & Engineering Chemistry Research 52 (28): 9505–9514. doi:. ISSN 0888-5885. https://pubs.acs.org/doi/10.1021/ie401157c.
- ↑ G. H. Coleman, H. F. Johnstone (1925). «Cyclohexene». Organic Syntheses 5: 33. doi:.
- ↑ J. Brent Friesen; Robert Schretzman (2011). «Dehydration of 2-Methyl-1-cyclohexanol: New Findings from a Popular Undergraduate Laboratory Experiment». J. Chem. Educ. 88 (8): 1141–1147. doi:. Bibcode: 2011JChEd..88.1141F.
- ↑ Roden, Brian A. (2001). «Diphenylbis(1,1,1,3,3,3-hexafluoro-2-phenyl-2-propoxy)sulfurane». Encyclopedia of Reagents for Organic Synthesis. doi:. ISBN 0471936235.
- ↑ H. Adkins; W. H. Hartung (1926), «Acrolein», Org. Synth. 6: 1, doi:
- ↑ Katryniok, Benjamin; Paul, Sébastien; Bellière-Baca, Virginie; Rey, Patrick; Dumeignil, Franck (2010). «Glycerol dehydration to acrolein in the context of new uses of glycerol» (στα αγγλικά). Green Chemistry 12 (12): 2079. doi:. ISSN 1463-9262. http://xlink.rsc.org/?DOI=c0gc00307g.
- ↑ Franz Wirsching "Calcium Sulfate" in Ullmann's Encyclopedia of Industrial Chemistry, 2012 Wiley-VCH, Weinheim.
- ↑ Staff. «CaSO4, ½ H2O». LaFargePrestia. Αρχειοθετήθηκε από το πρωτότυπο στις 20 Νοεμβρίου 2008. Ανακτήθηκε στις 27 Νοεμβρίου 2008.