Κενομπαμάτη
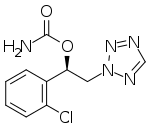 Η χημική δομή της κενομπαμάτης | |
| Ονομασία IUPAC | |
|---|---|
[(1R)-1-(2-chlorophenyl)-2-(tetrazol-2-yl)ethyl] carbamate | |
| Κλινικά δεδομένα | |
| Εμπορικές ονομασίες | Xcopri, Ontozry |
| AHFS/Drugs.com | Μονογραφία |
| MedlinePlus | a620021 |
| Δεδομένα άδειας |
|
| Οδοί χορήγησης | Από του στόματος χρήση |
| Κυκλοφορία | |
| Κυκλοφορία | |
| Φαρμακοκινητική | |
| Βιοδιαθεσιμότητα | ≥88% |
| Πρωτεϊνική σύνδεση | 60% |
| Μεταβολισμός | Γλυκουρονιδίωση μεσω του UGT2B7 |
| Βιολογικός χρόνος ημιζωής | 50–60 ώρες |
| Απέκκριση | Ούρα (87.8%) Κόπρανα (5.2%) |
| Κωδικοί | |
| Αριθμός CAS | 913088-80-9 |
| Κωδικός ATC | N03AX25 |
| PubChem | CID 11962412 |
| DrugBank | DB06119 |
| ChemSpider | 10136642 |
| UNII | P85X70RZWS |
| KEGG | D11150 |
| ChEMBL | CHEMBL3989949 |
| Συνώνυμα | YKP3089 |
| Χημικά στοιχεία | |
| Χημικός τύπος | C10H10ClN5O2 |
| Μοριακή μάζα | 267,67 g·mol−1 |
C1=CC=C(C(=C1)C(CN2N=CN=N2)OC(=O)N)Cl | |
InChI=1S/C10H10ClN5O2/c11-8-4-2-1-3-7(8)9(18-10(12)17)5-16-14-6-13-15-16/h1-4,6,9H,5H2,(H2,12,17)/t9-/m0/s1 Key:GFHAXPJGXSQLPT-VIFPVBQESA-N | |
Η κενομπαμάτη, που πωλείται με τις εμπορικές ονομασίες Xcopri (ΗΠΑ) και Ontozry (ΕΕ), είναι ένα φάρμακο που χρησιμοποιείται για τη θεραπεία επιληπτικών κρίσεων εστιακής έναρξης, ενός είδους επιληψίας, σε ενήλικες. Λαμβάνεται από το στόμα . [6] [7]
Η κενομπαμάτη εγκρίθηκε για ιατρική χρήση στις Ηνωμένες Πολιτείες τον Νοέμβριο του 2019 [6] [7] [8] και τοποθετήθηκε στο Παράρτημα V του νόμου περί ελεγχόμενων ουσιών τον Μάρτιο του 2020. [9] Η κενομπαμάτη εγκρίθηκε για ιατρική χρήση στην Ευρωπαϊκή Ένωση τον Μάρτιο του 2021.
Ενδείξεις
[Επεξεργασία | επεξεργασία κώδικα]Στις Ηνωμένες Πολιτείες, η κενομπαμάτη ενδείκνυται για τη θεραπεία επιληπτικών κρίσεων εστιακής έναρξης με ή χωρίς δευτερογενή γενίκευση.
Στην Ευρωπαϊκή Ένωση, ενδείκνυται για τη συμπληρωματική θεραπεία των επιληπτικών κρίσεων με ή χωρίς δευτερογενή γενίκευση σε ενήλικες με επιληψία που δεν έχουν ελεγχθεί επαρκώς, παρά το ιστορικό θεραπείας με τουλάχιστον δύο αντιεπιληπτικά φάρμακα.
Αντενδείξεις
[Επεξεργασία | επεξεργασία κώδικα]Η κενομπαμάτη μειώνει το διάστημα QT του καρδιακού ρυθμού. Επομένως, αντενδείκνυται σε άτομα με οικογενές σύνδρομο βραχύ QT, μια πολύ σπάνια ασθένεια του ηλεκτρικού συστήματος της καρδιάς. [10] [11]
Ανεπιθύμητες ενέργειες
[Επεξεργασία | επεξεργασία κώδικα]Οι πιο συχνές ανεπιθύμητες ενέργειες είναι η υπνηλία (στο 37% των ατόμων που λαμβάνουν το φάρμακο), η ζάλη (33%) και η κόπωση (24%). Διαταραχές όρασης, πονοκέφαλος και αυξημένα επίπεδα καλίου στο αίμα (πάνω από 5 mmol/L ) είναι επίσης κοινές. [10] Υπερευαισθησία εμφανίζεται σε λιγότερο από 1% των ασθενών, φαρμακευτική αντίδραση με ηωσινοφιλία και συστηματικά συμπτώματα (DRESS) σε λιγότερο από 0,1%. [11]
Υπερβολική δόση
[Επεξεργασία | επεξεργασία κώδικα]Υπάρχουν λίγα δεδομένα σχετικά με την υπερδοσολογία με κενομπαμάτη. Αναμένεται ότι θα εμφανιστούν οι περιγραφόμενες ανεπιθύμητες ενέργειες όπως υπνηλία, ζάλη και κόπωση, καθώς και πιθανώς προβλήματα με τον καρδιακό ρυθμό. Δεν υπάρχει ειδικό αντίδοτο . [10] [11]
Αλληλεπιδράσεις
[Επεξεργασία | επεξεργασία κώδικα]Η χρήση της κενομπαμάτης μαζί με άλλα κατασταλτικά του κεντρικού νευρικού συστήματος, όπως τα βαρβιτουρικά, οι βενζοδιαζεπίνες ή το αλκοόλ μπορεί να οδηγήσει σε αυξημένη υπνηλία και άλλα συμπτώματα του κεντρικού νευρικού συστήματος . [10] [11]
Η κενομπαμάτη επάγει τα ένζυμα CYP3A4 και CYP2B6 και ως εκ τούτου μπορεί να μειώσει τις συγκεντρώσεις φαρμάκων στο αίμα που μεταβολίζονται από αυτά τα ένζυμα (για παράδειγμα μιδαζολάμη και βουπροπιόνη, αντίστοιχα). Αντίστροφα, αναστέλλει το ένζυμο CYP2C19, αυξάνοντας δυνητικά τις συγκεντρώσεις των φαρμάκων που μεταβολίζονται από αυτό το ένζυμο (για παράδειγμα ομεπραζόλη ). [10] [11]
Φαρμακολογία
[Επεξεργασία | επεξεργασία κώδικα]Μηχανισμός δράσης
[Επεξεργασία | επεξεργασία κώδικα]Η κενομπαμάτη είναι ένας αναστολέας διαύλων νατρίου (VGSC) με πύλη τάσης . [12] Είναι ένας εκλεκτικός αναστολέας της αδρανοποιημένης κατάστασης των VGSCs, αναστέλλοντας κατά προτίμηση το επίμονο ρεύμα νατρίου. [12] Έχει προταθεί ότι η κενομπαμάτη ενισχύει επιπλέον την προσυναπτική απελευθέρωση του γ-αμινοβουτυρικού οξέος (GABA), αυξάνοντας έτσι την ανασταλτική νευροδιαβίβαση GABA . [12]
Φαρμακοκινητική
[Επεξεργασία | επεξεργασία κώδικα]Η κενομπαμάτη απορροφάται από το έντερο σε τουλάχιστον 88% και φθάνει τις υψηλότερες συγκεντρώσεις στο πλάσμα του αίματος μετά από μία έως τέσσερις ώρες. Όταν βρίσκεται στην κυκλοφορία του αίματος, το 60% της ουσίας συνδέεται με τις πρωτεΐνες του πλάσματος, κυρίως με τη λευκωματίνη . Το Cenobamate απενεργοποιείται κυρίως με γλυκουρονιδίωση μέσω του ενζύμου UGT2B7 και σε μικρότερο βαθμό UGT2B4 . Τα ένζυμα CYP2E1, CYP2A6, CYP2B6, CYP2C19 και CYP3A4 παίζουν μικρότερο ρόλο στο μεταβολισμό του φαρμάκου. [11]
Οι συνθήκες σταθερής κατάστασης επιτυγχάνονται μετά από 14 ημέρες.Η κενομπαμάτη και οι μεταβολίτες της αποβάλλονται κυρίως μέσω των ούρων και μόνο σε ποσοστό 5,2% μέσω των κοπράνων. Ο τελικός χρόνος ημιζωής είναι 50 έως 60 ώρες. [11]
Ιστορία
[Επεξεργασία | επεξεργασία κώδικα]Η ασφάλεια και η αποτελεσματικότητα της κενομπαμάτης για τη θεραπεία επιληπτικών κρίσεων εστιακής έναρξης τεκμηριώθηκε σε δύο τυχαιοποιημένες, διπλές τυφλές, ελεγχόμενες με εικονικό φάρμακο μελέτες στις οποίες συμμετείχαν 655 ενήλικες. Σε αυτές τις μελέτες, οι ασθενείς είχαν επιληπτικές κρίσεις εστιακής έναρξης με ή χωρίς δευτερογενή γενίκευση κατά μέσο όρο για περίπου 24 χρόνια και διάμεση συχνότητα κρίσεων 8,5 κρίσεις ανά 28 ημέρες κατά τη διάρκεια μιας βασικής περιόδου 8 εβδομάδων. Κατά τη διάρκεια των δοκιμών, δόσεις των 100, 200 και 400 χιλιοστόγραμμων (mg) ημερησίως μείωσαν τον αριθμό των κρίσεων ανά 28 ημέρες σε σύγκριση με την ομάδα του εικονικού φαρμάκου. [6]
Κοινωνία και πολιτισμός
[Επεξεργασία | επεξεργασία κώδικα]Νομική υπόσταση
[Επεξεργασία | επεξεργασία κώδικα]Ο Οργανισμός Τροφίμων και Φαρμάκων των ΗΠΑ (FDA) ενέκρινε τη κενομπαμάτη τον Νοέμβριο του 2019 και ενέκρινε την αίτηση του Xcopri της SK Life Science Inc. [6] [7] [8] [13]
Στις 28 Ιανουαρίου 2021, η Επιτροπή Φαρμάκων για Ανθρώπινη Χρήση (CHMP) του Ευρωπαϊκού Οργανισμού Φαρμάκων (EMA) εξέδωσε θετική γνώμη, προτείνοντας τη χορήγηση άδειας κυκλοφορίας. [14] Ο αιτών για αυτό το φαρμακευτικό προϊόν είναι η Arvelle Therapeutics Netherlands BV [14] Το Ontozry εγκρίθηκε στις 26 Μαρτίου 2021. [15]
βιβλιογραφικές αναφορές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ «Notice: Multiple additions to the Prescription Drug List (PDL) [2023-08-30]». Health Canada. 26 Οκτωβρίου 2023. Ανακτήθηκε στις 3 Ιανουαρίου 2024.
- ↑ «Ontozry EPAR». European Medicines Agency (EMA). 25 Ιανουαρίου 2021. Ανακτήθηκε στις 4 Ιουνίου 2021. Text was copied from this source which is © European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- ↑ «Ontozry Product information». Union Register of medicinal products. Ανακτήθηκε στις 3 Μαρτίου 2023.
- ↑ «Xcopri Titration Pack- cenobamate kit Xcopri- cenobamate tablet, film coated Xcopri Maintenance Pack- cenobamate kit». DailyMed. Ανακτήθηκε στις 1 Φεβρουαρίου 2021.
- ↑ «Schedules of Controlled Substances: Placement of Cenobamate in Schedule V». Federal Register. 10 Μαρτίου 2020.
- ↑ 6,0 6,1 6,2 6,3 (21 November 2019). FDA approves new treatment for adults with partial-onset seizures. Δελτίο τύπου.
- ↑ 7,0 7,1 7,2 «Drug Trials Snapshots: Xcopri». U.S. Food and Drug Administration (FDA). 3 Δεκεμβρίου 2019. Αρχειοθετήθηκε από το πρωτότυπο στις 19 Δεκεμβρίου 2019. Ανακτήθηκε στις 18 Δεκεμβρίου 2019.
- ↑ 8,0 8,1 «Drug Approval Package: Xcopri». U.S. Food and Drug Administration (FDA). 10 Δεκεμβρίου 2019. Αρχειοθετήθηκε από το πρωτότυπο στις 19 Δεκεμβρίου 2019. Ανακτήθηκε στις 18 Δεκεμβρίου 2019.
- ↑ «2020 - Placement of Cenobamate in Schedule V». DEA Diversion Control Division. 10 Μαρτίου 2020. Αρχειοθετήθηκε από το πρωτότυπο στις 19 Απριλίου 2020. Ανακτήθηκε στις 11 Μαρτίου 2020.
- ↑ 10,0 10,1 10,2 10,3 10,4 Xcopri FDA Professional Drug Information.
- ↑ 11,0 11,1 11,2 11,3 11,4 11,5 11,6 «Ontozry: EPAR – Product information» (PDF). European Medicines Agency. 2 Ιουνίου 2021.
- ↑ 12,0 12,1 12,2 «A resurging boom in new drugs for epilepsy and brain disorders». Expert Review of Clinical Pharmacology 11 (1): 27–45. January 2018. doi:. PMID 28956955.
- ↑ «Cenobamate FDA Approval Status». Drugs.com. 13 Νοεμβρίου 2019. Ανακτήθηκε στις 22 Νοεμβρίου 2019.
- ↑ 14,0 14,1 «Ontozry: Pending EC decision». European Medicines Agency (EMA). 29 Ιανουαρίου 2021. Αρχειοθετήθηκε από το πρωτότυπο στις 1 Φεβρουαρίου 2021. Ανακτήθηκε στις 1 Φεβρουαρίου 2021.
- ↑ «Ontozry». Union Register of medicinal products. Ανακτήθηκε στις 3 Αυγούστου 2021.