Μεθυλφαινιδάτη
 | |
 | |
| Ονομασία IUPAC | |
|---|---|
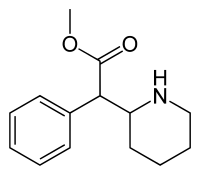
Methyl phenyl(piperidin-2-yl)acetate | |
| Κλινικά δεδομένα | |
| Εμπορικές ονομασίες | Ritalin, Concerta, άλλες |
| AHFS/Drugs.com | monograph |
| MedlinePlus | a682188 |
| Δεδομένα άδειας |
|
| Κατηγορία ασφαλείας κύησης | |
| Πιθανότητα εξάρτησης | Υψηλή[1] |
| Πιθανότητα εθισμού | Υψηλή[2] |
| Οδοί χορήγησης | Από το στόμα, διαδερμικά[1] |
| Κυκλοφορία | |
| Κυκλοφορία |
|
| Φαρμακοκινητική | |
| Βιοδιαθεσιμότητα | Περίπου 30% (εύρος: 11–52%) |
| Πρωτεϊνική σύνδεση | 10–33% |
| Μεταβολισμός | Ήπαρ (80%) κυρίως μέσω της CES1A1 |
| Βιολογικός χρόνος ημιζωής | 2–3 ώρες[3] |
| Απέκκριση | Ούρα (90%) |
| Κωδικοί | |
| Αριθμός CAS | 113-45-1 |
| Κωδικός ATC | N06BA04 |
| PubChem | CID 4158 |
| IUPHAR/BPS | 7236 |
| DrugBank | DB00422 |
| ChemSpider | 4015 |
| UNII | 207ZZ9QZ49 |
| KEGG | D04999 |
| ChEBI | CHEBI:6887 |
| ChEMBL | CHEMBL796 |
| Χημικά στοιχεία | |
| Χημικός τύπος | C14H19NO2 |
| Μοριακή μάζα | 233.31 |
O=C(OC)C(C1CCCCN1)C2=CC=CC=C2 | |
InChI=1S/C14H19NO2/c1-17-14(16)13(11-7-3-2-4-8-11)12-9-5-6-10-15-12/h2-4,7-8,12-13,15H,5-6,9-10H2,1H3 Key:DUGOZIWVEXMGBE-UHFFFAOYSA-N | |
| Φυσικά στοιχεία | |
| Σημείο τήξης | 74 °C (165 °F) [4] |
| Σημείο βρασμού | 136 °C (277 °F) [4] |
| (verify) | |
Η μεθυλφαινιδάτη, συντομογραφία MP ή MPH, που πωλείται με την εμπορική ονομασία Ritalin μεταξύ άλλων, είναι διεγερτικό φάρμακο που χρησιμοποιείται για τη θεραπεία της διαταραχής υπερκινητικότητας έλλειψης προσοχής (ΔΕΠΥ) και της ναρκοληψίας.[1] Είναι φάρμακο πρώτης γραμμής για τη ΔΕΠΥ. Μπορεί να ληφθεί από το στόμα ή να εφαρμοστεί στο δέρμα, και διαφορετικά σκευάσματα έχουν διαφορετικούς χρόνους δράσης.[1]
Οι συχνές παρενέργειες της μεθυλφαινιδάτης περιλαμβάνουν δυσκολία στον ύπνο, μειωμένη όρεξη, άγχος και απώλεια βάρους.[1] Πιο σοβαρές παρενέργειες μπορεί να περιλαμβάνουν ψύχωση, αλλεργικές αντιδράσεις, παρατεταμένες στύσεις, κατάχρηση ουσιών και καρδιακά προβλήματα. Η μεθυλφαινιδάτη πιστεύεται ότι δρα αναστέλλοντας την επαναπρόσληψη της ντοπαμίνης και της νορεπινεφρίνης από τους νευρώνες.[5][6] Η μεθυλφαινιδάτη είναι διεγερτικό του κεντρικού νευρικού συστήματος (ΚΝΣ) των τάξεων φαιναιθυλαμίνης και πιπεριδίνης.[7]
Η μεθυλφαινιδάτη κατασκευάστηκε για πρώτη φορά το 1944 και εγκρίθηκε για ιατρική χρήση στις Ηνωμένες Πολιτείες το 1955.[1][8] Αρχικά πωλήθηκε από την ελβετική εταιρεία CIBA, τώρα Novartis Corporation. Εκτιμάται όσον αφορά το 2013, 2,4 δισεκατομμύρια δόσεις μεθυλφαινιδάτης ελήφθησαν παγκοσμίως.[9] Το 2017, ήταν το 47ο πιο συχνά συνταγογραφούμενο φάρμακο στις Ηνωμένες Πολιτείες, με περισσότερες από 16 εκατομμύρια συνταγές.[10][11] Διατίθεται ως γενόσημο φάρμακο.
Χρήσεις
[Επεξεργασία | επεξεργασία κώδικα]Η μεθυλφαινιδάτη χρησιμοποιείται συχνότερα για τη θεραπεία της ΔΕΠΥ και της ναρκοληψίας.[12]
Διαταραχή ελλειμματικής προσοχής - υπερκινητικότητας
[Επεξεργασία | επεξεργασία κώδικα]Η μεθυλφαινιδάτη χρησιμοποιείται για τη θεραπεία της διαταραχής ελλειματικής προσοχής και υπερκινητικότητας.[13] Η προσθήκη θεραπείας τροποποίησης συμπεριφοράς μπορεί να έχει επιπλέον οφέλη στο αποτέλεσμα της θεραπείας.[14][15] Η δοσολογία μπορεί να ποικίλει και τιτλοδοτείται ως αποτέλεσμα.[16][17]
Τα βραχυπρόθεσμα οφέλη και η σχέση κόστους-αποτελεσματικότητας της μεθυλφαινιδάτης είναι καθιερωμένα.[18][19] Ορισμένες έρευνες έχουν αποδείξει την ασφάλεια και την αποτελεσματικότητα των διεγερτικών για άτομα με ΔΕΠΥ για αρκετά χρόνια.[20][21][22] Μια ανασκόπηση του 2018 βρήκε προσωρινά στοιχεία ότι μπορεί να προκαλέσει σοβαρές και μη παρενέργειες στα παιδιά.[23] Το ακριβές μέγεθος των βελτιώσεων στα συμπτώματα της ΔΕΠΥ και στην ποιότητα ζωής που οφείλονται στη θεραπεία με μεθυλφαινιδάτη παραμένει αβέβαιο όσον αφορά τον Νοέμβριο του 2015.[24] Ο Παγκόσμιος Οργανισμός Υγείας, ωστόσο, δεν πρόσθεσε τη μεθυλφαινιδάτη στη λίστα βασικών φαρμάκων του, καθώς βρήκαν ότι τα στοιχεία για τα οφέλη έναντι των βλαβών είναι ασαφή στην ΔΕΠΥ.[25]
Κατά προσέγγιση το 70% αυτών που χρησιμοποιούν μεθυλφαινιδάτη βλέπουν βελτιώσεις στα συμπτώματα της ΔΕΠΥ.[26] Τα παιδιά με ΔΕΠΥ που χρησιμοποιούν διεγερτικά φάρμακα έχουν γενικά καλύτερες σχέσεις με τους συνομηλίκους και τα μέλη της οικογένειάς τους, έχουν καλύτερη απόδοση στο σχολείο, αποσπούνται λιγότερο και είναι λιγότερο παρορμητικά και έχουν μεγαλύτερη προσοχή.[20][27] Τα άτομα με ΔΕΠΥ έχουν αυξημένο κίνδυνο διαταραχών χρήσης ουσιών χωρίς θεραπεία και τα διεγερτικά φάρμακα μειώνουν αυτόν τον κίνδυνο.[28][29] Ορισμένες μελέτες δείχνουν ότι δεδομένου ότι η διάγνωση ΔΕΠΥ αυξάνεται σημαντικά σε όλο τον κόσμο, η χρήση του φαρμάκου μπορεί να προκαλέσει περισσότερη βλάβη παρά όφελος σε ορισμένους πληθυσμούς που χρησιμοποιούν τη μεθυλφαινιδάτη ως «φάρμακο μελέτης».[30] Αυτό ισχύει για άτομα που ενδέχεται να αντιμετωπίζουν διαφορετικό πρόβλημα και έχουν εσφαλμένη διάγνωση με ΔΕΠΥ. Τα άτομα αυτής της κατηγορίας μπορούν στη συνέχεια να παρουσιάσουν αρνητικές παρενέργειες του φαρμάκου που επιδεινώνουν την κατάστασή τους και δυσκολεύουν να λάβουν επαρκή φροντίδα, καθώς οι πάροχοι γύρω τους μπορεί να πιστεύουν ότι τα φάρμακα είναι επαρκή και το πρόβλημα βρίσκεται στον χρήστη. Η μεθυλφαινιδάτη δεν έχει εγκριθεί για παιδιά κάτω των έξι ετών.[31][32] Η μεθυλφαινιδάτη άμεσης απελευθέρωσης χρησιμοποιείται καθημερινά μαζί με τη μορφή μακράς δράσης για την επίτευξη πλήρους ολοήμερου ελέγχου των συμπτωμάτων[17][33] :722
Ναρκοληψία
[Επεξεργασία | επεξεργασία κώδικα]Η ναρκοληψία, μια χρόνια διαταραχή του ύπνου που χαρακτηρίζεται από υπερβολική υπνηλία κατά τη διάρκεια της ημέρας και ανεξέλεγκτο ύπνο, αντιμετωπίζεται κυρίως με διεγερτικά. Η μεθυλφαινιδάτη θεωρείται αποτελεσματική στην αύξηση της εγρήγορσης, της επαγρύπνησης και της απόδοσης.[34] Η μεθυλφαινιδάτη βελτιώνει την υπνηλία σε τυποποιημένες δοκιμασίες, όπως το πολλαπλό τεστ καθυστέρησης ύπνου (MSLT), αλλά η απόδοση δεν βελτιώνεται σε επίπεδα συγκρίσιμα με υγιή άτομα.[35]
Άλλες ιατρικές χρήσεις
[Επεξεργασία | επεξεργασία κώδικα]Η μεθυλφαινιδάτη μπορεί επίσης να συνταγογραφηθεί για χρήση εκτός ετικέτας σε ανθεκτικές στη θεραπεία περιπτώσεις διπολικής διαταραχής και μείζονος καταθλιπτικής διαταραχής.[36] Μπορεί επίσης να βελτιώσει την κατάθλιψη σε πολλές ομάδες, συμπεριλαμβανομένων των ασθενών με εγκεφαλικό επεισόδιο, καρκίνο και HIV.[37] Ωστόσο, η χρήση διεγερτικών όπως η μεθυλφαινιδάτη σε περιπτώσεις κατάθλιψης ανθεκτικής στη θεραπεία είναι αμφιλεγόμενη.[38] Τα διεγερτικά μπορεί να έχουν λιγότερες παρενέργειες από τα τρικυκλικά αντικαταθλιπτικά σε ηλικιωμένους και ιατρικά άρρωστους.[39] Σε άτομα με τελικού σταδίου καρκίνο, η μεθυλφαινιδάτη μπορεί να χρησιμοποιηθεί για την αντιμετώπιση της υπνηλίας που προκαλείται από οπιοειδή, για την αύξηση των αναλγητικών επιδράσεων των οπιοειδών, για τη θεραπεία της κατάθλιψης και για τη βελτίωση της γνωστικής λειτουργίας.[40] Μια ανασκόπηση του 2018 βρήκε στοιχεία χαμηλής ποιότητας που υποστηρίζουν τη χρήση του για τη θεραπεία της απάθειας όπως εκδηλώνεται στη νόσο του Αλτσχάιμερ, εκτός από τα ελαφρά οφέλη στη διανόηση και τη γνωστική απόδοση.[41]
Βελτίωση απόδοσης
[Επεξεργασία | επεξεργασία κώδικα]Μια ανασκόπηση του 2015 διαπίστωσε ότι οι θεραπευτικές δόσεις αμφεταμίνης και μεθυλφαινιδάτης οδηγούν σε μέτριες βελτιώσεις στις γνωστικές λειτουργίας, συμπεριλαμβανομένης της μνήμης εργασίας, της επεισοδιακής μνήμης και του ανασταλτικού ελέγχου, σε φυσιολογικούς υγιείς ενήλικες.[42][43] Οι επιδράσεις ενίσχυσης των γνωσιακών λειτουργιών αυτών των φαρμάκων είναι γνωστό ότι λαμβάνουν χώρα δια της έμμεσης ενεργοποίησης τόσο του υποδοχέα ντοπαμίνης D1 και του αδρενεργικού α2 υποδοχέα στον προμετωπιαίο φλοιό. Η μεθυλφαινιδάτη και άλλα διεγερτικά στη ΔΕΠΥ βελτιώνουν επίσης την αίσθηση της εργασίας και αυξάνουν την διέγερση.[44] Τα διεγερτικά όπως η αμφεταμίνη και η μεθυλφαινιδάτη μπορούν να βελτιώσουν την απόδοση σε δύσκολες και βαρετές εργασίες,[45][46] και χρησιμοποιούνται από μερικούς μαθητές ως βοηθητικό στη μελέτη και στους διαγωνισμούς.[30][47] Με βάση μελέτες για την αυτοαναφερόμενη παράνομη χρήση διεγερτικών, η χρήση που βελτιώνει την απόδοση και όχι η αναψυχή, είναι ο πρωταρχικός λόγος που οι μαθητές χρησιμοποιούν διεγερτικά.[48]
Υπερβολικές δόσεις μεθυλφαινιδάτης, πάνω από το θεραπευτικό εύρος, μπορούν να επηρεάσουν τη λειτουργική μνήμη και τον γνωστικό έλεγχο.[45][44] Όπως η αμφεταμίνη και η βουπροπιόνη, η μεθυλφαινιδάτη αυξάνει την αντοχή στους ανθρώπους κυρίως μέσω της αναστολής της επαναπρόσληψης της ντοπαμίνης στο κεντρικό νευρικό σύστημα.[49] Παρόμοια με την απώλεια γνωστικής βελτίωσης κατά τη χρήση μεγάλων ποσοτήτων, μεγάλες δόσεις μεθυλφαινιδάτης μπορούν να προκαλέσουν παρενέργειες που επηρεάζουν την αθλητική απόδοση, όπως ραβδομυόλυση και υπερθερμία.[50] Ενώ η βιβλιογραφία προτείνει ότι μπορεί να βελτιώσει τη γνώση, οι περισσότεροι συγγραφείς συμφωνούν ότι η χρήση του φαρμάκου ως ψυχαγωγικού βοηθήματος όταν δεν υπάρχει διάγνωση ΔΕΠΥ δεν βελτιώνει πραγματικά τη ΣΔΣ.[30] Επιπλέον, έχει προταθεί ότι οι μαθητές που χρησιμοποιούν το φάρμακο για σπουδές μπορεί να κάνουν αυτοθεραπεία για πιθανά βαθύτερα υποκείμενα ζητήματα.
Αντενδείξεις
[Επεξεργασία | επεξεργασία κώδικα]Η μεθυλφαινιδάτη αντενδείκνυται σε άτομα που χρησιμοποιούν αναστολείς μονοαμινοξειδάσης (π.χ. φαινελζίνη και τρανυλκυπρομίνη ) ή άτομα με ανησυχία, τικ, γλαύκωμα ή υπερευαισθησία σε συστατικά που περιέχονται σε φαρμακευτικά προϊόντα μεθυλφαινιδάτης.[51]
Η Αμερικανική Υπηρεσία Τροφίμων και Φαρμάκων (FDA) εντάσσει τη μεθυλφαινιδάτη στην κατηγορία εγκυμοσύνης C και συνιστάται στις γυναίκες να χρησιμοποιούν το φάρμακο μόνο εάν τα οφέλη υπερτερούν των πιθανών κινδύνων.[52] Δεν έχουν διεξαχθεί αρκετές μελέτες σε ανθρώπους για να καταδειχθεί οριστικά επίδραση της μεθυλφαινιδάτης στην ανάπτυξη του εμβρύου.[53] Το 2018, μια ανασκόπηση κατέληξε στο συμπέρασμα ότι δεν ήταν τερατογόνος σε αρουραίους και κουνέλια και ότι «δεν είναι σημαντικό ανθρώπινο τερατογόνο».[54]
Παρενέργειες
[Επεξεργασία | επεξεργασία κώδικα]
Οι πιο συχνές παρενέργειες περιλαμβάνουν απώλεια όρεξης, ξηροστομία, άγχος / νευρικότητα, ναυτία και αϋπνία. Οι γαστρεντερικές παρενέργειες μπορεί να περιλαμβάνουν κοιλιακό άλγος και απώλεια βάρους. Οι παρενέργειες από το νευρικό σύστημα μπορεί να περιλαμβάνουν ακαθησία (διέγερση / ανησυχία), ευερεθιστότητα, δυσκινησία (τικ), λήθαργο (υπνηλία / κόπωση) και ζάλη. Οι καρδιακές παρενέργειες μπορεί να περιλαμβάνουν αίσθημα παλμών, αλλαγές στην αρτηριακή πίεση και τον καρδιακό ρυθμό (συνήθως ήπια) και ταχυκαρδία (γρήγορος καρδιακός ρυθμός).[56] Οι οφθαλμολογικές ανεπιθύμητες ενέργειες μπορεί να περιλαμβάνουν θολή όραση και ξηροφθαλμία, με λιγότερο συχνές αναφορές διπλωπίας και μυδρίασης.[57]
Υπάρχουν κάποιες ενδείξεις ήπιων μειώσεων του ύψους με παρατεταμένη θεραπεία σε παιδιά.[58] Αυτό εκτιμήθηκε σε ένα εκατοστό ή λιγότερο ανά έτος κατά τα πρώτα τρία χρόνια με συνολική μείωση 3 εκατοστά στην πάροδο 10 ετών.[59][60]
Μερικές φορές αναφέρεται υπερευαισθησία (συμπεριλαμβανομένου δερματικού εξανθήματος, κνίδωσης και πυρετού ) όταν χρησιμοποιείται διαδερμική μεθυλοφαινιδάτη. Το έμπλαστρο Daytrana έχει πολύ υψηλότερο ποσοστό δερματικών αντιδράσεων από τη στοματική μεθυλφαινιδάτη.[61]
Η μεθυλφαινιδάτη μπορεί να επιδεινώσει την ψύχωση σε άτομα που είναι ψυχωτικά και σε πολύ σπάνιες περιπτώσεις έχει συσχετιστεί με την εμφάνιση νέων ψυχωτικών συμπτωμάτων.[62] Θα πρέπει να χρησιμοποιείται με μεγάλη προσοχή σε άτομα με διπολική διαταραχή λόγω της πιθανής πρόκλησης μανίας ή υπομανίας.[63] Υπήρξαν πολύ σπάνιες αναφορές αυτοκτονικού ιδεασμού, αλλά ορισμένοι συγγραφείς ισχυρίζονται ότι τα στοιχεία δεν υποστηρίζουν συσχέτιση.[58] Αναφέρεται περιστασιακά λογόρροια. Πολύ σπάνια αναφέρονται διαταραχές της λίμπιντο, αποπροσανατολισμός και ψευδαισθήσεις. Ο πριαπισμός είναι μια πολύ σπάνια ανεπιθύμητη ενέργεια που μπορεί να είναι δυνητικά σοβαρή.[64]
Μελέτες που ανατέθηκαν από το USFDA από το 2011 δείχνουν ότι σε παιδιά, νεαρούς ενήλικες και ενήλικες δεν υπάρχει σχέση μεταξύ σοβαρών ανεπιθύμητων καρδιαγγειακών συμβάντων ( ξαφνικός θάνατος, καρδιακή προσβολή και εγκεφαλικό επεισόδιο ) και της ιατρικής χρήσης του μεθυλφαινιδάτη ή άλλων διεγερτικών για τη ΔΕΠΥ.[65]
Επειδή ορισμένες ανεπιθύμητες ενέργειες μπορεί να εμφανιστούν μόνο κατά τη χρόνια χρήση μεθυλφαινιδάτης, συνιστάται η συνεχής παρακολούθηση των ανεπιθύμητων ενεργειών.[66]
Μια ανασκόπηση του Cochrane του 2018 διαπίστωσε ότι η μεθυλφαινιδάτη μπορεί να σχετίζεται με σοβαρές παρενέργειες όπως καρδιακά προβλήματα, ψύχωση και θάνατο. Η βεβαιότητα των αποδεικτικών στοιχείων δηλώθηκε ως πολύ χαμηλή και ο πραγματικός κίνδυνος μπορεί να είναι υψηλότερος.[67]
Υπερβολική δόση
[Επεξεργασία | επεξεργασία κώδικα]Τα συμπτώματα μιας μέτριας οξείας υπερδοσολογίας από μεθυλφαινιδάτη προκύπτουν κυρίως από υπερδιέγερση του κεντρικού νευρικού συστήματος. Αυτά τα συμπτώματα περιλαμβάνουν: έμετο, ναυτία, διέγερση, τρόμο, υπερφλεξία, συσπάσεις των μυών, ευφορία, σύγχυση, ψευδαισθήσεις, παραλήρημα, υπερθερμία, εφίδρωση, έξαψη, κεφαλαλγία, ταχυκαρδία, αίσθημα παλμών, καρδιακές αρρυθμίες, υπέρταση, μυδρίαση και ξηρότητα των βλεννογόνων μεμβρανών. Μια σοβαρή υπερδοσολογία μπορεί να περιλαμβάνει συμπτώματα όπως υπερπυρεξία, συμπαθομιμητική τοξίκωση, σπασμούς, παράνοια, στερεοτυπία (μια επαναλαμβανόμενη διαταραχή κίνησης), ταχεία μυϊκή διάσπαση, κώμα και κατάρρευση του κυκλοφορικού συστήματος.[50][68][69] Η υπερδοσολογία μεθυλφαινιδάτης σπάνια είναι θανατηφόρα με κατάλληλη φροντίδα. Μετά την ένεση δισκίων μεθυλφαινιδάτης σε αρτηρία, έχουν αναφερθεί σοβαρές τοξικές αντιδράσεις που περιλαμβάνουν σχηματισμό αποστήματος και νέκρωση.[70]
Η θεραπεία μιας υπερδοσολογίας μεθυλφαινιδάτης συνήθως περιλαμβάνει τη χορήγηση βενζοδιαζεπινών, με τα αντιψυχωσικά, τους αγωνιστές α-αδρενοϋποδοχέων και την προποφόλη να χρησιμεύουν ως θεραπείες δεύτερης γραμμής.[69]
Εθισμός και εξάρτηση
[Επεξεργασία | επεξεργασία κώδικα]Πρότυπο:Annotated image 4 Η μεθυλφαινιδάτη είναι διεγερτικό με πιθανότητα εθισμού και εξάρτησης παρόμοια με την αμφεταμίνη. Έχει μέτρια πιθανότητα εθισμού ανάμεσα στα εθιστικά ναρκωτικά.[71][72] Κατά συνέπεια, ο εθισμός και η ψυχολογική εξάρτηση είναι δυνατοί και πιθανοί όταν η μεθυλφαινιδάτη χρησιμοποιείται σε υψηλές δόσεις ως ψυχαγωγικό φάρμακο. Όταν χρησιμοποιούνται πάνω από το θεραπευτικό εύρος, τα διεγερτικά συνδέονται με την ανάπτυξη της διεγερτικής ψύχωσης.[73] Όπως με όλα τα εθιστικά φάρμακα, η υπερέκφραση της ΔFosB στους μεσαίους ακανθώδεις νευρώνες τύπου D1 στον επικλινή πυρήνα εμπλέκεται στον εθισμό στη μεθυλφαινιδάτη.[74][75]
Η μεθυλφαινιδάτη έχει δείξει ορισμένα οφέλη ως θεραπεία αντικατάστασης για άτομα που είναι εθισμένα και εξαρτώνται από τη μεθαμφεταμίνη.[76] Η μεθυλφαινιδάτη και η αμφεταμίνη έχουν διερευνηθεί ως χημικό υποκατάστατο για τη θεραπεία του εθισμού στην κοκαΐνη[77][78][79][80] με τον ίδιο τρόπο που η μεθαδόνη χρησιμοποιείται ως φάρμακο αντικατάστασης για φυσική εξάρτηση από την ηρωίνη. Η αποτελεσματικότητά της στη θεραπεία του εθισμού στην κοκαΐνη ή σε ψυχοδιεγερτικά ή της ψυχολογικής εξάρτησης δεν έχει αποδειχθεί και απαιτείται περαιτέρω έρευνα.[81]
Βιομοριακοί μηχανισμοί
[Επεξεργασία | επεξεργασία κώδικα]Η μεθυλφαινιδάτη έχει τη δυνατότητα να προκαλέσει ευφορία λόγω της φαρμακοδυναμικής της δράσης (δηλαδή, αναστολή επαναπρόσληψης ντοπαμίνης) στο σύστημα ανταμοιβής του εγκεφάλου.[75] Σε θεραπευτικές δόσεις, τα διεγερτικά ΔΕΠΥ δεν ενεργοποιούν επαρκώς το σύστημα ανταμοιβής, ή ειδικότερα την οδό ανταμοιβής, στο βαθμό που είναι απαραίτητο για να προκαλέσουν επίμονες αυξήσεις της έκφρασης γονιδίου ΔFosB στους μεσαίους ακανόνιστους νευρώνες τύπου D1. κατά συνέπεια, όταν λαμβάνεται σύμφωνα με τις οδηγίες σε δόσεις που συνήθως συνταγογραφούνται για τη θεραπεία της ΔΕΠΥ, η χρήση μεθυλφαινιδάτης δεν έχει την ικανότητα να προκαλέσει εθισμό.[72] Ωστόσο, όταν η μεθυλφαινιδάτη χρησιμοποιείται σε αρκετά υψηλές δόσεις αναψυχής μέσω μιας βιοδιαθέσιμης οδού χορήγησης (π.χ. εμφύσηση ή ενδοφλέβια χορήγηση ), ιδιαίτερα για τη χρήση του φαρμάκου για πρόκληση ευφορίας, το ΔFosB συσσωρεύεται στον πυρήνα. Ως εκ τούτου, όπως και κάθε άλλο εθιστικό φάρμακο, η τακτική ψυχαγωγική χρήση μεθυλφαινιδάτης σε υψηλές δόσεις τελικά προκαλεί υπερέκφραση ΔFosB σε νευρώνες τύπου D1 που στη συνέχεια ενεργοποιεί μια σειρά καταρράκτες σηματοδότησης μεσολαβούμενης από μεταγραφή γονιδίου που προκαλούν εθισμό.[82][83]
Αλληλεπιδράσεις
[Επεξεργασία | επεξεργασία κώδικα]Η μεθυλφαινιδάτη μπορεί να αναστέλλει το μεταβολισμό των αντιπηκτικών της βιταμίνης Κ, ορισμένα αντιεπιληπτικά και ορισμένα αντικαταθλιπτικά (τρικυκλικά αντικαταθλιπτικά και εκλεκτικούς αναστολείς επαναπρόσληψης σεροτονίνης). Η ταυτόχρονη χορήγηση μπορεί να απαιτεί προσαρμογές της δόσης, ενδεχομένως υποβοηθούμενη από την παρακολούθηση των συγκεντρώσεων του φαρμάκου στο πλάσμα.[84] Υπάρχουν πολλές αναφορές περιπτώσεων συνδρόμου σεροτονίνης που προκλήθηκε από ταυτόχρονη χορήγηση μεθυλφαινιδάτης κςι αντικαταθλιπτικών.[85][86][87][88]
Όταν η μεθυλφαινιδάτη συμπυκνώνεται με αιθανόλη, ένας μεταβολίτης που ονομάζεται αιθυλφαινιδάτη σχηματίζεται μέσω ηπατικής διεστεροποίησης,[89][90] όχι διαφορετικά με τον ηπατικό σχηματισμό κοκααιθυλενίου από κοκαΐνη και αιθανόλη. Η μειωμένη ισχύς της αιθυλφαινιδάτης και ο ελάχιστος σχηματισμός της σημαίνει ότι δεν συμβάλλει στο φαρμακολογικό προφίλ σε θεραπευτικές δόσεις και ακόμη και σε περιπτώσεις υπερδοσολογίας οι συγκεντρώσεις αιθυλφαινιδάτης παραμένουν αμελητέες.[91]
Η συγκατάποση αλκοόλ (αιθανόλης) αυξάνει επίσης τα επίπεδα της d-μεθυλφαινιδάτης στο πλάσμα έως και 40%.[92]
Η ηπατοτοξικότητα από τη μεθυλφαινιδάτη είναι εξαιρετικά σπάνια, αλλά περιορισμένα στοιχεία δείχνουν ότι η πρόσληψη β-αδρενεργικών αγωνιστών με μεθυλφαινιδάτη μπορεί να αυξήσει τον κίνδυνο ηπατικής τοξικότητας.[93]
Φαρμακολογία
[Επεξεργασία | επεξεργασία κώδικα]Φαρμακοδυναμική
[Επεξεργασία | επεξεργασία κώδικα]Η μεθυλφαινιδάτη δρα κυρίως ως αναστολέας επαναπρόσληψης νορεπινεφρίνης-ντοπαμίνης (NDRI). Είναι παράγωγο βενζυλοπιπεριδίνης και φαιναιθυλαμίνης που μοιράζεται επίσης μέρος της βασικής του δομής με τις κατεχολαμίνες.
Η μεθυλφαινιδάτη είναι ψυχοδιεγερτική και αυξάνει τη δραστηριότητα του κεντρικού νευρικού συστήματος μέσω της αναστολής της επαναπρόσληψης των νευροδιαβιβαστών νορεπινεφρίνης και ντοπαμίνης. Όπως υποδηλώνουν τα μοντέλα της ΔΕΠΥ, συνδέεται με λειτουργικές βλάβες σε ορισμένα από τα συστήματα νευροδιαβιβαστών του εγκεφάλου, ιδίως εκείνων της ντοπαμίνης στις μεσοφλοιικές και μεσομεταιχμιακές οδούς και της νορεπινεφρίνης στον προμετωπιαίο φλοιό και υπομέλανα τόπο. Ψυχοδιεγερτικά όπως η μεθυλφαινιδάτη και η αμφεταμίνη μπορεί να είναι αποτελεσματικά στη θεραπεία της ΔΕΠΥ επειδή αυξάνουν τη δραστηριότητα των νευροδιαβιβαστών σε αυτά τα συστήματα. Όταν η επαναπρόσληψη αυτών των νευροδιαβιβαστών σταματά, η συγκέντρωση και τα αποτελέσματά της στη σύναψη αυξάνονται και διαρκούν περισσότερο, αντίστοιχα. Επομένως, η μεθυλφαινιδάτη ονομάζεται αναστολέας επαναπρόσληψης νορεπινεφρίνης-ντοπαμίνης.[91] Αυξάνοντας τις επιδράσεις της νορεπινεφρίνης και της ντοπαμίνης, η μεθυλφαινιδάτη αύξησε τη δραστηριότητα του κεντρικού νευρικού συστήματος και παρήγαγε αποτελέσματα όπως επαυξημένη εγρήγορση, καταπολέμηση της κόπωσης και βελτιωμένη προσοχή.[94][95]
Η μεθυλφαινιδάτη είναι πιο δραστική στη ρύθμιση των επιπέδων της ντοπαμίνης (DA) και σε μικρότερο βαθμό της νορεπινεφρίνης.[96] Η μεθυλφαινιδάτη συνδέεται και εμποδίζει τους μεταφορείς ντοπαμίνης (DAT) και τους μεταφορείς νορεπινεφρίνης.[97] Υπάρχει μεταβλητότητα στον αποκλεισμού του DAT και της εξωκυτταρικής ντοπαμίνης, οδηγώντας στην υπόθεση ότι η μεθυλφαινιδάτη ενισχύει τη βασική δραστικότητα ντοπαμίνης, οδηγώντας σε μη απόκριση σε άτομα με χαμηλή βασική δραστικότητα ντοπαμίνης.[98] Κατά μέσο όρο, η μεθυλφαινιδάτη προκαλεί αύξηση 3-4 φορές στη ντοπαμίνη και τη νορεπινεφρίνη στο ραβδωτό σώμα και στον προμετωπιαίο φλοιό.[99] Μελέτες μαγνητικής τομογραφίας (MRI) δείχνουν ότι η μακροχρόνια θεραπεία με διεγερτικά ΔΕΠΥ (συγκεκριμένα, αμφεταμίνη και μεθυλφαινιδάτη) μειώνει τις ανωμαλίες στη δομή και τη λειτουργία του εγκεφάλου που βρίσκονται σε άτομα με ADHD.[100][101][102]
Τόσο η αμφεταμίνη όσο και η μεθυλφαινιδάτη είναι κατά κύριο λόγο ντοπαμινεργικά φάρμακα, αλλά οι μηχανισμοί δράσης τους είναι διακριτοί. Η μεθυλφαινιδάτη δρα ως αναστολέας επαναπρόσληψης νορεπινεφρίνης-ντοπαμίνης, ενώ η αμφεταμίνη είναι παράγοντας απελευθέρωσης και αναστολέας επαναπρόσληψης ντοπαμίνης και νορεπινεφρίνης. Ο μηχανισμός δράσης της μεθυλφαινιδάτης στην απελευθέρωση της ντοπαμίνης και της νορεπινεφρίνης είναι θεμελιωδώς διαφορετικός από τα περισσότερα άλλα παράγωγα φαιναιθυλαμίνης, καθώς η μεθυλφαινιδάτη πιστεύεται ότι αυξάνει τον ρυθμό πυροδότησης νευρώνων,[103][104][105][106] ενώ η αμφεταμίνη μειώνει το ρυθμό πυροδότησης, αλλά προκαλεί απελευθέρωση μονοαμίνης αναστρέφοντας τη ροή των μονοαμινών μέσω μεταφορέων μονοαμίνης μέσω ενός διαφορετικού συνόλου μηχανισμών, συμπεριλαμβανομένης της ενεργοποίησης του TAAR1 και της διαμόρφωσης της λειτουργίας του VMAT2, μεταξύ άλλων μηχανισμών.[107][108][109] Η διαφορά στον μηχανισμό δράσης μεταξύ της μεθυλφαινιδάτης και της αμφεταμίνης έχει ως αποτέλεσμα την αναστολή των επιδράσεων της αμφεταμίνης στην μεθυφαινιδάτη στους μεταφορείς μονοαμίνης όταν συγχορηγούνται.[107]
Η μεθυλφαινιδάτη έχει συγγένεια πρόσδεσης τόσο με τον μεταφορέα ντοπαμίνης όσο και τον μεταφορέα νορεπινεφρίνης, με τα εναντιομερή δεξτρομεθυλφαινιδάτης να εμφανίζουν εμφανή συγγένεια για τον μεταφορέα νορεπινεφρίνης. Τόσο τα δεξτρόστροφα όσο και τα λεβόστροφα εναντιομερή εμφάνισαν συγγένεια υποδοχέα για τους σεροτονινεργικούς υπότυπους 5ΗΤ1A και 5ΗΤ2B, αν και δεν παρατηρήθηκε άμεση σύνδεση με τον μεταφορέα σεροτονίνης.[110] Μια μεταγενέστερη μελέτη επιβεβαίωσε τη δέσμευση της d-θρειο-μεθυλφαινιδάτης (δεξμεθυλφαινιδάτη) στον υποδοχέα 5ΗΤ 1Α, αλλά δε βρέθηκε σημαντική δραστικότητα επί του υποδοχέα 5-ΗΤ 2Β.[111]
Η μεθυλφαινιδάτη μπορεί να προστατεύσει τους νευρώνες από τις νευροτοξικές επιδράσεις της νόσου Πάρκινσον και της κατάχρησης μεθαμφεταμίνης.[112] Ο υποθετικός μηχανισμός νευροπροστασίας είναι μέσω της αναστολής των αλληλεπιδράσεων μεθαμφεταμίνης-DAT και μέσω της μείωσης της κυτταροπλασματικής ντοπαμίνης, οδηγώντας σε μειωμένη παραγωγή ειδών ριζών οξυγόνου που σχετίζονται με τη ντοπαμίνη.
Τα δεξτρόστροφα εναντιομερή είναι σημαντικά πιο ισχυρά από τα λεβόστροφα εναντιομερή και επομένως ορισμένα φάρμακα περιέχουν μόνο δεξμεθυλοφαινιδάτη.[96] Η μελετημένη μεγιστοποιημένη ημερήσια δόση μεθοφαινιδάτης φαίνεται να είναι 144 mg / ημέρα.[113]
Φαρμακοκινητική
[Επεξεργασία | επεξεργασία κώδικα]Η μεθυλφαινιδάτη που λαμβάνεται από το στόμα έχει βιοδιαθεσιμότητα 11–52% με διάρκεια μέγιστης δράσης περίπου 2–4 ώρες στα σκευάσματα άμεσης απελευθέρωσης (δηλ. Ritalin), 3-8 ώρες για παρατεταμένη απελευθέρωση (δηλ. Ritalin SR) και 8-12 ώρες για εκτεταμένη απελευθέρωση (δηλ. Concerta). Ο χρόνος ημιζωής της μεθυλφαινιδάτη είναι 2-3 ώρες, ανάλογα με το άτομο. Η μέγιστη συγκέντρωση στο πλάσμα επιτυγχάνεται σε περίπου 2 ώρες.[3] Η μεθυλφαινιδάτη παρουσιάζει μικρή δέσμευση με πρωτεΐνες στο πλάσμα (10-33%) και έχει όγκο κατανομής 2,65L / kg.[114]
Η δεξτρομεθυλοφαινιδάτη είναι πολύ πιο βιοδιαθέσιμη από την λεβομεθυλοφαινιδάτη όταν χορηγείται από το στόμα και είναι κυρίως υπεύθυνη για την ψυχοδραστικότητα της ρακεμικής μεθυλοφαινιδάτης.[3]
Σε αντίθεση με το προσδοκόμενο, η λήψη μεθυλφαινιδάτης με γεύμα επιταχύνει την απορρόφηση.[115] Οι επιδράσεις ενός γεύματος με υψηλή περιεκτικότητα σε λιπαρά στην παρατηρούμενη Cmax διαφέρουν μεταξύ ορισμένων σκευασμάτων παρατεταμένης απελευθέρωσης, με συνδυασμένες συνθέσεις IR / ER και OROS που δείχνουν μειωμένα επίπεδα Cmax[116] ενώ οι συνθέσεις παρατεταμένης απελευθέρωσης με βάση υγρό έδειξαν αυξημένα επίπεδα Cmax όταν χορηγήθηκαν ένα γεύμα με υψηλή περιεκτικότητα σε λιπαρά.[117]
Η μεθυλφαινιδάτη μεταβολίζεται σε ριταλινικό οξύ από το CES1A1, ένα ένζυμο στο ήπαρ. Η δεξτρομεθυλοφαινιδάτη μεταβολίζεται επιλεκτικά με βραδύτερο ρυθμό από ότι η λεβομεθυλοφαινιδάτη.[118] 97% του μεταβολισμένου φαρμάκου απεκκρίνεται στα ούρα και μεταξύ 1 και 3% απεκκρίνεται στα κόπρανα. Μια μικρή ποσότητα, λιγότερο από 1%, του φαρμάκου απεκκρίνεται στα ούρα με την αμετάβλητη μορφή του.[114]
Χημεία
[Επεξεργασία | επεξεργασία κώδικα]Τέσσερα ισομερή μεθυλφαινιδάτης είναι δυνατά, καθώς το μόριο έχει δύο χειρόμορφα κέντρα. Διακρίνονται ένα ζεύγος θρεοϊσομερών και ένα ζεύγος έρυθρο, από τα οποία κυρίως η d-θρεο-μεθυλοφαινιδάτη εμφανίζει τα φαρμακολογικά επιθυμητά αποτελέσματα.[96][119] Τα διαστερεομερή ερυθρού είναι αμίνες τύπου πιεσίνης, μια ιδιότητα που δεν μοιράζεται με τα διαστερεομερή θρεο. Όταν το φάρμακο κυκλοφόρησε για πρώτη φορά, πωλήθηκε ως μείγμα 4:1 ερυθρο:θρεο διαστερεομερών, αλλά αργότερα αναδιαμορφώθηκε ώστε να περιέχει μόνο τα θρεο διαστερεομερή. Το "TMP" αναφέρεται σε ένα προϊόν θρεο που δεν περιέχει ερυθρο διαστερεομερή, δηλαδή (±) -θρεο-μεθυλοφαινιδάτη. Δεδομένου ότι τα θρεοϊσομερή ευνοούνται ενεργητικά, είναι εύκολο να επιμεριστεί κάποιο από τα ανεπιθύμητα ερυθροϊσομερή. Το φάρμακο που περιέχει μόνο δεξτροστροφική μεθυλφαινιδάτη ονομάζεται μερικές φορές d-TMP, αν και αυτό το όνομα χρησιμοποιείται σπάνια μόνο και αναφέρεται πολύ πιο συχνά ως δεξμεθυλοφαινιδάτη, d-MPH ή d-θρεο-μεθυλοφαινιδάτη. Έχει δημοσιευθεί μια ανασκόπηση για τη σύνθεση του εναντιομερώς καθαρού υδροχλωριδίου ( 2R, 2 ' R ) - (+) - θρεο -μεθυλοφαινιδάτη.[120]
Ανίχνευση σε βιολογικά υγρά
[Επεξεργασία | επεξεργασία κώδικα]Η συγκέντρωση μεθυλφαινιδάτης ή ριταλινικού οξέος, του κύριου μεταβολίτη της, μπορεί να προσδιοριστεί ποσοτικά σε πλάσμα, ορό ή πλήρες αίμα προκειμένου να παρακολουθείται η συμμόρφωση σε εκείνους που λαμβάνουν το φάρμακο θεραπευτικά, για να επιβεβαιώσει τη διάγνωση σε πιθανά θύματα δηλητηρίασης ή να βοηθήσει στην ιατροδικαστική έρευνα σε περίπτωση θανατηφόρας υπερδοσολογίας.[121]
Ιστορία
[Επεξεργασία | επεξεργασία κώδικα]Η μεθυλφαινιδάτη παρασκευάστηκε για πρώτη φορά το 1944,[122] και αναγνωρίστηκε ως διεγερτικό το 1954.[123]
Η μεθυλφαινιδάτη συντέθηκε από τον χημικό της Ciba (τώρα Novartis) Λεάντρο Πάνιτσον. Ονόμασε το φάρμακο από τη σύζυγό του, που είχε το παρατσούκλι Ρίτα, που χρησιμοποίησε το Ritalin για να αντισταθμίσει τη χαμηλή αρτηριακή πίεση.[124]
Αρχικά κυκλοφόρησε στο εμπόριο ως μείγμα δύο ρακεμικών, 80% (±) -ερυθρό και 20% (±) -θρέο. Μεταγενέστερες μελέτες των ρακεμικών έδειξαν ότι η κεντρική διεγερτική δραστηριότητα σχετίζεται με το θρεο ρακεμικό και επικεντρώθηκε στον διαχωρισμό και τη μετατροπή του ερυθροϊσομερούς στο πιο ενεργό θρεοϊσομερές.[125][126][127]
Η μεθυλφαινιδάτη χρησιμοποιήθηκε για πρώτη φορά για να ανακουφίσει το κώμα, τη ναρκοληψία και την κατάθλιψη που προκαλείται από βαρβιτουρικά.[128] Χρησιμοποιήθηκε αργότερα για τη θεραπεία ελλειμμάτων μνήμης σε ηλικιωμένους.[129] Ξεκινώντας από τη δεκαετία του 1960, χρησιμοποιήθηκε για τη θεραπεία παιδιών με ΔΕΠΥ βάσει προηγούμενης εργασίας που ξεκίνησε με τις μελέτες του Αμερικανού ψυχίατρου Τσαρλς Μπράντλεϊ[130] σχετικά με τη χρήση ψυχοδιεγερτικών φαρμάκων, όπως η Μπενζεδρίνη, σε τότε λεγόμενα «κακοπροσαρμοσμένα παιδιά».[131] Η παραγωγή και η συνταγογράφηση της μεθυλφαινιδάτης αυξήθηκαν σημαντικά τη δεκαετία του 1990, ειδικά στις Ηνωμένες Πολιτείες, καθώς η διάγνωση ΔΕΠΥ έγινε καλύτερα κατανοητή και πιο γενικά αποδεκτή στις κοινότητες ιατρικής και ψυχικής υγείας.[132]
Κοινωνία και πολιτισμός
[Επεξεργασία | επεξεργασία κώδικα]
Η μεθυλφαινιδάτη διατίθεται σε πολλές μορφές και ένας γιατρός θα καθορίσει την κατάλληλη συνταγοποίηση του φαρμάκου που θα συνταγογραφηθεί με βάση το ιστορικό του ασθενούς, τις εμπειρίες του γιατρού για τη θεραπεία άλλων ασθενών με προϊόντα μεθυλφαινιδάτης και την τιμή ή τη διαθεσιμότητα του προϊόντος. Οι διαθέσιμες σήμερα μορφές περιλαμβάνουν μια ποικιλία δισκίων και καψουλών, ένα διαδερμικό έμπλαστρο και ένα πόσιμο εναιώρημα (υγρό σιρόπι).
Το δεξτροστροφρικό εναντιομερές της μεθυλφαινιδάτης, γνωστό ως δεξμεθυλοφαινιδάτη, πωλείται ως γενόσημο και με τα εμπορικά σήματα Focalin και Attenade τόσο σε μορφή άμεσης απελευθέρωσης όσο και σε μορφή παρατεταμένης αποδέσμευσης. Σε ορισμένες περιπτώσεις μπορεί να συνταγογραφείται αντί για μεθυλφαινιδάτη, ωστόσο δεν έχει σημαντικά πλεονεκτήματα έναντι της μεθυλοφαινιδάτη σε ισοδύναμες δόσεις και έτσι μερικές φορές θεωρείται ότι αποτελεί παράδειγμα ενός αειθαλούς φαρμάκου.[133]
Νομικό καθεστώς
[Επεξεργασία | επεξεργασία κώδικα]- Σε διεθνές επίπεδο, η μεθυλφαινιδάτη είναι φάρμακο του Παραρτήματος II σύμφωνα με τη Σύμβαση για τις Ψυχοτροπικές Ουσίες.[134]
- Στις Ηνωμένες Πολιτείες, η μεθυλφαινιδάτη ταξινομείται ως ελεγχόμενη ουσία του Παραρτήματος ΙΙ, ο χαρακτηρισμός χρησιμοποιείται για ουσίες που έχουν αναγνωρισμένη ιατρική αξία αλλά παρουσιάζουν υψηλές πιθανότητες κατάχρησης.
- Στο Ηνωμένο Βασίλειο, η μεθυλφαινιδάτη είναι μια ελεγχόμενη ουσία «Κατηγορίας Β». Η κατοχή χωρίς συνταγή φέρει ποινή έως 5 χρόνια ή απεριόριστο πρόστιμο ή και τα δύο. Η προμήθεια μεθυλφαινιδάτης καταδικάζεται με 14 χρόνια ή απεριόριστο πρόστιμο, ή και τα δύο.[135]
- Στον Καναδά, η μεθυλφαινιδάτη περιλαμβάνεται στο Παράρτημα III του νόμου περί ελεγχόμενων ναρκωτικών και ουσιών και είναι παράνομο να κατέχεται χωρίς ιατρική συνταγή, με την παράνομη κατοχή να τιμωρείται με φυλάκιση έως και τριών ετών ή (μέσω συνοπτικής καταδίκης) έως και ένα έτος φυλάκιση και / ή πρόστιμα έως και δύο χιλιάδες δολάρια. Η παράνομη κατοχή με σκοπό την εμπορία τιμωρείται με ποινή φυλάκισης έως δέκα ετών ή (μέσω συνοπτικής καταδίκης) με φυλάκιση έως δεκαοκτώ μηνών.[136]
- Στη Νέα Ζηλανδία, η μεθυλφαινιδάτη είναι «ελεγχόμενη ουσία κατηγορίας B2». Η παράνομη κατοχή τιμωρείται με ποινή φυλάκισης έξι μηνών και με διανομή 14 ετών.
- Στην Αυστραλία, η μεθυλφαινιδάτη είναι ελεγχόμενη ουσία «Παραρτήματος 8».[137] Τέτοια ναρκωτικά πρέπει να φυλάσσονται σε ασφαλή κλειδαριά έως ότου διανεμηθούν και η κατοχή χωρίς συνταγή τιμωρείται με πρόστιμα και φυλάκιση.
- Στη Ρωσία, η μεθυλφαινιδάτη είναι ψυχοτρόπος ουσία ελεγχόμενη στον κατάλογο Ι χωρίς αναγνωρισμένη ιατρική αξία. Η Σταθερή Επιτροπή Ελέγχου Φαρμάκων του ρωσικού Υπουργείου Υγείας τοποθέτησε τη μεθυλφαινιδάτη και τα παράγωγά της στον Εθνικό Κατάλογο Ναρκωτικών, Ψυχοτρόπων Ουσιών και των Προδρόμων τους και η κυβέρνηση απαγόρευσε τη μεθυλφαινιδάτη για οποιαδήποτε χρήση στις 25 Οκτωβρίου 2014.[138]
- Στη Σουηδία, η μεθυλφαινιδάτη. Η κατοχή χωρίς ιατρική συνταγή τιμωρείται με φυλάκιση έως και τρία χρόνια.[139]
- Στη Γαλλία, η μεθυλφαινιδάτη καλύπτεται από το πρόγραμμα «ναρκωτικών», οι συνθήκες συνταγογράφησης και διανομής περιορίζονται με ιατρική συνταγή μόνο για την αρχική θεραπεία και ετήσιες διαβουλεύσεις.[140]
- Στην Ινδία, η μεθυλφαινιδάτη είναι ένα φάρμακο του παραρτήματος Χ και ελέγχεται από τον Κανόνα Ναρκωτικών και Καλλυντικών του 1945. Διανέμεται μόνο με ιατρική συνταγή.[141] Νομικά, 2 γραμμάρια μεθυλφαινιδάτης ταξινομούνται ως μικρή ποσότητα και 50 γραμμάρια ως μεγάλη ή εμπορική ποσότητα.[142]
- Στο Χονγκ Κονγκ, η μεθυλφαινιδάτη ελέγχεται σύμφωνα με το παράρτημα 1 του διατάγματος για τα επικίνδυνα ναρκωτικά (Κεφ. 134).[143]
Αμφισβήτηση
[Επεξεργασία | επεξεργασία κώδικα]Η μεθυλφαινιδάτη αποτέλεσε αντικείμενο αντιπαραθέσεων σχετικά με τη χρήση της στη θεραπεία της ΔΕΠΥ. Η συνταγογράφηση ψυχοδιεγερτικής φαρμακευτικής αγωγής στα παιδιά για τη μείωση των συμπτωμάτων της ΔΕΠΥ υπήρξε ένα σημαντικό σημείο κριτικής.[144] Ο ισχυρισμός ότι η μεθυλφαινιδάτη δρα ως φάρμακο εισόδου έχει δυσφημιστεί από πολλές πηγές,[145] σύμφωνα με τις οποίες η κατάχρηση είναι στατιστικά πολύ χαμηλή και «η διεγερτική θεραπεία στην παιδική ηλικία δεν αυξάνει τον κίνδυνο για επακόλουθη κατάχρηση ναρκωτικών και αλκοόλ διαταραχές αργότερα στη ζωή».[146] Μια μελέτη διαπίστωσε ότι το φάρμακο ΔΕΠΥ δεν συσχετίστηκε με αυξημένο κίνδυνο χρήσης τσιγάρων και στην πραγματικότητα διεγερτικές θεραπείες όπως το Ritalin φάνηκαν να μειώνουν αυτόν τον κίνδυνο.[147]
Μεταξύ των χωρών με τα υψηλότερα ποσοστά χρήσης φαρμακευστικής μεθυλφαινιδάτης είναι η Ισλανδία,[148] όπου η έρευνα δείχνει ότι το φάρμακο ήταν η πιο συχνά χρησιμοποιούμενη ουσία μεταξύ των χρηστών ενδοφλέβιων ουσιών.[149] Η μελέτη περιελάμβανε 108 χρήστες ενδοφλέβιων ουσιών και το 88% από αυτούς είχαν ενέσει μεθυλφαινιδάτη τις τελευταίες 30 ημέρες και για το 63% αυτών, η μεθυλφαινιδάτη ήταν η προτιμώμενη ουσία.
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 «Methylphenidate Hydrochloride Monograph for Professionals». Drugs.com (στα Αγγλικά). AHFS. Αρχειοθετήθηκε από το πρωτότυπο στις 19 Δεκεμβρίου 2018. Ανακτήθηκε στις 19 Δεκεμβρίου 2018.
- ↑ Bonewit-West K, Hunt SA, Applegate E (2012). Today's Medical Assistant: Clinical and Administrative Procedures (στα Αγγλικά). Elsevier Health Sciences. σελ. 571. ISBN 9781455701506.
- ↑ 3,0 3,1 3,2 «Pharmacokinetics and clinical effectiveness of methylphenidate». Clinical Pharmacokinetics 37 (6): 457–70. December 1999. doi:. PMID 10628897.
- ↑ 4,0 4,1 «Methylphenidate». Methylphenidate. National Center for Biotechnology Information.
- ↑ «Neurobiology of Executive Functions: Catecholamine Influences on Prefrontal Cortical Functions». Biological Psychiatry 57 (11): 1377–84. 2005. doi:. PMID 15950011.
- ↑ Stahl, Stephen M. (11 Απριλίου 2013). Stahl's Essential Psychopharmacology: Neuroscientific Basis and Practical Applications (4th έκδοση). Cambridge University Press. ISBN 978-1107686465.
- ↑ Preedy, Victor R. (2016). Neuropathology of Drug Addictions and Substance Misuse Volume 3: General Processes and Mechanisms, Prescription Medications, Caffeine and Areca, Polydrug Misuse, Emerging Addictions and Non-Drug Addictions (στα Αγγλικά). Academic Press. σελ. 651. ISBN 9780128006771.
- ↑ «The history of attention deficit hyperactivity disorder». ADHD Attention Deficit and Hyperactivity Disorders 2 (4): 241–55. 2010. doi:. PMID 21258430.
- ↑ March 2015, The Pharmaceutical Journal6. «Narcotics monitoring board reports 66% increase in global consumption of methylphenidate». Pharmaceutical Journal. Αρχειοθετήθηκε από το πρωτότυπο στις 19 December 2018. https://web.archive.org/web/20181219230236/https://www.pharmaceutical-journal.com/news-and-analysis/news-in-brief/narcotics-monitoring-board-reports-66-increase-in-global-consumption-of-methylphenidate/20068042.article?firstPass=false. Ανακτήθηκε στις 19 December 2018.
- ↑ «The Top 300 of 2020». ClinCalc. Ανακτήθηκε στις 11 Απριλίου 2020.
- ↑ «Methylphenidate - Drug Usage Statistics». ClinCalc. Ανακτήθηκε στις 11 Απριλίου 2020.
- ↑ «Methylphenidate». www.drugbank.ca. Αρχειοθετήθηκε από το πρωτότυπο στις 31 Ιανουαρίου 2019. Ανακτήθηκε στις 30 Ιανουαρίου 2019.
- ↑ «Stimulants: use and abuse in the treatment of ADD». Current Opinion in Pharmacology 5 (1): 87–93. 2005. doi:. PMID 15661631.
- ↑ «Methylphenidate HCl: therapy for attention deficit hyperactivity disorder». Expert Rev Neurother 5 (3): 325–31. 2005. doi:. PMID 15938665.
- ↑ «Treatment of attention deficit hyperactivity disorder in adults». Expert Rev Neurother 5 (1): 107–21. 2005. doi:. PMID 15853481.
- ↑ «Stimulant medication therapy in the treatment of children with attention deficit hyperactivity disorder». Pediatr. Clin. North Am. 36 (5): 1183–97. 1989. doi:. PMID 2677938. https://archive.org/details/sim_pediatric-clinics-of-north-america_1989-10_36_5/page/1183.
- ↑ 17,0 17,1 Management (1 November 2011). «ADHD: Clinical Practice Guideline for the Diagnosis, Evaluation, and Treatment of Attention-Deficit/Hyperactivity Disorder in Children and Adolescents». Pediatrics 128 (5): 1007–1022. doi:. ISSN 0031-4005. PMID 22003063.
- ↑ «Methylphenidate in children with hyperactivity: review and cost-utility analysis». Pharmacoepidemiol Drug Saf 10 (2): 85–94. 2001. doi:. PMID 11499858.
- ↑ «Clinical inquiries. Is methylphenidate useful for treating adolescents with ADHD?». The Journal of Family Practice 53 (8): 659–61. 2004. PMID 15298843. Αρχειοθετήθηκε από το πρωτότυπο στις 13 July 2011. https://web.archive.org/web/20110713105514/http://www.jfponline.com/Pages.asp?AID=1753. Ανακτήθηκε στις 30 April 2009.
- ↑ 20,0 20,1 Millichap, JG, επιμ. (2010). «Chapter 3: Medications for ADHD». Attention Deficit Hyperactivity Disorder Handbook: A Physician's Guide to ADHD (2nd έκδοση). New York: Springer. σελίδες 111–113. ISBN 9781441913968.
- ↑ «Long-term outcomes with medications for attention-deficit hyperactivity disorder: current status of knowledge». CNS Drugs 25 (7): 539–554. July 2011. doi:. PMID 21699268.
- ↑ Millichap, JG, επιμ. (2010). «Chapter 3: Medications for ADHD». Attention Deficit Hyperactivity Disorder Handbook: A Physician's Guide to ADHD (2nd έκδοση). New York: Springer. σελίδες 121–123. ISBN 9781441913968.
- ↑ «Methylphenidate for attention deficit hyperactivity disorder (ADHD) in children and adolescents – assessment of adverse events in non-randomised studies». Cochrane Database Syst Rev 5: CD012069. 2018. doi:. PMID 29744873. «Our findings suggest that methylphenidate may be associated with a number of serious adverse events as well as a large number of non-serious adverse events in children. Concerning adverse events associated with the treatment, our systematic review of randomised clinical trials (RCTs) demonstrated no increase in serious adverse events, but a high proportion of participants suffered a range of non‐serious adverse events.».
- ↑ «Methylphenidate for children and adolescents with attention deficit hyperactivity disorder (ADHD)». Cochrane Database Syst Rev 11 (11): CD009885. November 2015. doi:. PMID 26599576. Αρχειοθετήθηκε από το πρωτότυπο στις 2021-02-28. https://web.archive.org/web/20210228063939/https://findresearcher.sdu.dk:8443/ws/files/129083195/Methylphenidate_for_children_and_adolescents_with_attention_deficit_hyperactivity_disorder_ADHD_.pdf. Ανακτήθηκε στις 2020-10-06. «the low quality of the underpinning evidence means that we cannot be certain of the magnitude of the effects.».
- ↑ «eEML - Electronic Essential Medicines List». list.essentialmeds.org. Ανακτήθηκε στις 26 Μαρτίου 2020.
- ↑ «Practice parameter for the use of stimulant medications in the treatment of children, adolescents, and adults». J. Am. Acad. Child Adolesc. Psychiatry 41 (2 Suppl): 26S–49S. February 2002. doi:. PMID 11833633.
- ↑ «Stimulants for Attention Deficit Hyperactivity Disorder». WebMD. Healthwise. 12 Απριλίου 2010. Αρχειοθετήθηκε από το πρωτότυπο στις 13 Νοεμβρίου 2013. Ανακτήθηκε στις 12 Νοεμβρίου 2013.
- ↑ «Effect of stimulant medications for attention-deficit/hyperactivity disorder on later substance use and the potential for stimulant misuse, abuse, and diversion». J Clin Psychiatry 68 Suppl 11 (11): 15–22. 2007. doi:. PMID 18307377.
- ↑ «Does Stimulant Therapy of Attention-Deficit/Hyperactivity Disorder Beget Later Substance Abuse? A Meta-analytic Review of the Literature». Pediatrics 111 (1): 179–85. 2003. doi:. PMID 12509574. https://archive.org/details/sim_pediatrics_2003-01_111_1/page/179.
- ↑ 30,0 30,1 30,2 «Mitigating risks of students use of study drugs through understanding motivations for use and applying harm reduction theory: a literature review». Harm Reduction Journal 14 (1): 68. October 2017. doi:. PMID 28985738.
- ↑ «Psychopharmacology for young children: clinical needs and research opportunities». Pediatrics 108 (4): 983–9. October 2001. doi:. PMID 11581454. https://semanticscholar.org/paper/7b921a206155401fc089da016b94d96ceba389a3.
- ↑ «Integrative neuroscience approach to predict ADHD stimulant response». Expert Review of Neurotherapeutics 6 (5): 753–63. 2006. doi:. PMID 16734523.
- ↑ Neinstein, Lawrence (2009). Handbook of adolescent health care. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. ISBN 978-0-7817-9020-8.
- ↑ «Treatment modalities for narcolepsy». Neurology 50 (2 Suppl 1): S43-8. February 1998. doi:. PMID 9484423.
- ↑ «Evaluation of treatment with stimulants in narcolepsy». Sleep 17 (8 Suppl): S103-6. December 1994. doi:. PMID 7701190.
- ↑ «Wake-promoting pharmacotherapy for psychiatric disorders». Curr Psychiatry Rep 16 (12): 524. December 2014. doi:. PMID 25312027.
- ↑ «Methylphenidate: a review of its neuropharmacological, neuropsychological and adverse clinical effects». Hum Psychopharmacol 19 (3): 151–80. 2004. doi:. PMID 15079851. https://archive.org/details/sim_human-psychopharmacology_2004-04_19_3/page/151.
- ↑ «Methylphenidate hydrochloride as an antidepressant: controversy, case studies, and review». South. Med. J. 85 (10): 985–91. 1992. doi:. PMID 1411740. https://archive.org/details/sim_southern-medical-journal_1992-10_85_10/page/985.
- ↑ «Stimulants in the treatment of depression: a critical overview». J Clin Psychiatry 50 (7): 241–9. 1989. PMID 2567730. https://archive.org/details/sim_journal-of-clinical-psychiatry_1989-07_50_7/page/241.
- ↑ «Palliative uses of methylphenidate in patients with cancer: a review». J. Clin. Oncol. 20 (1): 335–9. 2002. doi:. PMID 11773187.
- ↑ Ruthirakuhan, Myuri T.; Herrmann, Nathan; Abraham, Eleenor H.; Chan, Sarah; Lanctôt, Krista L. (2018-05-04). «Pharmacological interventions for apathy in Alzheimer's disease». The Cochrane Database of Systematic Reviews 5: CD012197. doi:. ISSN 1469-493X. PMID 29727467.
- ↑ «The Cognition-Enhancing Effects of Psychostimulants Involve Direct Action in the Prefrontal Cortex». Biol. Psychiatry 77 (11): 940–950. June 2015. doi:. PMID 25499957. «The procognitive actions of psychostimulants are only associated with low doses. Surprisingly, despite nearly 80 years of clinical use, the neurobiology of the procognitive actions of psychostimulants has only recently been systematically investigated. Findings from this research unambiguously demonstrate that the cognition-enhancing effects of psychostimulants involve the preferential elevation of catecholamines in the PFC and the subsequent activation of norepinephrine α2 and dopamine D1 receptors. ... This differential modulation of PFC-dependent processes across dose appears to be associated with the differential involvement of noradrenergic α2 versus α1 receptors. Collectively, this evidence indicates that at low, clinically relevant doses, psychostimulants are devoid of the behavioral and neurochemical actions that define this class of drugs and instead act largely as cognitive enhancers (improving PFC-dependent function). This information has potentially important clinical implications as well as relevance for public health policy regarding the widespread clinical use of psychostimulants and for the development of novel pharmacologic treatments for attention-deficit/hyperactivity disorder and other conditions associated with PFC dysregulation.».
- ↑ «Prescription Stimulants' Effects on Healthy Inhibitory Control, Working Memory, and Episodic Memory: A Meta-analysis». J. Cogn. Neurosci. 27 (6): 1069–1089. January 2015. doi:. PMID 25591060. Αρχειοθετήθηκε από το πρωτότυπο στις 19 September 2018. https://web.archive.org/web/20180919111616/https://repository.upenn.edu/neuroethics_pubs/130/. Ανακτήθηκε στις 14 November 2018. «Specifically, in a set of experiments limited to high-quality designs, we found significant enhancement of several cognitive abilities. ... The results of this meta-analysis ... do confirm the reality of cognitive enhancing effects for normal healthy adults in general, while also indicating that these effects are modest in size.».
- ↑ 44,0 44,1 «Psychostimulants and cognition: a continuum of behavioral and cognitive activation». Pharmacol. Rev. 66 (1): 193–221. January 2014. doi:. PMID 24344115.
- ↑ 45,0 45,1 «Chapter 13: Higher Cognitive Function and Behavioral Control». Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd έκδοση). New York: McGraw-Hill Medical. 2009. σελ. 318. ISBN 9780071481274.
Therapeutic (relatively low) doses of psychostimulants, such as methylphenidate and amphetamine, improve performance on working memory tasks both in normal subjects and those with ADHD. Positron emission tomography (PET) demonstrates that methylphenidate decreases regional cerebral blood flow in the doroslateral prefrontal cortex and posterior parietal cortex while improving performance of a spatial working memory task. This suggests that cortical networks that normally process spatial working memory become more efficient in response to the drug. ... [It] is now believed that dopamine and norepinephrine, but not serotonin, produce the beneficial effects of stimulants on working memory. At abused (relatively high) doses, stimulants can interfere with working memory and cognitive control ... stimulants act not only on working memory function, but also on general levels of arousal and, within the nucleus accumbens, improve the saliency of tasks. Thus, stimulants improve performance on effortful but tedious tasks ... through indirect stimulation of dopamine and norepinephrine receptors.
- ↑ «Non-specific effects of Methylphenidate (Ritalin) on cognitive ability and decision-making of ADHD and healthy adult». Psychopharmacology 210 (4): 511–519. 2010. doi:. PMID 20424828. https://archive.org/details/sim_psychopharmacology_2010-07_210_4/page/511.
- ↑ «Pills become an addictive study aid». JS Online. 26 Μαρτίου 2006. Αρχειοθετήθηκε από το πρωτότυπο στις 15 Αυγούστου 2007. Ανακτήθηκε στις 2 Δεκεμβρίου 2007.
- ↑ «Illicit use of specific prescription stimulants among college students: prevalence, motives, and routes of administration». Pharmacotherapy 26 (10): 1501–1510. October 2006. doi:. PMID 16999660. PMC 1794223. https://archive.org/details/sim_pharmacotherapy_2006-10_26_10/page/1501.
- ↑ «Neurophysiological determinants of theoretical concepts and mechanisms involved in pacing». Sports Med. 43 (5): 301–311. May 2013. doi:. PMID 23456493.
- ↑ 50,0 50,1 Noven Pharmaceuticals, Inc. (17 Απριλίου 2015). «Daytrana Prescribing Information» (PDF). United States Food and Drug Administration. σελίδες 1–33. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 23 Ιουνίου 2015. Ανακτήθηκε στις 23 Ιουνίου 2015.
- ↑ «DAYTRANA» (PDF). United States Food and Drug Administration. Noven Pharmaceuticals, Inc. Οκτωβρίου 2013. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 14 Ιουλίου 2014. Ανακτήθηκε στις 13 Ιουνίου 2014.
- ↑ «Methylphenidate: Use During Pregnancy and Breastfeeding». Drugs.com. Αρχειοθετήθηκε από το πρωτότυπο στις 2 Ιανουαρίου 2018.
- ↑ «Exposure to attention deficit hyperactivity disorder medications during pregnancy». Canadian Family Physician 53 (7): 1153–5. 2007. PMID 17872810.
- ↑ Ornoy, Asher (6 February 2018). «Pharmacological Treatment of Attention Deficit Hyperactivity Disorder During Pregnancy and Lactation». Pharmaceutical Research 35 (3): 46. doi:. PMID 29411149.
- ↑ «Development of a rational scale to assess the harm of drugs of potential misuse». Lancet 369 (9566): 1047–53. March 2007. doi:. PMID 17382831.
- ↑ «Ritalin LA® (methylphenidate hydrochloride) extended-release capsules» (PDF). Novartis. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 20 Ιουλίου 2011.
- ↑ «Ocular side effects of selected systemic drugs». Optometry Clinics 2 (4): 73–96. 1992. PMID 1363080.
- ↑ 58,0 58,1 «Practitioner review: current best practice in the management of adverse events during treatment with ADHD medications in children and adolescents». Journal of Child Psychology and Psychiatry, and Allied Disciplines 54 (3): 227–46. March 2013. doi:. PMID 23294014.
- ↑ «Growth on stimulant medication; clarifying the confusion: a review». Archives of Disease in Childhood 90 (8): 801–6. August 2005. doi:. PMID 16040876. PMC 1720538. https://archive.org/details/sim_archives-of-disease-in-childhood_2005-08_90_8/page/801.
- ↑ «ADHD, Multimodal Treatment, and Longitudinal Outcome: Evidence, Paradox, and Challenge». Wiley Interdisciplinary Reviews. Cognitive Science 6 (1): 39–52. January 2015. doi:. PMID 25558298.
- ↑ «Transdermal therapy for attention-deficit hyperactivity disorder with the methylphenidate patch (MTS)». CNS Drugs 28 (3): 217–28. March 2014. doi:. PMID 24532028.
- ↑ «Methylphenidate-induced psychosis in adult attention-deficit/hyperactivity disorder: report of 3 new cases and review of the literature». Clinical Neuropharmacology 33 (4): 204–6. July 2010. doi:. PMID 20571380.
- ↑ «Frequency of stimulant treatment and of stimulant-associated mania/hypomania in bipolar disorder patients». Psychopharmacology Bulletin 41 (4): 37–47. 2008. PMID 19015628.
- ↑ «Methylphenidate ADHD Medications: Drug Safety Communication – Risk of Long-lasting Erections». U.S. Food and Drug Administration. 17 Δεκεμβρίου 2013. Αρχειοθετήθηκε από το πρωτότυπο στις 17 Δεκεμβρίου 2013. Ανακτήθηκε στις 17 Δεκεμβρίου 2013.
- ↑ «FDA Drug Safety Communication: Safety Review Update of Medications used to treat Attention-Deficit/Hyperactivity Disorder (ADHD) in children and young adults». United States Food and Drug Administration. 20 Δεκεμβρίου 2011. Αρχειοθετήθηκε από το πρωτότυπο στις 30 Οκτωβρίου 2013. Ανακτήθηκε στις 4 Νοεμβρίου 2013.
• «ADHD drugs and serious cardiovascular events in children and young adults». N. Engl. J. Med. 365 (20): 1896–1904. November 2011. doi:. PMID 22043968.
• «FDA Drug Safety Communication: Safety Review Update of Medications used to treat Attention-Deficit/Hyperactivity Disorder (ADHD) in adults». United States Food and Drug Administration. 15 Δεκεμβρίου 2011. Αρχειοθετήθηκε από το πρωτότυπο στις 30 Οκτωβρίου 2013. Ανακτήθηκε στις 4 Νοεμβρίου 2013.
• «ADHD medications and risk of serious cardiovascular events in young and middle-aged adults». JAMA 306 (24): 2673–2683. December 2011. doi:. PMID 22161946. - ↑ «Attention deficit hyperactivity disorder: possible causes and treatment». International Journal of Clinical Practice 53 (7): 524–8. 1999. PMID 10692738.
- ↑ «Methylphenidate for attention deficit hyperactivity disorder (ADHD) in children and adolescents - assessment of adverse events in non-randomised studies». The Cochrane Database of Systematic Reviews 5: CD012069. May 2018. doi:. PMID 29744873.
- ↑ «Methylphenidate hydrochloride (PIM 344)». INCHEM. International Programme on Chemical Safety. Αρχειοθετήθηκε από το πρωτότυπο στις 23 Ιουνίου 2015. Ανακτήθηκε στις 23 Ιουνίου 2015.
- ↑ 69,0 69,1 «Overdose of drugs for attention-deficit hyperactivity disorder: clinical presentation, mechanisms of toxicity, and management». CNS Drugs 27 (7): 531–543. June 2013. doi:. PMID 23757186. «The management of amphetamine, dextroamphetamine, and methylphenidate overdose is largely supportive, with a focus on interruption of the sympathomimetic syndrome with judicious use of benzodiazepines. In cases where agitation, delirium, and movement disorders are unresponsive to benzodiazepines, second-line therapies include antipsychotics such as ziprasidone or haloperidol, central alpha-adrenoreceptor agonists such as dexmedetomidine, or propofol. ... However, fatalities are rare with appropriate care».
- ↑ «Severe toxicity due to injected but not oral or nasal abuse of methylphenidate tablets». Swiss Med Wkly 141: w13267. 2011. doi:. PMID 21984207.
- ↑ «Methylphenidate Abuse and Psychiatric Side Effects». Prim Care Companion J Clin Psychiatry 2 (5): 159–164. 2000. doi:. PMID 15014637.
- ↑ 72,0 72,1 «Chapter 15: Reinforcement and Addictive Disorders». Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd έκδοση). New York: McGraw-Hill Medical. 2009. σελ. 368. ISBN 9780071481274.
Cocaine, [amphetamine], and methamphetamine are the major psychostimulants of abuse. The related drug methylphenidate is also abused, although it is far less potent. These drugs elicit similar initial subjective effects ; differences generally reflect the route of administration and other pharmacokinetic factors. Such agents also have important therapeutic uses; cocaine, for example, is used as a local anesthetic (Chapter 2), and amphetamines and methylphenidate are used in low doses to treat attention deficit hyperactivity disorder and in higher doses to treat narcolepsy (Chapter 12). Despite their clinical uses, these drugs are strongly reinforcing, and their long-term use at high doses is linked with potential addiction, especially when they are rapidly administered or when high-potency forms are given.
- ↑ «Risks of high-dose stimulants in the treatment of disorders of excessive somnolence: a case-control study». Sleep 28 (6): 667–72. 2005. doi:. PMID 16477952.
- ↑ «Addiction-related gene regulation: risks of exposure to cognitive enhancers vs. other psychostimulants». Prog. Neurobiol. 100: 60–80. January 2013. doi:. PMID 23085425.
- ↑ 75,0 75,1 «Methylphenidate-induced dendritic spine formation and DeltaFosB expression in nucleus accumbens». Proc. Natl. Acad. Sci. U.S.A. 106 (8): 2915–20. 2009. doi:. PMID 19202072. Bibcode: 2009PNAS..106.2915K. «Despite decades of clinical use of methylphenidate for ADHD, concerns have been raised that long-term treatment of children with this medication may result in subsequent drug abuse and addiction. However, meta analysis of available data suggests that treatment of ADHD with stimulant drugs may have a significant protective effect, reducing the risk for addictive substance use (36, 37). Studies with juvenile rats have also indicated that repeated exposure to methylphenidate does not necessarily lead to enhanced drug-seeking behavior in adulthood (38). However, the recent increase of methylphenidate use as a cognitive enhancer by the general public has again raised concerns because of its potential for abuse and addiction (3, 6–10). Thus, although oral administration of clinical doses of methylphenidate is not associated with euphoria or with abuse problems, nontherapeutic use of high doses or i.v. administration may lead to addiction (39, 40).».
- ↑ «Pharmacotherapy of methamphetamine addiction: an update». Substance Abuse 29 (3): 31–49. 2008. doi:. PMID 19042205.
- ↑ «Replacement medication for cocaine dependence: methylphenidate». Journal of Clinical Psychopharmacology 17 (6): 485–8. December 1997. doi:. PMID 9408812.
- ↑ «Agents in development for the management of cocaine abuse». Drugs 64 (14): 1547–73. 2004. doi:. PMID 15233592. Αρχειοθετήθηκε από το πρωτότυπο στις 1 July 2019. https://web.archive.org/web/20190701002920/https://zenodo.org/record/1236415. Ανακτήθηκε στις 1 July 2019.
- ↑ «New treatments for cocaine dependence: a focused review». The International Journal of Neuropsychopharmacology 11 (3): 425–38. May 2008. doi:. PMID 17927843.
- ↑ «NIDA InfoFacts: Understanding Drug Abuse and Addiction» (PDF). 2008. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 15 Δεκεμβρίου 2010.
- ↑ «The principles of agonist pharmacotherapy for psychostimulant dependence». Drug and Alcohol Review 27 (3): 301–8. May 2008. doi:. PMID 18368612.
- ↑ «Cellular basis of memory for addiction». Dialogues in Clinical Neuroscience 15 (4): 431–43. December 2013. PMID 24459410. «Despite the importance of numerous psychosocial factors, at its core, drug addiction involves a biological process: the ability of repeated exposure to a drug of abuse to induce changes in a vulnerable brain that drive the compulsive seeking and taking of drugs, and loss of control over drug use, that define a state of addiction. ... A large body of literature has demonstrated that such ΔFosB induction in D1-type NAc neurons increases an animal's sensitivity to drug as well as natural rewards and promotes drug self-administration, presumably through a process of positive reinforcement ... Another ΔFosB target is cFos: as ΔFosB accumulates with repeated drug exposure it represses c-Fos and contributes to the molecular switch whereby ΔFosB is selectively induced in the chronic drug-treated state.41. ... Moreover, there is increasing evidence that, despite a range of genetic risks for addiction across the population, exposure to sufficiently high doses of a drug for long periods of time can transform someone who has relatively lower genetic loading into an addict.4».
- ↑ «Molecular neurobiology of addiction: what's all the (Δ)FosB about?». The American Journal of Drug and Alcohol Abuse 40 (6): 428–37. November 2014. doi:. PMID 25083822. «
The strong correlation between chronic drug exposure and ΔFosB provides novel opportunities for targeted therapies in addiction (118), and suggests methods to analyze their efficacy (119). Over the past two decades, research has progressed from identifying ΔFosB induction to investigating its subsequent action (38). It is likely that ΔFosB research will now progress into a new era – the use of ΔFosB as a biomarker. ...
Conclusions
Πρότυπο:In5ΔFosB is an essential transcription factor implicated in the molecular and behavioral pathways of addiction following repeated drug exposure. The formation of ΔFosB in multiple brain regions, and the molecular pathway leading to the formation of AP-1 complexes is well understood. The establishment of a functional purpose for ΔFosB has allowed further determination as to some of the key aspects of its molecular cascades, involving effectors such as GluR2 (87,88), Cdk5 (93) and NFkB (100). Moreover, many of these molecular changes identified are now directly linked to the structural, physiological and behavioral changes observed following chronic drug exposure (60,95,97,102). New frontiers of research investigating the molecular roles of ΔFosB have been opened by epigenetic studies, and recent advances have illustrated the role of ΔFosB acting on DNA and histones, truly as a molecular switch (34). As a consequence of our improved understanding of ΔFosB in addiction, it is possible to evaluate the addictive potential of current medications (119), as well as use it as a biomarker for assessing the efficacy of therapeutic interventions (121,122,124). Some of these proposed interventions have limitations (125) or are in their infancy (75). However, it is hoped that some of these preliminary findings may lead to innovative treatments, which are much needed in addiction.».
• «Epigenetic regulation in drug addiction». Annals of Agricultural and Environmental Medicine 19 (3): 491–6. 2012. PMID 23020045. «For these reasons, ΔFosB is considered a primary and causative transcription factor in creating new neural connections in the reward centre, prefrontal cortex, and other regions of the limbic system. This is reflected in the increased, stable and long-lasting level of sensitivity to cocaine and other drugs, and tendency to relapse even after long periods of abstinence. These newly constructed networks function very efficiently via new pathways as soon as drugs of abuse are further taken ... In this way, the induction of CDK5 gene expression occurs together with suppression of the G9A gene coding for dimethyltransferase acting on the histone H3. A feedback mechanism can be observed in the regulation of these 2 crucial factors that determine the adaptive epigenetic response to cocaine. This depends on ΔFosB inhibiting G9a gene expression, i.e. H3K9me2 synthesis which in turn inhibits transcription factors for ΔFosB. For this reason, the observed hyper-expression of G9a, which ensures high levels of the dimethylated form of histone H3, eliminates the neuronal structural and plasticity effects caused by cocaine by means of this feedback which blocks ΔFosB transcription».
• «Transcriptional and epigenetic mechanisms of addiction». Nature Reviews. Neuroscience 12 (11): 623–37. October 2011. doi:. PMID 21989194. «ΔFosB has been linked directly to several addiction-related behaviors ... Importantly, genetic or viral overexpression of ΔJunD, a dominant negative mutant of JunD which antagonizes ΔFosB- and other AP-1-mediated transcriptional activity, in the NAc or OFC blocks these key effects of drug exposure14,22–24. This indicates that ΔFosB is both necessary and sufficient for many of the changes wrought in the brain by chronic drug exposure. ΔFosB is also induced in D1-type NAc MSNs by chronic consumption of several natural rewards, including sucrose, high fat food, sex, wheel running, where it promotes that consumption14,26–30. This implicates ΔFosB in the regulation of natural rewards under normal conditions and perhaps during pathological addictive-like states.». - ↑ «Concerta product monograph» (PDF). Janssen Pharmaceuticals. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 28 Ιανουαρίου 2017. Ανακτήθηκε στις 4 Δεκεμβρίου 2016.
- ↑ «Serotonin syndrome induced by augmentation of SSRI with methylphenidate». Psychiatry and Clinical Neurosciences 62 (2): 246. April 2008. doi:. PMID 18412855.
- ↑ «Serotonin syndrome with sertraline and methylphenidate in an adolescent». Clinical Neuropharmacology 38 (2): 65–6. 2015. doi:. PMID 25768857.
- ↑ «Manic switch and serotonin syndrome induced by augmentation of paroxetine with methylphenidate in a patient with major depression». Progress in Neuro-Psychopharmacology & Biological Psychiatry 34 (4): 719–20. May 2010. doi:. PMID 20298736.
- ↑ «Serotonin syndrome». Neurology 45 (2): 219–23. February 1995. doi:. PMID 7854515. https://archive.org/details/sim_neurology_1995-02_45_2/page/219.
- ↑ «New methylphenidate formulations for the treatment of attention-deficit/hyperactivity disorder». Expert Opinion on Drug Delivery 2 (1): 121–43. 2005. doi:. PMID 16296740.
- ↑ «Ethylphenidate formation in human subjects after the administration of a single dose of methylphenidate and ethanol». Drug Metabolism and Disposition 28 (6): 620–4. 2000. PMID 10820132.
- ↑ 91,0 91,1 «Detection of the novel metabolite ethylphenidate after methylphenidate overdose with alcohol coingestion». Journal of Clinical Psychopharmacology 19 (4): 362–6. 1999. doi:. PMID 10440465.
- ↑ «Influence of ethanol and gender on methylphenidate pharmacokinetics and pharmacodynamics.». Clinical Pharmacology and Therapeutics 81 (3): 346–53. March 2007. doi:. PMID 17339864. PMC 3188424. https://archive.org/details/sim_clinical-pharmacology-and-therapeutics_2007-03_81_3/page/346.
- ↑ «Adrenergic modulation of hepatotoxicity». Drug Metab. Rev. 29 (1–2): 329–53. 1997. doi:. PMID 9187524.
- ↑ «Chapter 6: Widely Projecting Systems: Monoamines, Acetylcholine, and Orexin». Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd έκδοση). New York: McGraw-Hill Medical. 2009. σελίδες 154–157. ISBN 9780071481274.
- ↑ «A randomized, controlled effectiveness trial of OROS-methylphenidate compared to usual care with immediate-release methylphenidate in attention deficit-hyperactivity disorder». Can J Clin Pharmacol 13 (1): e50–62. 2006. PMID 16456216. Αρχειοθετήθηκε από το πρωτότυπο στις 15 December 2011. http://webarchive.nationalarchives.gov.uk/20111215210932/http%3A//www.cjcp.ca/CJCP_05%2D012_e50%2Dr101628.
- ↑ 96,0 96,1 96,2 «Methylphenidate and its isomers: their role in the treatment of attention-deficit hyperactivity disorder using a transdermal delivery system». CNS Drugs 20 (9): 713–38. 2006. doi:. PMID 16953648.
- ↑ «Neurotransmitter transporters and their impact on the development of psychopharmacology». British Journal of Pharmacology 147 Suppl 1 (Suppl 1): S82-8. January 2006. doi:. PMID 16402124.
- ↑ «Mechanism of action of methylphenidate: insights from PET imaging studies». Journal of Attention Disorders 6 Suppl 1: S31-43. 1 January 2002. doi:. PMID 12685517.
- ↑ «Amfetamine and methylphenidate medications for attention-deficit/hyperactivity disorder: complementary treatment options». European Child & Adolescent Psychiatry 21 (9): 477–92. September 2012. doi:. PMID 22763750.
- ↑ «Meta-analysis of functional magnetic resonance imaging studies of inhibition and attention in attention-deficit/hyperactivity disorder: exploring task-specific, stimulant medication, and age effects». JAMA Psychiatry 70 (2): 185–98. February 2013. doi:. PMID 23247506. https://archive.org/details/sim_jama-psychiatry_2013-02_70_2/page/185.
- ↑ «Effect of psychostimulants on brain structure and function in ADHD: a qualitative literature review of magnetic resonance imaging-based neuroimaging studies». The Journal of Clinical Psychiatry 74 (9): 902–17. September 2013. doi:. PMID 24107764. PMC 3801446. https://archive.org/details/sim_journal-of-clinical-psychiatry_2013-09_74_9/page/902.
- ↑ «Meta-analysis of structural MRI studies in children and adults with attention deficit hyperactivity disorder indicates treatment effects». Acta Psychiatrica Scandinavica 125 (2): 114–26. February 2012. doi:. PMID 22118249. «Basal ganglia regions like the right globus pallidus, the right putamen, and the nucleus caudatus are structurally affected in children with ADHD. These changes and alterations in limbic regions like ACC and amygdala are more pronounced in non-treated populations and seem to diminish over time from child to adulthood. Treatment seems to have positive effects on brain structure.».
- ↑ «Dysfunctions in dopamine systems and ADHD: evidence from animals and modeling». Neural Plasticity 11 (1–2): 102, 106–107. 2004. doi:. PMID 15303308.
- ↑ «Focalin XR». RxList.
- ↑ «Focalin XR – Full Prescribing Information» (PDF). Novartis. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 14 Ιουλίου 2011.
- ↑ «Concerta XL 18 mg – 54 mg prolonged release tablets». eMC. Αρχειοθετήθηκε από το πρωτότυπο στις 17 Οκτωβρίου 2017.
- ↑ 107,0 107,1 «The emerging role of trace amine-associated receptor 1 in the functional regulation of monoamine transporters and dopaminergic activity». Journal of Neurochemistry 116 (2): 164–76. January 2011. doi:. PMID 21073468.
- ↑ «VMAT2: a dynamic regulator of brain monoaminergic neuronal function interacting with drugs of abuse». Ann. N. Y. Acad. Sci. 1216 (1): 86–98. January 2011. doi:. PMID 21272013. Bibcode: 2011NYASA1216...86E. «VMAT2 is the CNS vesicular transporter for not only the biogenic amines DA, NE, EPI, 5-HT, and HIS, but likely also for the trace amines TYR, PEA, and thyronamine (THYR) ... AMPH release of DA from synapses requires both an action at VMAT2 to release DA to the cytoplasm and a concerted release of DA from the cytoplasm via “reverse transport” through DAT.».
- ↑ «Striatal dopamine neurotransmission: regulation of release and uptake». Basal Ganglia 6 (3): 123–148. August 2016. doi:. PMID 27141430. «Despite the challenges in determining synaptic vesicle pH, the proton gradient across the vesicle membrane is of fundamental importance for its function. Exposure of isolated catecholamine vesicles to protonophores collapses the pH gradient and rapidly redistributes transmitter from inside to outside the vesicle. ... Amphetamine and its derivatives like methamphetamine are weak base compounds that are the only widely used class of drugs known to elicit transmitter release by a non-exocytic mechanism. As substrates for both DAT and VMAT, amphetamines can be taken up to the cytosol and then sequestered in vesicles, where they act to collapse the vesicular pH gradient.».
- ↑ «A comprehensive in vitro screening of d-, l-, and dl-threo-methylphenidate: an exploratory study». Journal of Child and Adolescent Psychopharmacology 16 (6): 687–98. December 2006. doi:. PMID 17201613. https://semanticscholar.org/paper/adb71af0b909e4a96f605266ca1a77df368985ad.
- ↑ «The psychostimulant d-threo-(R,R)-methylphenidate binds as an agonist to the 5HT(1A) receptor». Die Pharmazie 64 (2): 123–5. February 2009. PMID 19322953.
- ↑ «Neuropharmacological mechanisms underlying the neuroprotective effects of methylphenidate». Current Neuropharmacology 6 (4): 379–85. December 2008. doi:. PMID 19587858.
- ↑ «Concerta». Drugs.com. 1 Οκτωβρίου 2018. Αρχειοθετήθηκε από το πρωτότυπο στις 29 Σεπτεμβρίου 2018. Ανακτήθηκε στις 11 Μαρτίου 2019.
- ↑ 114,0 114,1 «FDA» (PDF). Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 10 Φεβρουαρίου 2017. Ανακτήθηκε στις 30 Ιανουαρίου 2019.
- ↑ «Methylphenidate hydrochloride given with or before breakfast: II. Effects on plasma concentration of methylphenidate and ritalinic acid». Pediatrics 72 (1): 56–59. 1983. PMID 6866592. https://archive.org/details/sim_pediatrics_1983-07_72_1/page/56.
- ↑ https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/205489s000lbl.pdf
- ↑ https://www.trispharma.com/generic/Quillivant_XR_08_2018_FINAL_for_Website_Jan_22_2019.pdf#page15
- ↑ «Methylphenidate is stereoselectively hydrolyzed by human carboxylesterase CES1A1». The Journal of Pharmacology and Experimental Therapeutics 310 (2): 469–76. August 2004. doi:. PMID 15082749. https://archive.org/details/sim_journal-of-pharmacology-and-experimental-therapeutics_2004-08_310_2/page/469.
- ↑ «Conformational analysis of methylphenidate and its structural relationship to other dopamine reuptake blockers such as CFT». Pharmaceutical Research 12 (10): 1430–4. October 1995. doi:. PMID 8584475. https://archive.org/details/sim_pharmaceutical-research_1995-10_12_10/page/1430.
- ↑ «Approaches to the Preparation of Enantiomerically Pure (2R,2′R)-(+)-threo-Methylphenidate Hydrochloride». Adv. Synth. Catal. 343 (5): 379–92. 2001. doi:.
- ↑ R. Baselt, Disposition of Toxic Drugs and Chemicals in Man, 9th edition, Biomedical Publications, Seal Beach, CA, 2011, pp. 1091–93.
- ↑ Panizzon L (1944). «La preparazione di piridile piperidil-arilacetonitrili e di alcuni prodotti di trasformazione (Parte Ia)». Helvetica Chimica Acta 27: 1748–56. doi:.
- ↑ «[Ritalin, a new synthetic compound with specific analeptic components]». Klinische Wochenschrift 32 (19–20): 445–50. May 1954. doi:. PMID 13164273.
- ↑ Myers, Richard Leroy (1 Ιανουαρίου 2007). The 100 Most Important Chemical Compounds: A Reference Guide. ABC-CLIO. σελ. 178. ISBN 9780313337581. Ανακτήθηκε στις 24 Σεπτεμβρίου 2016.
- ↑ Leandro Panizzon et al Pyridine and piperdjine compounds U.S. Patent 2,507,631 Issue date: 16 May 1950
- ↑ Rudolf Rouietscji et al Process for the conversion of U.S. Patent 2.838.519 Issue date: 10 June 1958
- ↑ Rudolf Rouietscji et alProcess for the conversion of U.S. Patent 2,957,880 Issue date: 25 October 1960
- ↑ Myers, Richard L (Αυγούστου 2007). The 100 most important chemical compounds: a reference guide. ABC-CLIO. σελ. 178. ISBN 978-0-313-33758-1. Ανακτήθηκε στις 10 Σεπτεμβρίου 2010.
named ritalin after his wife.
- ↑ Stolerman, Ian (2010). Encyclopedia of psychopharmacology. Berlin London: Springer. σελ. 763. ISBN 978-3540686989.
- ↑ «Ritalin and Attention Deficit Disorder: History of its Use, Effects and Side Effects» (PDF). 1995. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 24 Αυγούστου 2012. Ανακτήθηκε στις 22 Ιουλίου 2014.
- ↑ Bradley, Charles. Benzedrine® and Dexedrine® in the Treatment of Children's Behavior Disorders. Pediatrics 1950; 5:1 24–37
- ↑ Woodworth, Terrance (16 Μαΐου 2000). «DEA Congressional Testimony». Αρχειοθετήθηκε από το πρωτότυπο στις 12 Οκτωβρίου 2007. Ανακτήθηκε στις 2 Νοεμβρίου 2007.
- ↑ «The Evergreening of Biopharmaceuticals: Time to Defoliate». Journal of Clinical Pharmacology 56 (4): 383–9. April 2016. doi:. PMID 26388527.
- ↑ «Green List: Annex to the annual statistical report on psychotropic substances (form P)» (PDF). Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 31 Αυγούστου 2012. (1.63 MB) 23rd edition. August 2003. International Narcotics Board, Vienna International Centre. Retrieved 2 March 2006.
- ↑ «Misuse of Drugs Act 1971 (c. 38): SCHEDULE 2: Controlled Drugs». Office of Public Sector Information. Ανακτήθηκε στις 15 Ιουνίου 2009.
- ↑ «Controlled Drugs and Substances Act (S.C. 1996, c. 19)». 25 Απριλίου 2017. Αρχειοθετήθηκε από το πρωτότυπο στις 3 Απριλίου 2011. Ανακτήθηκε στις 26 Απριλίου 2017.
- ↑ «Poisons Standard 2012 as amended made under paragraph 52D(2)(a) of the Therapeutic Goods Act 1989». Therapeutic Goods Administration. 27 Νοεμβρίου 2014. Αρχειοθετήθηκε από το πρωτότυπο στις 1 Ιουλίου 2015. Ανακτήθηκε στις 28 Ιουνίου 2015.
- ↑ «Decree of the Government of Russian Federation on 25 October 2014 № 1102» (PDF). Ανακτήθηκε στις 17 Οκτωβρίου 2019.
- ↑ «Narkotikastrafflag (1968:64)». Ministry of Justice. Αρχειοθετήθηκε από το πρωτότυπο στις 6 Οκτωβρίου 2013. Ανακτήθηκε στις 15 Ιανουαρίου 2014.
- ↑ «Paediatric methylphenidate (Ritalin) restrictive conditions of prescription in France». Br J Clin Pharmacol 57 (1): 115–6. January 2004. doi:. PMID 14678352. PMC 1884413. https://archive.org/details/sim_british-journal-of-clinical-pharmacology_2004-01_57_1/page/115.
- ↑ «The Drugs and Cosmetics Rules, 1945». Ministry of Health & Family Welfare. Government of India. 15 Αυγούστου 2013. σελίδες 729–730. Αρχειοθετήθηκε από το πρωτότυπο στις 8 Αυγούστου 2016. Ανακτήθηκε στις 5 Δεκεμβρίου 2016.
- ↑ «Drug Law Enforcement Field Officers' Hand Book» (PDF). Ministry of Home Affairs, Government of India. σελ. 145. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 5 Μαρτίου 2017. Ανακτήθηκε στις 5 Δεκεμβρίου 2016.
- ↑ «Hong Kong e-Legislation».
- ↑ «The impact of prescribed psychotropics on youth». Clin Pract Epidemiol Ment Health 3 (1): 21. 2007. doi:. PMID 17949504.
- ↑ «New Research Helps Explain Ritalin's Low Abuse Potential When Taken As Prescribed». NIH.gov. 29 Σεπτεμβρίου 1998. Αρχειοθετήθηκε από το πρωτότυπο στις 28 Μαΐου 2010. Ανακτήθηκε στις 30 Απριλίου 2011.
- ↑ «Stimulant ADHD Medications: Methylphenidate and Amphetamines». Drugabuse.gov. Αρχειοθετήθηκε από το πρωτότυπο στις 26 Μαρτίου 2010. Ανακτήθηκε στις 30 Απριλίου 2011.
- ↑ «Stimulant treatment of ADHD and cigarette smoking: a meta-analysis». Pediatrics 133 (6): 1070–80. June 2014. doi:. PMID 24819571.
- ↑ «Use of drugs for ADHD among adults-a multinational study among 15.8 million adults in the Nordic countries». European Journal of Clinical Pharmacology 72 (12): 1507–1514. December 2016. doi:. PMID 27586399.
- ↑ «Prevalent intravenous abuse of methylphenidate among treatment-seeking patients with substance abuse disorders: a descriptive population-based study». Journal of Addiction Medicine 9 (3): 188–94. 29 November 2016. doi:. PMID 25748561.