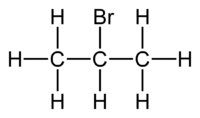
2-βρωμοπροπάνιο
| 2-βρωμοπροπάνιο | |||
|---|---|---|---|

| |||
| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | 2-βρωμοπροπάνιο | ||
| Άλλες ονομασίες | Ισοπροπυλοβρωμίδιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C3H7Br | ||
| Μοριακή μάζα | 122,99 amu | ||
| Σύντομος συντακτικός τύπος |
CH3CH2CH2Br | ||
| Συντομογραφίες | iPrBr, 2-BP | ||
| Αριθμός CAS | 75-26-3 | ||
| SMILES | CC(Br)C | ||
| InChI | 1S/C3H7Br/c1-3(2)4/h3H,1-2H3 | ||
| Αριθμός EINECS | 200-855-1 | ||
| Αριθμός RTECS | TX4111000 | ||
| Αριθμός UN | 2344 | ||
| PubChem CID | 6358 | ||
| ChemSpider ID | 6118 | ||
| Δομή | |||
| Ισομέρεια | |||
| Ισομερή θέσης | 1 1-βρωμοπροπάνιο | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -90 °C | ||
| Σημείο βρασμού | 59,4 °C | ||
| Πυκνότητα | 1.310 kg/m3 | ||
| Διαλυτότητα στο νερό |
3,2 kg/m3 (20 °C) | ||
| Διαλυτότητα σε άλλους διαλύτες |
Πλήρως διαλυτό σε αιθανόλη διαιθυλαιθέρα. | ||
| Ιξώδες | 6,106 cP (0 °C) 4,894 cP (20 °C) | ||
| Δείκτης διάθλασης , nD |
1,4251 | ||
| Εμφάνιση | Άχρωμο υγρό | ||
| Χημικές ιδιότητες | |||
| Ελάχιστη θερμοκρασία ανάφλεξης |
19 °C | ||
| Επικινδυνότητα | |||
 
| |||
| Φράσεις κινδύνου | R10 R20 R36 R37 R38 | ||
| Φράσεις ασφαλείας | S16, S45 | ||
| LD50 | 483,7 mg/kg[1] | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το 2-βρωμοπροπάνιο ή ισοπροπυλοβρωμίδιο είναι μια χημική ένωση με χημικό τύπο C3H7Br. Ανήκει στην ομόλογη σειρά των αλκυλαλογονιδίων. Στην εμφάνιση είναι ένα άχρωμο υγρό, στις συνηθισμένες συνθήκες (T = 25 °C, P = 1 atm). Έχει ένα (1) μόνο ισομερές θέσης, το 1-βρωμοπροπάνιο. Χρησιμοποιήθηκε σε οργανικές συνθέσεις, αξιοποιώντας τη δυνατότητά του να προσθέτει την ισοπροπυλομάδα σε διάφορες ενώσεις.
Ονοματολογία
[Επεξεργασία | επεξεργασία κώδικα]Η ονομασία «2-βρωμοπροπάνιο» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα «προπ-» δηλώνει την παρουσία τριών (3) ατόμων άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-αν-» δείχνει την παρουσία μόνο απλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-ιο» φανερώνει ότι δεν περιέχει χαρακτηριστικές ομάδες που έχουν χαρακτηριστικές καταλήξεις. Το αρχικό πρόθεμα «βρωμο-» δηλώνει την παρουσία ενός (1) ατόμου βρωμίου ανά μόριο της ένωσης. Τέλος, ο αριθμός θέσης «2-» δηλώνει ότι το άτομο του βρωμίου ενώνεται το μεσαίο (#2) άτομο άνθρακα της ανθρακικής του αλυσίδας.
Μοριακή δομή
[Επεξεργασία | επεξεργασία κώδικα]| Δεσμοί[2] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C-C | σ | 2sp3-2sp3 | 154 pm | |
| C-Br | σ | 2sp3-4sp3 | 191 pm | 2% C+ Br- |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| H | +0,03 | |||
| C#2 | -0,01 | |||
| Br | -0,02 | |||
| C#1,#3 | -0,09 | |||
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Με φωτοχημική βρωμίωση
[Επεξεργασία | επεξεργασία κώδικα]Με φωτοχημική βρωμίωση προπανίου παράγεται μίγμα των δύο ισομερών βρωμοπροπανίων[3]:
- Ακολουθεί το συνηθισμένο μηχανισμό φωτοχημικής αλογόνωσης αλκανίων. Παράγονται και πολυβρωμοπαράγωγα. Η συγκέντρωση των τελευταίων περιορίζεται με χρήση περίσσειας προπανίου.
- Η αναφερόμενη στοιχειομετρική αναλογία παραγωγής χλωροπροπανίων δεν συνυπολογίζει τα συμπαραγόμενα πολυβρωμοπαράγωγα.
- Η μέθοδος δεν είναι χρήσιμη αν επιθυμείται το ένα μόνο ισομερές, αφού είναι σχετικά δύσκολος ο διαχωρισμός τους.
Υποκατάσταση υδροξυλίου από βρώμιο
[Επεξεργασία | επεξεργασία κώδικα]1. Με επίδραση υδροβρωμίου (HCl) σε 2-προπανόλη[4]:
2. Η υποκατάσταση του OH από Br στη 2-προπανόλη μπορεί να γίνει και με βρωμιωτικά μέσα[5] Με τριβρωμιούχο φωσφόρο (PCl3)[6]:
Προσθήκη υδροβρωμίου σε προπένιο
[Επεξεργασία | επεξεργασία κώδικα]Με προσθήκη υδροβρωμίου σε προπένιο παράγεται 2-βρωμοπροπάνιο:
Με αποικοδόμηση τύπου Hunsdiecker
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση βρωμίου σε μεθυλοπροπανικό άργυρο παράγεται 2-βρωμοπροπάνιο - Αντίδραση Hunsdiecker[7]:
Χημικές ιδιότητες και παράγωγα
[Επεξεργασία | επεξεργασία κώδικα]Αντιδράσεις υποκατάστασης
[Επεξεργασία | επεξεργασία κώδικα]- Οι αντιδράσεις είναι πιο γρήγορες σε σύγκριση με τα αντίστοιχα αλκυλαλογονίδια των άλλων αλογόνων, πλην του ιωδίου.
Υποκατάσταση από υδροξύλιο
[Επεξεργασία | επεξεργασία κώδικα]Κατά την υδρόλυσή του με εναιώρημα υδροξειδίου του αργύρου (AgOH) σχηματίζεται προπανόλη-2 [8]:
Υποκατάσταση από αλκοξύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με αλκοολικά άλατα (RONa) σχηματίζει αλκυλισοπροπυλαιθέρα (CH3CH2CH2OR)[8]:
Υποκατάσταση από αλκινύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με αλκινικά άλατα (RC≡CNa) σχηματίζει αλκίνιο. Π.χ.[8]:
Υποκατάσταση από ακύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με καρβονικά άλατα (RCOONa) σχηματίζει καρβονικό ισοπροπυλεστέρα [8]:
Υποκατάσταση από κυάνιο
[Επεξεργασία | επεξεργασία κώδικα]Με κυανιούχο νάτριο (NaCN) σχηματίζει μεθυλοπροπανονιτρίλιο[8]:
Υποκατάσταση από αλκύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με αλκυλολίθιο (RLi) σχηματίζει αλκάνιο[8]:
Υποκατάσταση από σουλφυδρίλιο
[Επεξεργασία | επεξεργασία κώδικα]Με όξινο θειούχο νάτριο (NaSH) σχηματίζει προπανοθειόλη-2[8]:
Υποκατάσταση από σουλφαλκύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με θειολικό νάτριο (RSNa) σχηματίζει αλκυλισοπροπυλθειαιθέρα [8]:
Υποκατάσταση από ιώδιο
[Επεξεργασία | επεξεργασία κώδικα]Με ιωδιούχο νάτριο (NaI) σχηματίζει 2-ιωδοπροπάνιο[8]:
Υποκατάσταση από φθόριο
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση φθοριούχου υφυδραργύρου (Hg2F2) σε 2-βρωμοπροπάνιο (CH3CH2Br) παράγεται 2-φθοροπροπάνιο[9]:
Υποκατάσταση από αμινομάδα
[Επεξεργασία | επεξεργασία κώδικα]Με αμμωνία (NH3) σχηματίζει προπαναμίνη-2[8]:
Υποκατάσταση από αλκυλαμινομάδα
[Επεξεργασία | επεξεργασία κώδικα]Με πρωυτοταγείς αμίνες (RNH2) σχηματίζει αλκυλισοπροπυλαμίνη[8]:
Υποκατάσταση από διαλκυλαμινομάδα
[Επεξεργασία | επεξεργασία κώδικα]Με δευτεροταγείς αμίνες (R'NHR) σχηματίζει διαλκυλισοπροπυλαμίνη[8]:
Υποκατάσταση από τριαλκυλαμινομάδα
[Επεξεργασία | επεξεργασία κώδικα]Με τριτοταγείς αμίνες [R'N(R)R"] σχηματίζει βρωμιούχο ισοπροπυλoτριαλκυλαμμώνιο [10]:
Υποκατάσταση από φωσφύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με φωσφίνη σχηματίζει προπανοφωσφαμίνη-2[11]:
Υποκατάσταση από νιτροομάδα
[Επεξεργασία | επεξεργασία κώδικα]Με νιτρώδη άργυρο (AgNO2) σχηματίζει 2-νιτροπροπάνιο [12]:
Υποκατάσταση από φαινύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση τύπου Friedel-Crafts σε βενζολίου παράγεται 2-φαινυλοπροπάνιο:
Παραγωγή οργανομεταλλικών ενώσεων
[Επεξεργασία | επεξεργασία κώδικα]1. Με λίθιο (Li). Παράγεται ισοπροπυλολίθιο[13]:
2. Με μαγνήσιο (Mg) (αντιδραστήριο Grignard)[14]:
Αναγωγή
[Επεξεργασία | επεξεργασία κώδικα]1. Με λιθιοαργιλλιοϋδρίδιο (LiAlH4) παράγεται προπάνιο[15]:
2. Με «υδρογόνο εν τω γενάσθαι», δηλαδή μέταλλο + οξύ παράγεται προπάνιο[16]:
3. Με σιλάνιο, παρουσία τριφθοριούχου βορίου, παράγεται προπάνιο[17]:
4. Αναγωγή από ένα αλκυλοκασσιτεράνιο. Π.χ.[18]:
Αντιδράσεις προσθήκης
[Επεξεργασία | επεξεργασία κώδικα]1. Σε αλκένια. Π.χ. με αιθένιο (CH2=CH2) παράγει 1-βρωμο-3-μεθυλοβουτάνιο[19]:
2. Σε αλκίνια. Π.χ. με αιθίνιο (HC≡CH) παράγει 1-βρωμο-3-μεθυλο-1-βουτένιο[20]:
3. Η αντίδραση του 2-βρωμοπροπανίου με συζυγή αλκαδιένια αντιστοιχεί κυρίως σε 1,4-προσθήκη, αν και είναι επίσης δυνατές η 1,2-προσθήκη και η 3,4-προσθήκη, με τη χρήση κατάλληλων συνθηκών. Π.χ.[21]:
(1,4-προσθήκη)
(1,2-προσθήκη)
(3,4-προσθήκη)
4. Σε κυκλοαλκάνια που έχουν τριμελή ή τετραμελή δακτύλιο. Π.χ. με κυκλοπροπάνιο παράγει 1-βρωμο-4-μεθυλοπεντάνιο[21]:
5. Σε ετεροκυκλικές ενώσεις που έχουν τριμελή ή τετραμελή δακτύλιο. Π.χ. με εποξυαιθάνιο παράγει 2-βρωμισοπροποξυαιθάνιο[22]:
Αντίδραση απόσπασης
[Επεξεργασία | επεξεργασία κώδικα]Με απόσπαση υδροβρωμίου (HBr) από 2-βρωμοπροπάνιο παράγεται προπένιο[23]:
- Επειδή το παραγώμενο προπένιο είναι αέριο, συχνά χρησιμοποιούνται ασθενείς βάσεις, όπως το ανθρακικό κάλιο στη θέση ισχυρότερων.
Παρεμβολή καρβενίων
[Επεξεργασία | επεξεργασία κώδικα]
- Η αντίδραση είναι ελάχιστα εκλεκτική και αυτό σημαίνει ότι κατά προσέγγιση έχουμε:
- 1. Παρεμβολή στους έξι (3) δεσμούς C#1,#3H2-H. Παράγεται 2-βρωμοβουτάνιο.
- 2. Παρεμβολή στον ένα (1) δεσμό C#2-H: 2. Παράγεται 2-βρωμο-μεθυλοπροπάνιο.
Προκύπτει επομένως μίγμα 2-βρωμοβουτάνιου ~86% και 2-βρωμομεθυλοπροπάνιου 14%.
Ασφάλεια
[Επεξεργασία | επεξεργασία κώδικα]Ως αλκυλιωτικό αντιδραστήριο θεωρείται ως πιθανό καρκινογόνο.
Σημειώσεις και αναφορές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Διαδικτυακός τόπος Αnachemia
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.2, R = CH3CH2CH2, CH3CHCH3, X = Br.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 185, §7.2.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 185, §7.2.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 185, §7.2.2, R = CH2CH2CH3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3δ.
- ↑ 8,00 8,01 8,02 8,03 8,04 8,05 8,06 8,07 8,08 8,09 8,10 8,11 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 186, §7.3.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 185, §7.2.8.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 243, §10.2.Α, X = Br.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 267, §11.3.Α1, X = Br.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 244, §10.3.Α, X = Br.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, §5.1. σελ.82
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.5, X = Br.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.3α, X = Br.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.3β, X = Br.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ. 291-293, §19.1.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ. 42, §4.3.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, για Ε = CH3CHCH3 και Nu = Br.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, εφαρμογή για αλκίνια και για Ε = CH3CHCH3 και Nu = Br με βάση και την §8.1, σελ. 114-116.
- ↑ 21,0 21,1 SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, εφαρμογή για αλκαδιένια και για Ε = CH3CHCH3 και Nu = Br με βάση και την §8.2, σελ. 116-117.
- ↑ Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985, §2.1., σελ. 16-17, εφαρμογή γενικής αντίδρασης για Nu = Br.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985

![{\displaystyle \mathrm {CH_{3}CH_{2}CH_{3}+Br_{2}{\xrightarrow[{\triangle }]{UV}}0,035CH_{3}CH_{2}CH_{2}Br+0,965CH_{3}CHBrCH_{3}+HBr} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/6de44041d1e170d2d6b439b2f00c7f00711f8e23)


















![{\displaystyle \mathrm {CH_{3}CHBrCH_{3}+R{\acute {}}\;N(R)R{\acute {}}\;{\acute {}}\;{\xrightarrow {}}[R{\acute {}}\;N(CH(CH_{3})_{2})(R)R{\acute {}}\;{\acute {}}\;]Br} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c49719e753618a10ed594a457b0cddb8e25f6b9d)



![{\displaystyle \mathrm {CH_{3}CHBrCH_{3}+2Li{\xrightarrow[{-10^{o}C}]{|Et_{2}O|}}CH_{3}CHLiCH_{3}+LiBr} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/5aba0a827afa99f8b7b51c4cb54cedfa0f8034bf)












![{\displaystyle \mathrm {CH_{3}CHBrCH_{3}Br+NaOH{\xrightarrow[{\triangle }]{ROH}}CH_{3}CH=CH_{2}+NaBr+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9599bfd130736a533966fa6eaa005b5c87b8d126)
