Αγομελατίνη
 | |
 | |
| Ονομασία IUPAC | |
|---|---|
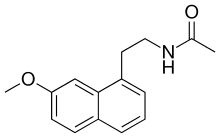
N-[2-(7-methoxynaphthalen-1-yl)ethyl]acetamide | |
| Κλινικά δεδομένα | |
| Εμπορικές ονομασίες | Melitor, Thymanax, Valdoxan, άλλες |
| AHFS/Drugs.com | International Drug Names |
| Δεδομένα άδειας | |
| Κατηγορία ασφαλείας κύησης |
|
| Οδοί χορήγησης | Από το στόμα |
| Κυκλοφορία | |
| Κυκλοφορία |
|
| Φαρμακοκινητική | |
| Βιοδιαθεσιμότητα | 1%[1] |
| Πρωτεϊνική σύνδεση | 95%[1] |
| Μεταβολισμός | Ήπαρ (90% CYP1A2 και 10% CYP2C9)[1] |
| Βιολογικός χρόνος ημιζωής | 1–2 ώρες[1] |
| Απέκκριση | Νεφρά (80%, κυρίως ως μεταβολίτες)[1] |
| Κωδικοί | |
| Αριθμός CAS | 138112-76-2 |
| Κωδικός ATC | N06AX22 |
| PubChem | CID 82148 |
| IUPHAR/BPS | 198 |
| DrugBank | DB06594 |
| ChemSpider | 74141 |
| UNII | 137R1N49AD |
| KEGG | D02578 |
| ChEMBL | CHEMBL10878 |
| Χημικά στοιχεία | |
| Χημικός τύπος | C15H17NO2 |
| Μοριακή μάζα | 243,31 g·mol−1 |
O=C(NCCc1c2c(ccc1)ccc(OC)c2)C | |
InChI=1S/C15H17NO2/c1-11(17)16-9-8-13-5-3-4-12-6-7-14(18-2)10-15(12)13/h3-7,10H,8-9H2,1-2H3,(H,16,17) Key:YJYPHIXNFHFHND-UHFFFAOYSA-N | |
| (verify) | |
Η αγομελατίνη, διαθέσιμη με την εμπορική ονομασία Valdoxan μεταξύ άλλων, είναι άτυπο αντικαταθλιπτικό που χρησιμοποιείται για τη θεραπεία της μείζονος καταθλιπτικής διαταραχής.[5] Μια ανασκόπηση διαπίστωσε ότι είναι εξίσου αποτελεσματική με άλλα αντικαταθλιπτικά με παρόμοια ποσοστά διακοπής συνολικά αλλά λιγότερες διακοπές λόγω παρενεργειών.[6] Μια άλλη ανασκόπηση διαπίστωσε επίσης ότι ήταν εξίσου αποτελεσματική με πολλά άλλα αντικαταθλιπτικά.[7]
Συχνές ανεπιθύμητες ενέργειες περιλαμβάνουν αύξηση βάρους, κόπωση, ηπατικά προβλήματα, ναυτία, πονοκεφάλους και άγχος.[8] Λόγω πιθανών ηπατικών προβλημάτων, συνιστώνται συνεχείς εξετάσεις αίματος.[9] Η χρήση του δεν συνιστάται σε άτομα με άνοια ή άνω των 75 ετών.[10] Υπάρχουν προσωρινές ενδείξεις ότι μπορεί να έχει λιγότερες παρενέργειες από κάποια άλλα αντικαταθλιπτικά.[5] Λειτουργεί διεγείροντας τους υποδοχείς μελατονίνης και αποκλείοντας τους υποδοχείς σεροτονίνης.
Η αγομελατίνη εγκρίθηκε για ιατρική χρήση στην Ευρώπη το 2009 και στην Αυστραλία το 2010. Η χρήση της δεν έχει εγκριθεί στις Ηνωμένες Πολιτείες και οι προσπάθειες έγκρισης ολοκληρώθηκαν το 2011.[9] Αναπτύχθηκε από τη φαρμακευτική εταιρεία Servier.
Ιατρικές χρήσεις
[Επεξεργασία | επεξεργασία κώδικα]Μείζονα καταθλιπτική διαταραχή
[Επεξεργασία | επεξεργασία κώδικα]Η αγομελατίνη χρησιμοποιείται για τη θεραπεία σοβαρών καταθλιπτικών επεισοδίων σε ενήλικες στην Ευρώπη.[11] Έχουν διεξαχθεί δέκα ελεγχόμενες δοκιμές με εικονικό φάρμακο για τη διερεύνηση της βραχυπρόθεσμης αποτελεσματικότητας της αγομελατίνης σε μείζονα καταθλιπτική διαταραχή. Στο τέλος της θεραπείας, σημαντική αποτελεσματικότητα αποδείχθηκε σε έξι από τις δέκα βραχυπρόθεσμες διπλά-τυφλές ελεγχόμενες μελέτες με εικονικό φάρμακο. Δύο θεωρήθηκαν "αποτυχημένες" δοκιμές, καθώς οι συγκριτές της καθιερωμένης αποτελεσματικότητας απέτυχαν να διαφοροποιηθούν από το εικονικό φάρμακο. Η αποτελεσματικότητα παρατηρήθηκε επίσης σε ασθενείς με σοβαρότερη κατάθλιψη σε όλες τις θετικές ελεγχόμενες μελέτες με εικονικό φάρμακο. Η διατήρηση της αντικαταθλιπτικής αποτελεσματικότητας αποδείχθηκε σε μια μελέτη πρόληψης υποτροπών. Μια μετα-ανάλυση διαπίστωσε ότι η αγομελατίνη είναι εξίσου αποτελεσματική με τα τυπικά αντικαταθλιπτικά.[12]
Μια μετα-ανάλυση διαπίστωσε ότι η αγομελατίνη είναι αποτελεσματική στη θεραπεία της σοβαρής κατάθλιψης. Το αντικαταθλιπτικό αποτέλεσμα είναι μεγαλύτερο για πιο σοβαρή κατάθλιψη. Σε άτομα με μεγαλύτερη βασική βαθμολογία (> 30 σε κλίμακα HAMD17), η διαφορά αγομελατίνης-εικονικού φαρμάκου ήταν 4,53 βαθμοί.[13] Οι ελεγχόμενες μελέτες σε ανθρώπους έχουν δείξει ότι η αγομελατίνη είναι τουλάχιστον εξίσου αποτελεσματική με τα αντικαταθλιπτικά SSRI παροξετίνη, σερτραλίνη, εσκιταλοπράμη και φλουοξετίνη στη θεραπεία της μείζονος κατάθλιψης.[14] Μια μετα-μελέτη του 2018 που συνέκρινε 21 αντικαταθλιπτικά, διαπίστωσε ότι η αγομελατίνη ήταν ένα από τα πιο ανεκτά, αλλά αποτελεσματικά αντικαταθλιπτικά.[7]
Ωστόσο, το σώμα της έρευνας για την αγρομελατίνη έχει επηρεαστεί σημαντικά από την προκατάληψη δημοσίευσης, προκαλώντας αναλύσεις που λαμβάνουν υπόψη τόσο δημοσιευμένες όσο και μη δημοσιευμένες μελέτες.[6][15][16] Αυτά έχουν επιβεβαιώσει ότι η αγομελατίνη είναι περίπου εξίσου αποτελεσματική με τα αντικαταθλιπτικά που χρησιμοποιούνται συνήθως (π.χ. SSRIs), αλλά ορισμένοι το χαρακτήρισαν ως "οριακά κλινικά σχετικό", είναι λίγο πιο πάνω από το εικονικό φάρμακο. Σύμφωνα με μια ανασκόπηση του 2013, η αγομελατίνη δεν φαίνεται να παρέχει πλεονέκτημα στην αποτελεσματικότητα έναντι άλλων αντικαταθλιπτικών για τη θεραπεία της οξείας φάσης της μείζονος κατάθλιψης.[17]
Χρήση σε ειδικούς πληθυσμούς
[Επεξεργασία | επεξεργασία κώδικα]Δεν συνιστάται για χρήση σε παιδιά και εφήβους κάτω των 18 ετών λόγω έλλειψης δεδομένων σχετικά με την ασφάλεια και την αποτελεσματικότητα.[11] Ωστόσο, μια μελέτη που δημοσιεύθηκε τον Σεπτέμβριο του 2020, έδειξε μεγαλύτερη αποτελεσματικότητα έναντι του εικονικού φαρμάκου για τη χορήγηση 25mg αγομελατίνης ανά ημέρα σε νέους ηλικίας 7-18 ετών.[18] Μόνο περιορισμένα δεδομένα είναι διαθέσιμα για χρήση σε ηλικιωμένους ηλικίας ≥ 75 ετών με μείζονα καταθλιπτικά επεισόδια.
Δεν συνιστάται η χρήση της κατά τη διάρκεια της εγκυμοσύνης ή του θηλασμού.[10]
Αντενδείξεις
[Επεξεργασία | επεξεργασία κώδικα]Η αγομελατίνη αντενδείκνυται σε ασθενείς με νεφρική ή ηπατική δυσλειτουργία.[11] Σύμφωνα με πληροφορίες που αποκάλυψε η Servier το 2012, οι οδηγίες για την παρακολούθηση των ασθενών που έλαβαν θεραπεία με Valdoxan έχουν τροποποιηθεί σε συνεργασία με τον Ευρωπαϊκό Οργανισμό Φαρμάκων. Καθώς ορισμένοι ασθενείς ενδέχεται να εμφανίσουν αυξημένα επίπεδα ηπατικών ενζύμων στο αίμα τους κατά τη διάρκεια της θεραπείας με Valdoxan, οι γιατροί πρέπει να διεξάγουν εργαστηριακές εξετάσεις για να ελέγξουν ότι το ήπαρ λειτουργεί σωστά κατά την έναρξη της θεραπείας και στη συνέχεια περιοδικά κατά τη διάρκεια της θεραπείας και στη συνέχεια αποφασίζει εάν θα συνεχίσει η θεραπεία ή όχι.[19] Δεν έχει παρατηρηθεί σημαντική μεταβολή των φαρμακοκινητικών παραμέτρων της αγομελατίνης σε ασθενείς με σοβαρή νεφρική δυσλειτουργία. Ωστόσο, διατίθενται μόνο περιορισμένα κλινικά δεδομένα σχετικά με τη χρήση του σε ασθενείς με κατάθλιψη με σοβαρή ή μέτρια νεφρική δυσλειτουργία με μείζονα καταθλιπτικά επεισόδια. Ως εκ τούτου, πρέπει να δίδεται προσοχή κατά τη συνταγογράφηση της αμομελατίνης σε αυτούς τους ασθενείς.
Παρενέργειες
[Επεξεργασία | επεξεργασία κώδικα]Η αγομελατίνη δεν μεταβάλλει την ημερήσια επαγρύπνηση και τη μνήμη σε υγιείς εθελοντές. Σε καταθλιπτικούς ασθενείς, η θεραπεία με το φάρμακο αύξησε τον ύπνο αργών κυμάτων χωρίς τροποποίηση της ποσότητας ύπνου REM (Rapid Eye Movement) ή καθυστέρησης REM.[20] Η αγομελατίνη προκάλεσε επίσης πρόοδο του χρόνου έναρξης του ύπνου και του ελάχιστου καρδιακού ρυθμού. Από την πρώτη εβδομάδα της θεραπείας, η έναρξη του ύπνου και η ποιότητα του ύπνου βελτιώθηκαν σημαντικά χωρίς αδεξιότητα κατά τη διάρκεια της ημέρας, όπως εκτιμήθηκε από τους ασθενείς.[11]
Η αγομελατίνη φαίνεται να προκαλεί λιγότερες σεξουαλικές παρενέργειες και αποτελέσματα διακοπής από την παροξετίνη.
- Υπεριδρωσία (αυξημένη εφίδρωση σε σχέση με τη θερμοκρασία)
- Κοιλιακός πόνος
- Ναυτία
- Εμετοί
- Διάρροια
- Δυσκοιλιότητα
- Πόνος στη πλάτη
- Κόπωση
- Αυξημένη τρανσαμινάση της αλανίτης και τρανσαμινάση του ασπαρτικόύ (ηπατικά ένζυμα)
- Πονοκέφαλος
- Ζάλη
- Υπνηλία
- Αϋπνία
- Ημικρανία
- Άγχος
- Παραισθησία (μη φυσιολογικές αισθήσεις, πχ. μυρμηγκιάσματα, καύσος, φαγούρα)
- θολή όραση
- Έκζεμα
- Κνησμός (φαγούρα)
- Κνίδωση
- Ψυχοκινητική ανησυχία
- Ευερεθιστότητα
- Επιθετικότητα
- Εφιάλτες
- Αφύσικα όνομα
- Μανία
- Υπομανία
- Αυτοκτονικός ιδεασμός
- Αυτοκονική συμπεριφορά
- Ψευδαισθήσεις
- Στεατοηπατίδα
- Αυξημένα επίπεδα τρανσπεπτιδάση του γ-γλουταμινικού (γ-GT) ή/και αλκαλική φωσφατάση
- Ηπατική ανεπάρκεια
- Ίκτερος
- Ερυθηματώδες εξάνθημα
- Οίδημα προσώπου και αγγειοοίδημα
- Απώλεια ή αύξηση βάρους, η οποία είναι λιγότερο σημαντική από ότι με τα SSRI[23]
Εξάρτηση και απόσυρση
[Επεξεργασία | επεξεργασία κώδικα]Δεν απαιτείται μείωση της δοσολογίας κατά τη διακοπή της θεραπείας.[11] Η αγομελατίνη δεν έχει πιθανότητα κατάχρησης όπως μετράται σε υγιείς εθελοντικές μελέτες.
Υπερβολική δόση
[Επεξεργασία | επεξεργασία κώδικα]Η αγομελατίνη αναμένεται να είναι σχετικά ασφαλής σε υπερβολική δόση.[24]
Αλληλεπιδράσεις
[Επεξεργασία | επεξεργασία κώδικα]Η αγομελατίνη είναι ένα υπόστρωμα των CYP1A2, CYP2C9 και CYP2C19. Οι αναστολείς αυτών των ενζύμων, π.χ. το SSRI αντικαταθλιπτικό φλουβοξαμίνη, μειώνουν την κάθαρσή της και μπορούν επομένως να οδηγήσουν σε αύξηση της έκθεσης στην αγομελατίνη.[21] Υπάρχει επίσης η πιθανότητα να αλληλεπιδράσει η αγομελατίνη με το αλκοόλ για να αυξήσει τον κίνδυνο ηπατοτοξικότητας.
Φαρμακολογία
[Επεξεργασία | επεξεργασία κώδικα]Φαρμακοδυναμική
[Επεξεργασία | επεξεργασία κώδικα]Η αγομελατίνη είναι αγωνιστής του υποδοχέα μελατονίνης ( MT1 ( Ki 0,1 nM) και MT2 ( K i = 0,12 nM)) και σεροτονίνης 5-HT2C ( K i = 631 ηΜ) και 5-ΗΤ2B υποδοχέα (Κi = 660 nM) ανταγωνιστής.[25][26] Οι μελέτες δέσμευσης δείχνουν ότι δεν έχει καμία επίδραση στην πρόσληψη μονοαμίνης και καμία συγγένεια για τους υποδοχείς αδρενεργικούς, ισταμίνης, χολινεργικούς, ντοπαμίνης και βενζοδιαζεπίνης, ούτε άλλων υποδοχέων σεροτονίνης.[11]
Η αγομελατίνη επανασυγχρονίζει τους κιρκαδικούς ρυθμούς σε ζωικά μοντέλα συνδρόμου καθυστερημένης ύπνου.[27] Ανταγωνίζοντας τον 5-HT2C, αποτρέπει / αυξάνει την απελευθέρωση νοραδρεναλίνης και ντοπαμίνης ειδικά στον μετωπιαίο φλοιό. Επομένως, μερικές φορές ταξινομείται ως αναστολέας νορεπινεφρίνης-ντοπαμίνης. Δεν επηρεάζει τα εξωκυτταρικά επίπεδα σεροτονίνης. Η αγομελατίνη έχει δείξει αντικαταθλιπτική δράση σε ζωϊκά μοντέλα κατάθλιψης (τεστ ανικανότητας, τεστ απελπισίας, χρόνιο ήπιο στρες) καθώς και σε μοντέλα με αποσυγχρονισμό του κιρκαδικού ρυθμού και σε μοντέλα που σχετίζονται με το άγχος και το άγχος. Στους ανθρώπους, η αγομελατίνη έχει θετικές μετατοπιστικές ιδιότητες. Προκαλεί πρόοδο φάσης ύπνου, πτώση θερμοκρασίας σώματος και έναρξη μελατονίνης.[11]
Ο ανταγωνισμός του 5-HT2B είναι μια αντικαταθλιπτική ιδιότητα που μοιράζεται η αγομελατίνη με πολλά άτυπα αντιψυχωσικά, όπως η αριπιπραζόλη, τα οποία τα ίδια χρησιμοποιούνται ως άτυπα αντικαταθλιπτικά. Οι ανταγωνιστές 5-HT2B διερευνούνται επί του παρόντος για τη χρησιμότητά τους στη μείωση της καρδιοτοξικότητας των φαρμάκων καθώς και στην αποτελεσματικότητά τους στη μείωση του πονοκέφαλου. Ως εκ τούτου, αυτός ο ανταγωνισμός των συγκεκριμένων υποδοχέων από την αγομελατίνη είναι χρήσιμος για την αντικαταθλιπτική αποτελεσματικότητά του καθώς επίσης και για τη μείωση των αρνητικών επιδράσεων του φαρμάκου.[28]
Χημεία
[Επεξεργασία | επεξεργασία κώδικα]
Η χημική δομή της αγομελατίνης είναι πολύ παρόμοια με αυτήν της μελατονίνης. Όπου η μελατονίνη έχει σύστημα δακτυλίου ινδόλης, η αγομελατίνη έχει βιοϊσοστέρα ναφθαλενίου.[29]
Ιστορία
[Επεξεργασία | επεξεργασία κώδικα]Η αγομελατίνη ανακαλύφθηκε και αναπτύχθηκε από την ευρωπαϊκή φαρμακευτική εταιρεία Servier Laboratories Ltd. Η Servier συνέχισε να αναπτύσσει το φάρμακο και να διεξάγει δοκιμές φάσης III στην Ευρωπαϊκή Ένωση.
Τον Μάρτιο του 2005, η Servier υπέβαλε την αγομελατίνη στον Ευρωπαϊκό Οργανισμό Φαρμάκων (EMA) με τις εμπορικές ονομασίες Valdoxan και Thymanax. Στις 27 Ιουλίου 2006, η Επιτροπή Ιατρικών Προϊόντων για Ανθρώπινη Χρήση (CHMP) του EMA συνέστησε την απόρριψη της άδειας κυκλοφορίας. Το κύριο μέλημα ήταν ότι η αποτελεσματικότητα δεν είχε αποδειχθεί επαρκώς, ενώ δεν υπήρχαν ιδιαίτερες ανησυχίες σχετικά με τις παρενέργειες.[30] Τον Σεπτέμβριο του 2007, η Servier υπέβαλε μια νέα αίτηση μάρκετινγκ στον EMA.[31]
Τον Μάρτιο του 2006, η Servier ανακοίνωσε ότι πούλησε τα δικαιώματα στην αγορά αγομελατίνης στις Ηνωμένες Πολιτείες στη Novartis.[32] Είχε υποβληθεί σε αρκετές κλινικές δοκιμές φάσης III στις ΗΠΑ και μέχρι τον Οκτώβριο του 2011 η Novartis ανέφερε το φάρμακο ως προγραμματισμένο για υποβολή στο FDA το νωρίτερο το 2012.[33] Ωστόσο, η ανάπτυξη για την αγορά των ΗΠΑ διακόπηκε τον Οκτώβριο του 2011, όταν έγιναν διαθέσιμα τα αποτελέσματα από την τελευταία από αυτές τις δοκιμές.[34]
Έλαβε έγκριση από τον Ευρωπαϊκό Οργανισμό Φαρμάκων (EMA) για εμπορία στην Ευρωπαϊκή Ένωση τον Φεβρουάριο του 2009[11] και έγκριση από τη Διοίκηση Θεραπευτικών Προϊόντων (TGA) για εμπορία στην Αυστραλία τον Αύγουστο του 2010.
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 «Valdoxan Product Information» (PDF). TGA eBusiness Services. Servier Laboratories Pty Ltd. 23 Σεπτεμβρίου 2013. Αρχειοθετήθηκε από το πρωτότυπο στις 24 Μαρτίου 2017. Ανακτήθηκε στις 14 Οκτωβρίου 2013.
- ↑ «Thymanax EPAR». European Medicines Agency (EMA). Ανακτήθηκε στις 14 Ιανουαρίου 2021.
- ↑ «Valdoxan EPAR». European Medicines Agency (EMA). Ανακτήθηκε στις 14 Ιανουαρίου 2021.
- ↑ «Valdoxan 25 mg film-coated tablets - Summary of Product Characteristics (SmPC)». (emc). 13 Ιουλίου 2020. Ανακτήθηκε στις 14 Ιανουαρίου 2021.
- ↑ 5,0 5,1 «Agomelatine versus other antidepressive agents for major depression». The Cochrane Database of Systematic Reviews (12): CD008851. December 2013. doi:. PMID 24343836.
- ↑ 6,0 6,1 «Antidepressant efficacy of agomelatine: meta-analysis of published and unpublished studies». BMJ 348: g1888. March 2014. doi:. PMID 24647162.
- ↑ 7,0 7,1 «Comparative efficacy and acceptability of 21 antidepressant drugs for the acute treatment of adults with major depressive disorder: a systematic review and network meta-analysis» (στα αγγλικά). Lancet 391 (10128): 1357–1366. April 2018. doi:. PMID 29477251.
- ↑ «Product Information: Valdoxan, INN-agomelatine» (PDF). www.ema.europa.eu. European Medicines Agency. 13 Νοεμβρίου 2013. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 29 Οκτωβρίου 2014. Ανακτήθηκε στις 27 Φεβρουαρίου 2016.
- ↑ 9,0 9,1 Norman, TR; Olver, JS (13 February 2019). «Agomelatine for depression: expanding the horizons?». Expert Opinion on Pharmacotherapy 20 (6): 647–656. doi:. PMID 30759026.
- ↑ 10,0 10,1 British national formulary : BNF 76 (76 έκδοση). Pharmaceutical Press. 2018. σελίδες 357–358. ISBN 9780857113382.
- ↑ 11,00 11,01 11,02 11,03 11,04 11,05 11,06 11,07 11,08 11,09 11,10 «Summary of Product Characteristics» (PDF). European Medicine Agency. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 29 Οκτωβρίου 2014. Ανακτήθηκε στις 14 Οκτωβρίου 2013.
- ↑ «Antidepressant efficacy of agomelatine: meta-analysis of published and unpublished studies». BMJ 348: g1888. March 2014. doi:. PMID 24647162.
- ↑ «Severe depression and antidepressants: focus on a pooled analysis of placebo-controlled studies on agomelatine». International Clinical Psychopharmacology 22 (5): 283–91. September 2007. doi:. PMID 17690597.
- ↑ «Efficacy of agomelatine in major depressive disorder: meta-analysis and appraisal». The International Journal of Neuropsychopharmacology 15 (3): 417–28. April 2012. doi:. PMID 21859514.
- ↑ «Agomelatine efficacy and acceptability revisited: systematic review and meta-analysis of published and unpublished randomised trials». The British Journal of Psychiatry 203 (3): 179–87. September 2013. doi:. PMID 23999482.
- ↑ «A benefit-risk assessment of agomelatine in the treatment of major depression». Drug Safety 34 (9): 709–31. September 2011. doi:. PMID 21830835.
- ↑ «Agomelatine versus other antidepressive agents for major depression». The Cochrane Database of Systematic Reviews (12): CD008851. December 2013. doi:. PMID 24343836.
- ↑ «Agomelatine Effective for Children, Adolescents With Depression». dgnews.docguide.com (στα Αγγλικά). Ανακτήθηκε στις 21 Σεπτεμβρίου 2020.
- ↑ «Information about Valdoxan for patients». Servier. Αρχειοθετήθηκε από το πρωτότυπο στις 10 Δεκεμβρίου 2012. Ανακτήθηκε στις 10 Δεκεμβρίου 2012.
- ↑ Quera Salva, Maria-Antonia; Vanier, Bernard; Laredo, Judith; Hartley, Sarah; Chapotot, Florian; Moulin, Catherine; Lofaso, Frédéric; Guilleminault, Christian (2007-05-04). «Major depressive disorder, sleep EEG and agomelatine: an open-label study». The International Journal of Neuropsychopharmacology 10 (5): 691–696. doi:. ISSN 1461-1457. PMID 17477886.
- ↑ 21,0 21,1 21,2 21,3 Australian Medicines Handbook 2013. Adelaide: The Australian Medicines Handbook Unit Trust. 2013. ISBN 9780980579093.
- ↑ 22,0 22,1 22,2 Joint Formulary Committee and Royal Pharmaceutical Society of Great Britain (2013). British National Formulary (BNF) 65. London, UK: Pharmaceutical Press. σελ. 253. ISBN 978-0857110848.
- ↑ «Agomelatine in the treatment of major depressive disorder: potential for clinical effectiveness». CNS Drugs 24 (6): 479–99. June 2010. doi:. PMID 20192279.
- ↑ The Maudsley prescribing guidelines in psychiatry. West Sussex: Wiley-Blackwell. 2012. ISBN 978-0-470-97948-8.
- ↑ «Depression: chronophysiology and chronotherapy». Biological Rhythm Research 45: 77–91. June 2013. doi:.
- ↑ «The novel melatonin agonist agomelatine (S20098) is an antagonist at 5-hydroxytryptamine2C receptors, blockade of which enhances the activity of frontocortical dopaminergic and adrenergic pathways». The Journal of Pharmacology and Experimental Therapeutics 306 (3): 954–64. September 2003. doi:. PMID 12750432. https://archive.org/details/sim_journal-of-pharmacology-and-experimental-therapeutics_2003-09_306_3/page/954.
- ↑ «Agomelatine, an innovative pharmacological response to unmet needs». Journal of Psychopharmacology 22 (7 Suppl): 4–8. September 2008. doi:. PMID 18753276.
- ↑ «The novel melatonin agonist agomelatine (S20098) is an antagonist at 5-hydroxytryptamine2C receptors, blockade of which enhances the activity of frontocortical dopaminergic and adrenergic pathways». The Journal of Pharmacology and Experimental Therapeutics 306 (3): 954–64. September 2003. doi:. PMID 12750432. https://archive.org/details/sim_journal-of-pharmacology-and-experimental-therapeutics_2003-09_306_3/page/954.
- ↑ «N-[2-(7-Methoxy-1-naphthyl)ethyl]acetamide, a potent melatonin analog». Acta Crystallogr. C 50 (6): 907–910. 1994. doi:.
- ↑ «Questions and Answers on Recommendation for Refusal of Marketing Authorisation». European Medicines Agency. 18 November 2006. Αρχειοθετήθηκε από το πρωτότυπο στις 2020-03-02. https://web.archive.org/web/20200302212446/http://www.emea.europa.eu/humandocs/PDFs/EPAR/valdoxan/H-656-657-RQ%26A-en.pdf. Ανακτήθηκε στις 6 July 2009.
- ↑ «CHMP Assessment Report for Valdoxan». European Medicines Agency. 20 November 2008. Αρχειοθετήθηκε από το πρωτότυπο στις 24 April 2011. https://web.archive.org/web/20110424023843/http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/000915/WC500046226.pdf. Ανακτήθηκε στις 6 July 2009.
- ↑ Bentham, Clara (2006-03-29). «Servier and Novartis sign licensing agreement for agomelatine, a novel treatment for depression». Servier UK. Αρχειοθετήθηκε από το πρωτότυπο στις 16 April 2009. https://web.archive.org/web/20090416210513/http://www.servier.co.uk/news/news-details.asp?StoryID=76. Ανακτήθηκε στις 2009-05-15.
- ↑ «Clinical trials for agomelatine». ClinicalTrials.gov. National Institutes of Health. Αρχειοθετήθηκε από το πρωτότυπο στις 4 Οκτωβρίου 2011. Ανακτήθηκε στις 6 Ιουλίου 2009.
- ↑ Malone, Eleanor (25 Οκτωβρίου 2011). «Novartis drops future blockbuster agomelatine». Scrip Intelligence. Αρχειοθετήθηκε από το πρωτότυπο στις 11 Νοεμβρίου 2011.