Γλυκεριναλδεΰδη
| Γλυκεριναλδεΰδη | |
|---|---|

| |

| |

| |

| |

| |
| Γενικά | |
| Όνομα IUPAC | 2,3-διυδροξυπροπανάλη |
| Άλλες ονομασίες | Γλυκεριναλδεΰδη Γλυκερική αλδεΰδη |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C3H6O3 |
| Μοριακή μάζα | 90,078 amu |
| Σύντομος συντακτικός τύπος |
HOCH2CH(OH)CHO |
| Αριθμός CAS | 367-47-5 |
| SMILES | O=CC(O)CO |
| Ισομέρεια | |
| Ισομερή θέσης | 63 (τουλάχιστον) |
| Οπτικά ισομερή | 2 |
| Φυσικές ιδιότητες | |
| Σημείο τήξης | 145 °C |
| Σημείο βρασμού | 140-150 °C (0,8 mmHg) |
| Πυκνότητα | 1.455 kg/m3 |
| Εμφάνιση | άχρωμο κρυσταλλικό στερεό |
| Χημικές ιδιότητες | |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Η 2,3-διυδροξυπροπανάλη ή γλυκεριναλδεΰδη ή γλυκερική αλδεΰδη (σε δύο (2) οπτικά ισομερή) είναι η απλούστερη αλδόζη και συγκεκριμένα μια «τρίοζη»[1][2]. Είναι ένα άχρωμο κρυσταλλικό στερεό με γλυκιά γεύση και αποτελεί μια ενδιάμεση ένωση στο μεταβολισμό των (μεγαλύτερων) σακχάρων. Η ονομασία «γλυκεριναλδεΰδη» προέρχεται από τη σύνθεση των λέξεων γλυκερίνη και αλδεΰδη, αφού διαφέρει από την πρώτη μόνο στο ότι έχει φορμυλομάδα (CHO) αντί μιας ακραίας υδροξυμεθυλομάδας (CH2OH).
Δομή
[Επεξεργασία | επεξεργασία κώδικα]| Δεσμοί[3] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C#2,#3-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C#1-H | σ | 2sp2-1s | 107 pm | 3% C- H+ |
| O-H | σ | 2sp3-1s | 96 pm | 32% O- H+ |
| C-O | σ | 2sp3-2sp3 | 150 pm | 19% C+ O- |
| C=O | σ | 2sp2-2sp2 | 132 pm | 19% C+ O- |
| π | 2p-2p | |||
| C#2-C#1 | σ | 2sp3-2sp2 | 151 pm | |
| C#3-C#2 | σ | 2sp3-2sp3 | 154 pm | |
| Στατιστικό ηλεκτρικό φορτίο[4] | ||||
| Ο (COH) | -0,51 | |||
| Ο (C=O) | -0,38 | |||
| Η (H-C) | +0,03 | |||
| C#3 | +0,13 | |||
| C#2 | +0,16 | |||
| Η (H-O) | +0,32 | |||
| C#1 | +0,35 | |||
Ισομέρεια
[Επεξεργασία | επεξεργασία κώδικα]Θέσης
[Επεξεργασία | επεξεργασία κώδικα]Με βάση το χημικό της τύπο, C3H6O3, έχει τα ακόλουθα (τουλάχιστον) σταθερά ισομερή θέσης:
- Κυκλοπροπανοτριόλη-1,2,3 (σε δύο (2) γεωμετρικά ισομερή).
- Μεθοξυδροξυαιθανάλη με σύντομο συντακτικό τύπο CH3OCH(OH)CHO (σε δύο (2) οπτικά ισομερή).
- (Υδροξυμεθοξυ)αιθανάλη με σύντομο συντακτικό τύπο ΗΟCH2OCH2CHO.
- 1,3-διυδροξυπροπανόνη με σύντομο συντακτικό τύπο HOCH2COCH2OH.
- 2-υδροξυπροπανικό οξύ ή γαλακτικό οξύ με σύντομο συντακτικό τύπο CH3CH(OH)COOH (σε δύο (2) οπτικά ισομερή).
- 3-υδροξυπροπανικό οξύ με σύντομο συντακτικό τύπο ΗΟCH2CH2COOH.
- Μεθοξυαιθανικό οξύ με σύντομο συντακτικό τύπο CH3OCH2COOH.
- Υδροξυαιθανικός μεθυλεστέρας με σύντομο συντακτικό τύπο ΗOCH2COOCH3.
- Αιθανικός υδροξυμεθυλεστέρας με σύντομο συντακτικό τύπο CH3COOCH2OH.
- Ανθρακικός αιθυλεστέρας με σύντομο συντακτικό τύπο HOCOOCH2CH3.
- Ανθρακικός διμεθυλεστέρας με σύντομο συντακτικό τύπο CH3OCOOCH3.
- Μεθανικός 1-υδροξυαιθυλεστέρας με σύντομο συντακτικό τύπο ΗCOOCH(OH)CH3 (σε δύο (2) οπτικά ισομερή).
- Μεθανικός 2-υδροξυαιθυλεστέρας με σύντομο συντακτικό τύπο ΗCOOCH2CH2OH.
- Μεθανικός μεθοξυμεθυλεστέρας με σύντομο συντακτικό τύπο ΗCOOCH2OCH3.
- Προπανικό υπεροξύ με σύντομο συντακτικό τύπο CH3CH2CO3H.
- 1,3-επιτριοξυπροπάνιο ή 1,2,3-τριοξάνιο.
- 1',2-επιδιοξυμεθοξυαιθάνιο ή 1,2,4-τριοξάνιο.
- Διμεθοξυ-1',1"-εποξυμεθάνιο ή 1,3,5-τριοξάνιο.
- 1,2-επιτριοξυαιθάνιο ή μεθυλο-1,2,3-τριοξολάνιο.
- 1,1'-επιδιοξυμεθοξυαιθάνιιο ή μεθυλο-1,2-4-τριοξολάνιο.
- 1,3-επιδιοξυπροπανόλη-1 ή 3-υδροξυ-1,2-διοξολάνιο.
- 1,3-επιδιοξυπροπανόλη-2 ή 4-υδροξυ-1,2-διοξολάνιο.
- 1,2'-εποξυαιθυλοξυμεθανόλη ή 3-υδροξυ-1,3-διοξολάνιο.
- 1',2-εποξυμεθυλοαιθανόλη ή 4-υδροξυ-1,3-διοξολάνιο.
- 1,1-επιτριοξυπροπάνιο ή αιθυλοτριοξετάνιο.
- 2,2-επιτριοξυπροπάνιο ή διμεθυλοτριοξετάνιο.
- 1,2-επιδιοξυπροπανόλη-2 ή 3-μεθυλο-3-υδροξυ-1,2-διοξετάνιο.
- 1,2-επιδιοξυπροπανόλη-1 ή 4-μεθυλο-3-υδροξυ-1,2-διοξετάνιο.
- 2,3-επιδιοξυπροπανόλη-1 ή υδροξυμεθυλο-1,2-διοξετάνιο.
- 1,2-επιδιοξυμεθοξυαιθάνιο ή μεθοξυ-1,2-διοξετάνιο.
- 1,1'-εποξυ-1-μεθοξυαιθανόλη ή 2-μεθυλο-2-υδροξυ-1,3-διοξετάνιο.
- Αιθοξυ-1,1'-εποξυμεθανόλη ή 4-μεθυλο-2-υδροξυ-1,3-διοξετάνιο.
- 1',2-εποξυ-2-μεθοξυαιθανόλη ή υδροξυμεθυλο-1,3-διοξετάνιο.
- Διμεθοξυ-1,1'-εποξυμεθάνιο ή μεθοξυ-1,3-διοξετάνιο.
- 1,3-εποξυπροπανοδιόλη-1,1 ή 2,2-διυδροξυοξετάνιο.
- 1,3-εποξυπροπανοδιόλη-1,2 ή 2,3-διυδροξυοξετάνιο.
- 1,3-εποξυπροπανοδιόλη-1,3 ή 2,4-διυδροξυοξετάνιο.
- 1,3-εποξυπροπανοδιόλη-2,2 ή 3,3-διυδροξυοξετάνιο.
- 1,1-επιδιοξυπροπανόλη-1 ή 1-αιθυλο-1-υδροξυδιοξιράνιο.
- 1,1-επιδιοξυπροπανόλη-2 ή (1-υδροξυαιθυλο)διοξιράνιο.
- 3,3-επιδιοξυπροπανόλη-1 ή (2-υδροξυαιθυλο)διοξιράνιο.
- 2,2-επιδιοξυπροπανόλη-1 ή μεθυλο(υδροξυμεθυλο)διοξιράνιο.
- 1,1-επιδιοξυ-1-μεθοξυαιθάνιο ή μεθοξυμεθυλοδιοξιράνιο.
- 1,2-εποξυπροπανοδιόλη-1,1 ή 2,2-διυδροξυοξιράνιο.
- 1,2-εποξυπροπανοδιόλη-1,2 ή 2,3-διυδροξυοξιράνιο.
- 2,3-εποξυπροπανοδιόλη-1,2 ή 1-υδροξυ-1-υδροξυμεθυλοοξιράνιο.
- 1,2-εποξυπροπανοδιόλη-1,3 ή 1-υδροξυ-2-υδροξυμεθυλοοξιράνιο.
- 1,2-εποξυ-1-μεθοξυαιθανόλη ή 1-μεθοξυ-1-υδροξυοξιράνιο.
- 1,2-εποξυ-2-μεθοξυαιθανόλη ή 2-μεθοξυ-1-υδροξυοξιράνιο.
- 2,3-εποξυπροπανοδιόλη-1,1 ή διυδροξυμεθυλοξιράνιο.
Οπτική
[Επεξεργασία | επεξεργασία κώδικα]Η γλυκεριναλδεΰδη έχει ένα χειρόμορφο κέντρο (το #2 άτομο άνθρακα) και γι' αυτό υπάρχει σε δυο διαφορετικά εναντιομερή , δηλαδή ισομερή με αντίθετες ιδιότητες ως προς την ικανότητα στροψής του πολωμένου φωτός:
| D-γλυκεριναλδεΰδη R-γλυκεριναλδεΰδη (+)-γλυκεριναλδεΰδη |
L-γλυκεριναλδεΰδη S-γλυκεριναλδεΰδη (−)-γλυκεριναλδεΰδη | |
| Προβολές κατά Fischer | 
|
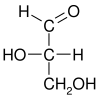
|
| Γραμμικοί τύποι | 
|

|
| 3D - μοριακά μοντέλα βασισμένα σε μπάλες και ράβδους | 
|
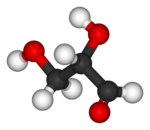
|
Παρόλο που η οπτική περιστροφή για τη γλυκεριναλδεΰδη είναι (+) για το R- και (-) για το S- ισομερές, αυτό δεν ισχύει για όλους τους μονοσακχαρίτες. Η στερεοχημική περιστροφή μπορεί να καθοριστεί μόνο από τη χημική δομή, ενώ η οπτική περιστροφή μπορεί να καθοριστεί μόνο πειραματικά. Όταν, λοιπόν, στα τέλη του 19ου αιώνα, θεωρήθηκε ότι η D-γλυκεριναλδεΰδη είναι ταυτόσημη με τη (+)-γλυκεριναλδεΰδη, αυτό ήταν μια τυχερή πρόβλεψη, που τελικά (αργότερα) επιβεβαιώθηκε με κρυσταλλογραφία ακτίνων Χ, το 1951. Μάλιστα, στο D/L- σύστημα ονομασίας διαχωρισμού των οπτικών ισομερών, η γλυκεριναλδεΰδη χρησιμοποιείται ως πρότυπη ένωση. Οι μονοσακχαρίτες με προσανατολισμό, το τελευταίο τους χειρόμορφο κέντρο (για παράδειγμα στη γλυκόζη το C#5), ταυτόσημο με την R-γλυκεριναλδεΰδη, χαρακτηρίζονται με το πρόθεμα D-. Ομοίως, φυσικά, τα άλλα, που είναι ταυτόσημα με την S-γλυκεριναλδεΰδη, χαρακτηρίζονται με το πρόθεμα L-.
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Με τριμερισμό μεθανάλης
[Επεξεργασία | επεξεργασία κώδικα]Η γλυκεριναλδεΰδη είναι ένα ενδιάμεσο της αντίδρασης φορμόζης, κατά την οποία παράγονται σάκχαρα με πρώτη ύλη τη μεθανάλη (αλδολική συμπύκνωση)[5]:
Με μερική οξείδωση γλυκερίνης
[Επεξεργασία | επεξεργασία κώδικα]Με μερική οξείδωση γλυκερίνης, με σχετικά ήπια οξειδωτικά μέσα, όπως το τριοξείδιο του χρωμίου ή υπεροξείδιο του υδρογόνου, με χρήση αλάτων σιδήρου ως καταλύτη, παράγεται γλυκεριναλδεΰδη και η ισομερής 1,3-διυδροξυπροπανόνη[6]:
Με μερική αναγωγή 2-υδροξυπροπανοδιάλης, 2-οξο-3-υδροξυπροπανάλης ή και 2-οξοπροπανοδιάλης
[Επεξεργασία | επεξεργασία κώδικα]1. Με μερική αναγωγή 2-υδροξυπροπανοδιάλης παράγεται γλυκεριναλδεΰδη[7]:
2. Με μερική αναγωγή 2-οξο-3-υδροξυπροπανάλης παράγεται γλυκεριναλδεΰδη[7]:
3. Με μερική αναγωγή 2-οξοπροπανοδιάλης παράγεται γλυκεριναλδεΰδη[7]:
Με έμμεση μερική αναγωγή 2,3-διυδροξυπροπανικού οξέος
[Επεξεργασία | επεξεργασία κώδικα]1. Αρχικά το 2,3-διυδροξυπροπανικό οξύ μετατρέπεται σε 2,3-διυδροξυπροπανοϋλοχλωρίδιο[8]:
2. Το 2,3-διυδροξυπροπανοϋλοχλωρίδιο ανάγεται καταλυτικά άμεσα προς γλυκεριναλδεΰδη:
Διυδροξυλίωση προπεν-2-άλης
[Επεξεργασία | επεξεργασία κώδικα]Η διυδροξυλίωση προπεν-2-άλης, αντιστοιχεί σε προσθήκη H2O2 και παράγει γλυκεριναλδεΰδη[9]:
1. Επίδραση αραιού διαλύματος υπερμαγγανικού καλίου (KMnO4). Π.χ.:
2. Επίδραση καρβονικού οξέος και υπεροξείδιου του υδρογόνου:
Βιοχημικός ρόλος
[Επεξεργασία | επεξεργασία κώδικα]Η γλυκεριναλδεΰδη είναι η απλούστερη αλδόζη και μια από τις δυο τριόζες. Η υδροξυακετόνη (ή 1,3-διυδροξυπροπανόνη) είναι, αντίστοιχα, η απλούστερη κετόζη και η άλλη, ισομερής, τριόζη. Η αλληλομετατροπή των φωσφοπαραγώγων των δύο αυτών ισαμερών τριοζών καταλύεται από το ένζυμο ισομεράση των φωσφοτριοζών και απαοτελεί ένα σημαντικό ενδιάμεσο στάδιο της γλυκόλυσης.
Χημικές ιδιότητες και παράγωγα
[Επεξεργασία | επεξεργασία κώδικα]Αναγωγή προς γλυκερίνη
[Επεξεργασία | επεξεργασία κώδικα]Μπορεί να αναχθεί προς γλυκερίνη με τις ακόλουθες μεθόδους[7]
1. Με λιθιοαργιλιοϋδρίδιο (LiAlH4):
2. Με καταλυτική υδρογόνωση:
Αναγωγή προς προπανοδιόλη-1,2
[Επεξεργασία | επεξεργασία κώδικα]Μπορεί να αναχθεί προς προπανοδιόλη-1,2 με την μεθόδο Wolff-Kishner[10]
Οξείδωση προς οξοπροπανοδιικό οξύ
[Επεξεργασία | επεξεργασία κώδικα]Μπορεί να οξειδωθεί προς οξοπροπανοδιικό οξύ, με αραιό υπερμαγγανικό κάλιο[11];
Μερική οξείδωση προς 2,3-διυδροξυπροπανικό οξύ
[Επεξεργασία | επεξεργασία κώδικα]Μπορεί να οξειδωθεί προς υ2,3-διυδροξυπροπανικό οξύ[11];
1. Με τριοξείδιο του χρωμίου:
2. Με οξυγόνο:
3. Με αντιδραστήριο Tollens (αμμωνιακό διάλυμα νιτρικού αργύρου):
4. Με αντιδραστήρια Fehling:
- Οι αντιδράσεις 3-4 παρουσιάζονται απλοποιημένες και χρησιμοποιούνται γενικά για την ανίχνευση αλδεϋδομάδας (-CHO).
Προσθήκη ύδατος
[Επεξεργασία | επεξεργασία κώδικα]Με προσθήκη ύδατος σε υδροξυαιθανάλη παράηεται, σε χημική ισορροπία, η μη απομονώσιμη ασταθής προπανοτετρόλη-1,1,2,3[12]:
Αντιδράσεις με αζωτούχες ενώσεις
[Επεξεργασία | επεξεργασία κώδικα]Αντιδρά με αρκετά είδη αζωτούχων ενώσεων του γενικού τύπου NH2A, όπου το A μπορεί να είναι υδρογόνο, αλκύλιο, υδροξύλιο, αμινοξάδα και διάφορα άλλα. Με βάση το γενικό τύπο η γενική αντίδραση είναι η ακόλουθη[13]:
- Μερικά σχετικά παραδείγματα αμέσως παρακάτω:
1. Με αμμωνία παράγεται 3-ιμινοπροπανοδιόλη-1,2. Προκύπτει από την παραπάνω γενική με A = H:
2. Με πρωτοταγείς αμίνες (RNH2) παράγεται 3-(αλκυλιμινο)προπανοδιόλη-1,2. Προκύπτει από την παραπάνω γενική με A = R:
3. Με υδροξυλαμίνη παράγεται 3-(υδροξυλιμινo)προπανοδιόλη-1,2. Προκύπτει από την παραπάνω γενική με A = OH:
4. Με υδραζίνη παράγεται αρχικά 3-υδραζοπροπανοδιόλη και με περίσσεια μεθανάλης δι(2,3-διυδροξυπροπυλιδεν)αζίνη. Προκύπτει από την παραπάνω γενική με A = NH2:
5. Με φαινυλυδραζίνη παράγεαι 3-(φαινυλυδραζo)προπανοδιόλη-1,2. Προκύπτει από την παραπάνω γενική με A = NHPh:
6. Με υδραζινομεθαναμίδιο παράγεται ((2,3-διυδροξυπροπυλιδεν)υδραζο)μεθαναμίνη. Προκύπτει από την παραπάνω γενική με A = NHCONH2:
Συμπύκνωση με δευτεροταγείς αμίνες
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση δευτεροταγούς αμίνης (RNHR') παράγεται 3-(διαλκυλιμινο)προπανοδιόλη-1,2[14]:
Αλδολική συμπύκνωση
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση βάσης έχουμε τη λεγόμενη αλδολική συμπύκνωση, η οποία όταν γίνεται με τον εαυτό της, παράγεται γλυκόζη[5]:
Συμπύκνωση με «ενεργές» μεθυλενομάδες
[Επεξεργασία | επεξεργασία κώδικα]Με την επίδραση «ενεργών» μεθυλενομάδων, δηλαδή ενώσεων του γενικού τύπου XCH2Y, όπου X,Y ηλεκτραρνητικές ομάδες όπως π.χ. κυανομάδα (CN), καρβαλκοξυομάδα (COOR), έχουμε την αντίδραση Knoevenagel[15]:
Επίδραση φωσφοροϋλιδίων
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση φωσφοροϋλιδίων [Ph3P+C-(R)R'] έχουμε τη λεγόμενη αντίδραση Wittig, με την οποία παράγεται 4,4-διαλκυλοβουτεν-3-διόλη-1,2[16]:
Προσθήκη διαφόρων πυρηνόφιλων αντιδραστηρίων
[Επεξεργασία | επεξεργασία κώδικα]Είναι δυνατή η προσθήκη διαφόρων πυρηνόφιλων αντιδραστηρίων στο διπλό δεσμό C=Ο που περιέχει η γλυκεριναλδεΰδη. Π.χ.:[17]:
1. Με προσθήκη υδροκυανίου παράγεται αρχικά 2,3,4-τριυδροξυβουτανονιτρίλιο, από το οποίο με υδρόλυση μπορεί να παραχθεί 2,3,4-τριυδροξυβουτανικό οξύ:
2. Με προσθήκη όξινου θειικού νατρίου παράγεται 1,2,3-τριυδροξυπροπανοσουλφονικό οξύ:
3. Με προσθήκη αλκυλομαγνησιοαλογονιδίου (RMgX) παράγεται 3-αλκυλοπροπανοτριόλη-1,2,3:
4. Με προσθήκη στο καρβονύλιο και υποκατάσταση των υδροξυλίων από πενταχλωριούχου φωσφόρου παράγεται 1,1,2,3-τετραχλωροπροπάνιο:
Επίδραση υδραζωτικού οξέος
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση υδραζωτικού οξέος παράγεται 2,3-διυδροξυπροπανονιτρίλιο και 2,3-διυδροξυπροπαναμίδιο[18]:
Προσθήκη αλκοολών
[Επεξεργασία | επεξεργασία κώδικα]Με προσθήκη αλκοόλης (ROH) παράγεται αρχικά 1-αλκοξυπροπανοτριόλη-1,2,3 και έπειτα, με περίσσεια αλκοόλης 3,3-διαλκοξυπροπανοδιόλη-1,2[19]:
Αντίδραση Stracker
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση υδροκυανίου (HCN) και αμμωνίας (NH3) σε υδροξυαιθανάλη παράγεται αρχικά 2-αμινο-3,4-διυδροξυβουτανονιτρίλιο και στη συνέχεια, με υδρόλυση, 2-αμινο-3,4-διυδροξυβουτανικό οξύ[20]:
Ενδομοριακή αφυδάτωση
[Επεξεργασία | επεξεργασία κώδικα]Με ενδομοριακή αφυδάτωση παράγεται (υδροξυμεθυλο)κετένη[21]:
Παραπομπές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Σάκχαρο με τρία (3) άτομα άνθρακα.
- ↑ Έχει προταθεί να θεωρηθεί η υδροξυαιθανάλη διόζη. Αν αυτό γίνει επισήμως δεκτό, τότε η υδροξυαιθανάλη θα γίνει η απλούστερη αλδόζη.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα
- ↑ 5,0 5,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.8.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.2.
- ↑ 7,0 7,1 7,2 7,3 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.9.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.3α.
- ↑ 11,0 11,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.221, §9.6.1,2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.5α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218-219, §9.5.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.9.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.11.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.12.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.15.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.221, §9.6.3.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 329, §14.2.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.3.
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.









![{\displaystyle \mathrm {4HOCH_{2}CH(OH)CHO+LiAlH_{4}{\xrightarrow {}}Li[Al(HOCH_{2}CH(OH)CH_{2}O)_{4}]{\xrightarrow {+2H_{2}O}}4HOCH_{2}CH(OH)CH_{2}OH+LiAlO_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/67ef24f02b677f07fc6118d88e8e1d5ac7662acf)


























![{\displaystyle \mathrm {HOCH_{2}CH(OH)CHO{\xrightarrow[{>150^{o}C}]{\pi .H_{2}SO_{4}}}HOCH_{2}CH=C=O+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/77fec0cfd9ba3e2d43e5363e9ee65af9b30373f5)