Διμεθυλομεθαναμίδιο
| Διμεθυλομεθαναμίδιο | |||
|---|---|---|---|

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Διμεθυλομεθαναμίδιο | ||
| Άλλες ονομασίες | διμεθυλοφορμαμίδιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C2H5ON | ||
| Μοριακή μάζα | 73,09 amu | ||
| Σύντομος συντακτικός τύπος |
HCON(CH3)2 | ||
| Συντομογραφίες | HCONMe2, DMF | ||
| Αριθμός CAS | 123-39-7 | ||
| SMILES | O=CN(C)C | ||
| InChI | 1/C3H7NO/c1-3(5)4-2/h1-2H3,(H,4,5) | ||
| Αριθμός RTECS | LQ2100000 | ||
| Αριθμός UN | 6228 | ||
| PubChem CID | 31254 | ||
| ChemSpider ID | 5993 | ||
| Δομή | |||
| Διπολική ροπή | 3,86 D | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 76 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -61 °C | ||
| Σημείο βρασμού | 153 °C | ||
| Πυκνότητα | 944 kg/m3 | ||
| Διαλυτότητα στο νερό |
αναμείξιμο | ||
| Ιξώδες | 0,92 cP (20 °C) | ||
| Δείκτης διάθλασης , nD |
1,4305 (20 °C) | ||
| Τάση ατμών | 0,3 kPa (20 °C) | ||
| Χημικές ιδιότητες | |||
| Ελάχιστη θερμοκρασία ανάφλεξης |
58 °C | ||
| Επικινδυνότητα | |||
| Φράσεις κινδύνου | R61 R20/21 R36 | ||
| Φράσεις ασφαλείας | 53-45 | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το διμεθυλομεθαναμίδιο ή διμεθυλοφορμαμίδιο (DMF, DiMethyl'Formamide, αν και η ίδια συντομογραφία χρησιμοποιείται ενίοτε και για το διμεθυλοφουράνιο) με σύντομο συντακτικό τύπο HCOΝ(CH3)2, είναι το απλούστερο τριτοταγές αμίδιο και, πιο συγκεκριμένα, ένα παράγωγο του μεθανικού οξέος, από το οποίο (τυπικά) προκύπτει με αντικατάσταση του υδροξυλίου του καρβοξυλίου από διμεθυλαμινομάδα [(CH3)N-. Eίναι ένα άχρωμο υγρό, αναμίξιμο με το νερό και την πλειονότητα των οργανικών υγρών. Είναι ένας συνηθισμένος διαλύτης για χημικές αντιδράσεις. Το καθαρό διμεθυλομεθαναμίδιο είναι άοσμο, αλλά τα εμπορικά του σκευάσματα συχνά έχουν μια οσμή ψαρίλας, που οφείλεται σε προσμίξεις διμεθυλαμίνης, που περιέχουν. Είναι ένας πολικός και υδρόφιλος απρωτικός διαλύτης με υψηλό σημείο ζέσης. Είναι λειτουργικός διαλύτης για αντιδράσεις που ακολουθούν το μηχανισμούς όπως τον SN2. Δεν είναι σταθερό παρουσία ισχυρών βάσεων ή ισχυρών οξέων, γιατί παρουσία αυτών υδρολύεται σε μεθανικό οξύ και διμεθυλαμίνη, ιδιαίτερα σε υψηλές θερμοκρασίες. Με βάση τον χημικό τύπο, C3H7NO, έχει τα ακόλουθα 76 ισομερή θέσης (όχι όλα σταθερά):
- 1-αμινοπροπεν-1-όλη-1 με σύντομο συντακτικό τύπο CH3CH=C(NH2)OH, σε δύο (2) γεωμετρικά ισομερή.
- 2-αμινοπροπεν-1-όλη-1 με σύντομο συντακτικό τύπο CH3C(NH2)=CHOH, σε δύο (2) γεωμετρικά ισομερή.
- 3-αμινοπροπεν-1-όλη-1 με σύντομο συντακτικό τύπο H2NCH2CH=CHOH, σε δύο (2) γεωμετρικά ισομερή.
- 1-αμινοπροπεν-2-όλη-1 με σύντομο συντακτικό τύπο CH2=CHCH(NH2)OH, σε δύο (2) οπτικά ισομερή.
- 2-αμινοπροπεν-2-όλη-1 με σύντομο συντακτικό τύπο CH2=C(NH2)CH2OH, σε δύο (2) οπτικά ισομερή.
- 3-αμινοπροπεν-2-όλη-1 με σύντομο συντακτικό τύπο H2NCH=CHCH2OH, σε δύο (2) γεωμετρικά ισομερή.
- 1-αμινοπροπεν-1-όλη-2 με σύντομο συντακτικό τύπο CH3C(OH)=CHNH2, σε δύο (2) γεωμετρικά ισομερή.
- 1-αμινοπροπεν-2-όλη-2 με σύντομο συντακτικό τύπο CH2=C(OH)CH2NH2.
- Προπεν-1-υδροξυλαμίνη-1 με σύντομο συντακτικό τύπο CH3CH=CHNHOH, σε δύο (2) γεωμετρικά ισομερή.
- Προπεν-2-υδροξυλαμίνη-1 με σύντομο συντακτικό τύπο CH2=CHCH2NHOH, σε δύο (2) γεωμετρικά ισομερή.
- Προπενυδροξυλαμίνη-2 με σύντομο συντακτικό τύπο CH3C(NHOH)=CH2.
- 1-μεθυλαμινοαιθενόλη με σύντομο συντακτικό τύπο CH2=C(NHCH3)OH.
- 2-μεθυλαμινοαιθενόλη με σύντομο συντακτικό τύπο CH3NHCH=CHOH, σε δύο (2) γεωμετρικά ισομερή.
- Βινυλαμινομεθανόλη με σύντομο συντακτικό τύπο CH2=CHNHCH2OH.
- N-μεθυλοαιθενυδροξυλαμίνη με σύντομο συντακτικό τύπο CH2=CHN(OH)CH3.
- 1-μεθοξυαιθεναμίνη με σύντομο συντακτικό τύπο CH2=C(OCH3)NH2.
- 2-μεθοξυαιθεναμίνη με σύντομο συντακτικό τύπο CH3OCH=CHNH2, σε δύο (2) γεωμετρικά ισομερή.
- Ν-μεθοξυαιθεναμίνη με σύντομο συντακτικό τύπο CH2=CHNHOCH3.
- Αιθενοξυμεθαναμίνη με σύντομο συντακτικό τύπο CH2=CHOCH2NH2.
- 1-ιμινοπροπανόλη-1 με σύντομο συντακτικό τύπο CH3CH2C(=NH)OH.
- 2-ιμινοπροπανόλη-1 με σύντομο συντακτικό τύπο CH3C(=NH)CH2OH.
- 3-ιμινοπροπανόλη-1 με σύντομο συντακτικό τύπο HN=CHCH2CH2OH.
- Ιμινοπροπανόλη-2 με σύντομο συντακτικό τύπο CH3CH(OH)CH=NH.
- Προπανυδροξυλιμίνη-1 με σύντομο συντακτικό τύπο CH3CH2CH=NOH.
- Προπανυδροξυλιμίνη-2 με σύντομο συντακτικό τύπο CH3C(=NOH)CH3.\
- 1-μεθυλενιμιναιθανόλη με σύντομο συντακτικό τύπο CH3CH(N=CH2)OH.
- 2-μεθυλενιμιναιθανόλη με σύντομο συντακτικό τύπο CH2=NCH2CH2OH.
- 1-μεθυλιμιναιθανόλη με σύντομο συντακτικό τύπο CH3C(=NCH3)OH.
- 2-μεθυλιμιναιθανόλη με σύντομο συντακτικό τύπο CH3N=CHCH2OH.
- Αιθυλιμινομεθανόλη με σύντομο συντακτικό τύπο CH3CH2N=CHOH.
- Αιθυλιδενιμινομεθανόλη με σύντομο συντακτικό τύπο CH3CH=NCH2OH.
- 1-μεθοξυαιθανιμίνη με σύντομο συντακτικό τύπο CH3C(OCH3)=NH.
- 2-μεθοξυαιθανιμίνη με σύντομο συντακτικό τύπο CH3OCH3CH=NH.
- Αιθοξυμεθανιμίνη με σύντομο συντακτικό τύπο CH3CH2OCH2=NH.
- Μεθοξυ-N-μεθυλομεθανιμίνη με σύντομο συντακτικό τύπο CH3ΟCH=NCH3.
- N-μεθοξυμεθυλομεθανιμίνη με σύντομο συντακτικό τύπο CH3ΟCH2N=CH2.
- 1-νιτρωδοπροπάνιο με σύντομο συντακτικό τύπο CH3CH2CH2NO.
- 2-νιτρωδοπροπάνιο με σύντομο συντακτικό τύπο CH3CH(NO)CH3.
- 2-αμινοπροπανάλη με σύντομο συντακτικό τύπο CH3CH(NH2)CHO, σε δύο (2) οπτικά ισομερή.
- 3-αμινοπροπανάλη με σύντομο συντακτικό τύπο H2NCH2CH2CHO.
- Μεθυλαμιναιθανάλη με σύντομο συντακτικό τύπο CH3NHCH2CHO.
- Αμινοπροπανόνη με σύντομο συντακτικό τύπο CH3COCH2NH2.
- Προπαναμίδιο με σύντομο συντακτικό τύπο CH3CH2CONH2.
- N-μεθυλαιθαναμίδιο με σύντομο συντακτικό τύπο CH3CONHCH3.
- Ν-αιθυλομεθαναμίδιο με σύντομο συντακτικό τύπο HCONHCH2CH3.
- 3,Ν-εποξυπροπαναμίνη-1 ή 1,2-οξαζολιδίνη.
- 1',2-εποξυ-N-μεθυλαιθαναμίνη ή 1,3-οξαζολιδίνη.
- N,2-εποξυ-N-μεθυλαιθαναμίνη ή N-μεθυλο-1,2-οξετιδίνη.
- 1,Ν-εποξυπροπαναμίνη-2 ή 3-μεθυλο-1,2-οξετιδίνη.
- 2,Ν-εποξυπροπαναμίνη-1 ή 4-μεθυλο-1,2-οξετιδίνη.
- 1,1'-εποξυ-Ν-μεθυλαιθαναμίνη ή 2-μεθυλο-1,3-οξετιδίνη.
- 1,1'-εποξυ-Ν,Ν-διμεθυλομεθναμίνη ή N-μεθυλο-1,3-οξετιδίνη.
- 1,3-εποξυπροπαναμίνη-1 ή 2-αμινοοξετάνιο'.
- 1,3-εποξυπροπαναμίνη-2 ή 3-αμινοοξετάνιο'.
- 1,3-επαζω-N-υδροξυπροπάνιο ή N-υδροξυαζετιδίνη.
- 1,3-επαζωπροπανόλη-1 ή 2-υδροξυαζετιδίνη.
- 1,3-επαζωπροπανόλη-2 ή 3-υδροξυαζετιδίνη.
- 1',Ν-εποξυ-N-μεθυλαιθαναμίνη ή N-αιθυλοξαζιριδίνη.
- 1,Ν-εποξυ-N-μεθυλαιθαναμίνη ή 3,Ν-διμεθυλοξαζιριδίνη.
- 2,Ν-εποξυπροπαναμίνη-2 ή 3,3-διμεθυλοξαζιριδίνη.
- 1,2-εποξυπροπαναμίνη-2 ή 2-αμινο-2-μεθυλοξιράνιο.
- 1,2-εποξυπροπαναμίνη-1 ή 2-αμινο-3-μεθυλοξιράνιο.
- 2,3-εποξυπροπαναμίνη-1 ή αμινομεθυλοξιράνιο.
- 1,2-εποξυ-N-μεθυλαιθαναμίνη ή μεθυλαμινοξιράνιο.
- 2,3-επαζωπροπανόλη-2 ή 2-μεθυλο-2-υδροξυαζιριδίνη.
- 1,2-επαζωπροπανόλη-1 ή 3-μεθυλο-2-υδροξυαζιριδίνη.
- Ν-υδροξυ-1,2-επαζωπροπάνιο] ή 2-μεθυλο-N-υδροξυαζιριδίνη.
- N-μεθυλο-1,2-επαξαιθανόλη ή N-μεθυλο-2-υδροξυαζιριδίνη.
- N-υδροξυμεθυλο-1,2-επαζωπροπάνιο ή N-υδροξυμεθυλαζιριδίνη.
- 2,3-επαζωπροπανόλη-1 ή 2--υδροξυμεθυλαζιριδίνη.
- N-μεθοξυεπαζαιθάνιο ή N-μεθοξυαζιριδίνη.
- 1-μεθοξυεπαζαιθάνιο ή 2-μεθοξυαζιριδίνη.
- 1-αμινοκυκλοπροπανόλη.
- 2-αμινοκυκλοπροπανόλη σε δύο (2) γεωμετρικά ισομερή.
- Κυκλοπροπανυδροξυλαμίνη
- Αμινοξυκυκλοπροπάνιο.
Δομή και ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]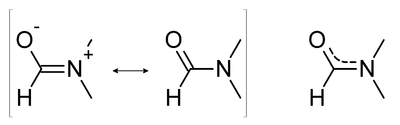
Λόγω της συνεισφοράς των δυο πιθανών δομών αναπαράστασης ενός αμιδίου, ο βαθμός συμετοχής του διπλού δεσμού στο καρβονύλιο είναι μειωμένος, ενώ ο αντίστοιχος C-N είναι αυξημένος. Έτσι το φάαμα υπερύθρου του διμεθυλομεθαναμιδίου δείχνει χαμηλότερα τη συχνότητα στρέψης του δεσμού C=O, στα 1676 cm−1[1], σε σχέση με ένα συνηθισμέμο δεσμό C=O. Επίσης, εξαιτίας του μερικού διπλού δεσμού στον C-N, η περιστροφή γύρω απ' αυτόν τον άξονα είναι αργή στη θερμοκρασία δωματίου, κάνοντας τα δυο μεθύλια ανισοδύναμα στο NMR, δίνοντας κορυφές σε δύο περιοχές των τριών πρωτονίων, στα 2,97 και 2,88 δ, αντίστοιχα[1], αντί για την αναμενόμενη μια περιοχή των 6 συνολικά πρωτονίων.
| Δεσμοί[2][3] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C#1',#1"-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C#1-H | σ | 2sp2-1s | 107 pm | 3% C- H+ |
| C=O | σ | 2sp2-2sp2 | 134 pm | 19% C+ O- |
| π | 2p-2p | |||
| C#1'-N | σ | 2sp3-2sp3 | 151 pm | 6% C+ N- |
| C#1"-N | σ | 2sp3-2sp3 | 151 pm | 6% C+ N- |
| C#1-N | σ | 2sp2-2sp3 | 149 pm | 6% C+ N- |
| Στατιστικό ηλεκτρικό φορτίο[4] | ||||
| O | -0,38 | |||
| N | -0,18 | |||
| C#1' | -0,03 | |||
| C#1" | -0,03 | |||
| Η (H-C) | +0,03 | |||
| Η (H-N) | +0,17 | |||
| C#1 | +0,41 | |||
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Με φορμυλίωση διμεθυλαμίνης
[Επεξεργασία | επεξεργασία κώδικα]1. Με επίδραση μεθανοϋλοαλογονίδιου (HCOX) σε διμεθυλαμίνη παράγεται N,N-Διμεθυλομεθαναμίδιο[5]:
2. Με επίδραση μονοξειδίου του άνθρακα σε διμεθυλαμίνη, παρουσία μεθανόλης παράγεται N,N-Διμεθυλομεθαναμίδιο[6]
Με αμινόλυση μεθανικού αλκυλεστέρα
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση διμεθυλαμίνης σε κάποιο μεθανικό αλκυλεστέρα (HCOOR) παράγεται N,N-Διμεθυλομεθαναμίδιο
Χημικές ιδιότητες και παράγωγα
[Επεξεργασία | επεξεργασία κώδικα]Υδρόλυση
[Επεξεργασία | επεξεργασία κώδικα]Το N,N-διμεθυλομεθαναμίδιο υδρολύεται σχηματίζοντας μεθανικό οξύ και διμεθυλαμίνη[7]:
- Η αντίδραση καταλύεται από την ύπαρξη οξέων ή βάσεων. Ο ιονισμός των προϊόντων εξαρτάται από το pH. Σε όξινο pH παράγεται HCOOH και (CH3)2NH2+. Σε αλκαλικό παράγεται HCOO- και (CH3)2NH. Σε κάποια ενδιάμεση περιοχή παράγεται HCOONH2(CH3)2 (δηλαδή έχουμε ιονισμό και των δύο).
Βασική συμπεριφορά
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση ισχυρών οξέων σχηματίζει αντίστοιχα άλατα[8]. Π.χ.:
Αναγωγή
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση υδρογόνου ή λιθιοαργιλλιοϋδρίδιου σε N,N-διμεθυλομεθαναμίδιο παράγεται τριμεθυλαμίνη[9]:
Αποικοδόμηση Hofmann
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση υποβρωμιούχου καλίου (BrOK) το N,N-διμεθυλομεθαναμίδιο αποικοδομείται σε διμεθυλαμίνη και ανθρακικό κάλιο[10]:
- Το υποβρωμιούχο κάλιο παράγεται συνήθως επιτόπου («in situ»), με την επίδραση υδροξειδίου του καλίου (KOH) σε στοιχειακό βρώμιο:
Εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]Η κύρια χρήση του διμεθυλοφορμαμιδίου είναι ως ένας διαλύτης με χαμηλό βαθμό εξάτμησης. Χρησιμοποιήθηκε ακόμη στην παραωγή ακρυλικών υφασμάτων και πλαστικών. Χρησιμοποιήθηκε ακόμη ως διαλύτης πεπτιδίων για φαρμακευτικά και για την ανάπτυξη και παραγωγή φυτοφαρμάκων και στην παραγωγή κόλλας, συνθεττικού δέρματος, υφασμάτων, φιλμ και επικαλύψεις επιφανειών[11]. Πιο εξειδικευμένα:
- Χρησιμοποιήθηκε ως αντιδραστήριο για τη σύνθεση αλδεϋδών στη σύνθεση Bouveault και στην αντίδραση Vilsmeier-Haack, άλλη μια χρήσιμη μέθοδος σχηματισμού αλδεϋδών.
- Χρησιμοποιήθηκε ως συνηθισμένος καταλύτης για τη σύνθεση ακυλαλογονιδίων και πιο συγκεκριμένα ακυλοχλωριδίων από καρβοξυλικά οξέα, χρησιμοποιώντας θειονυλοχλωρίδιο (SOCl2)[12].
- Διαπερνά τα περισσότερα πλαστικά, κάνοντάς τα να φουσκώνουν. Αυτή η ιδιότητα είναι πολύ χρήσιμη για τη σύνθεση πεπτιδίων στη στερεή κατάσταση. Επίσης συχνά
- Είναι πολύ χρήσιμο στο διαχωρισμό και την αναστολή ανθρακούχων νανοσωλήνων και είναι προτεινόμενο από τη NIST για τη χρήση του στη φασματοσκοπία εγγύς υπερύθρου[13].
- Χρησιμοποιήθηκε ως ένας διαλύτης για την ανάκτηση ολεφινών, όπως το βουταδιένιο-1,3, μέσω εξαντλητικής απόσταξης.
- Χρησιμοποιήθηκε ακόμη στην παραγωγή βερνικιών ως διαλύτης και ως μια σημαντική πρώτη ύλη. Κατααναλώνεται κατά τη διάρκεια των σχετικών αντιδράσεων (άρα μετέχει σ' αυτές).
- Το καθαρό αέριο αιθίνιοδεν μπορεί να συμπιεστεί και να αποθηκευτεί χωρίς κίνδυνο έκρηξης. Γι' αυτό το βιομηχανικό αιθίνιο διαλύεται σε N,N-διμεθυλομεθαναμίδιο και αποθηκεύεται σε μεταλλικούς κυλίνδρους ή φιάλες. Για τον ίδιο σκοπό γεμίζεται επίσης με αγκαμασσάν, που κάνει τη μεταφορά και τη χρήση ακόμη πιο ασφαλή.
Ασφάλεια και τοξικότητα
[Επεξεργασία | επεξεργασία κώδικα]Οι αντιδράσεις που περιλαμβάνουν τη χρήση του υδριδίου του νατρίου (NaH) σε Ν.Ν-διμεθυλοφορμαμίδιο ως διαλύτη είναι κάπως επικύνδινες: Έχουν αναφερθεί εξώθερμες διασπάσεις, ακόμη και σε θερμοκρασίες κάτω από 26 °C. Σε εργαστηριακή κλίμακα κάθε θερμική διεργασία συνήθως γρήγορα γίνεται αντιληπτή και τίθεται κάτω από έλεγχο με τη χρήση ενός παγόλουτρου και αυτός παραμένει ένας προσφιλής συνδυασμός αντιδραστηρίων. Από την άλλη, σε επίπεδο πειραματικών μονάδων, έχουν αναφερθεί αρκετά ατυχήματα[14].
To N,N-διμεθυλομεθαναμίδιο έχει συνδεθεί με τον καρκίνο στους ανθρώπους και θεωρήθηκε υπεύθυνο για το θάνατο νεογνών. Γι' αυτόν το λόγο σε ορισμένα τμήματα βιομηχανιών που χρησιμοποιούν το N,N-διμεθυλομεθαναμίδιο, έχει απαγορευθεί η συμμετοχή γυναικών ως εργαζόμενων. Για πολλούς τέτοιους κινδύνους έχει αντικατασταθεί (όπου είναι εφικτό) από το διμεθυλοσουλφίδιο. Πολλοί παραγωγοί N,N-διμεθυλομεθαναμίδιου, το έχουν τοποθετήσει στις άμεσες ή χρόνιες απειλές κατά της ζωής στα MSDS τους, εφόσον (εκτός των άλλων) το N,N-διμεθυλομεθαναμίδιο δεν αποβάλλεται εύκολα από οργανισμό που έχει επιρεάσει. Σύμφωνα με το IARC το N,N-διμεθυλομεθαναμίδιο είναι ένα πιθανό καρκινογόνο, παρόλο που το EPA δεν το θεωρεί καθόλου ως επικύνδινο για καρκινογένεση.
Σημειώσεις και αναφορές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,0 1,1 Spectral Database for Organic Compounds, Dimethylformamide[νεκρός σύνδεσμος], accessed 27 Jan 2007.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το Table of periodic properties of thε Elements, Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 34.
- ↑ LeBlanc, Jr., O. H.; Laurie, V. W.; Gwinn, W. D. “Microwave Spectrum, Structure, and Dipole Moment of Formyl Fluoride” The Journal of Chemical Physics 1960, volume 33, pp. 598-600.
- ↑ Υπολογισμένο βάσει του ιονισμού από τον παραπάνω πίνακα
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 296, §13.2.Γ1.
- ↑ Klaus Weissermel, Hans-Jürgen Arpe. Industrial Organic Chemistry: Important Raw Materials and Intermediates. Wiley-VCH. σελίδες 45–46. ISBN 3527305785.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 302, §13.6.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 303, §13.6.3-4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 303, §13.6.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 303, §13.6.7.
- ↑ Redlich, C; Beckett, W. S.; Sparer, J.; Barwick, K. W.; Riely, C. A.; Miller, H.; Sigal, S. L.; Shalat, S. L. και άλλοι. (1988). «Liver disease associated with occupational exposure to the solvent dimethylformamide». Ann. Intern. Med. 108 (5): 680–686. PMID 3358569. https://archive.org/details/sim_annals-of-internal-medicine_1988-05_108_5/page/680.
- ↑ Clayden, Jonathan (2001). Organic chemistry. Oxford: Oxford University Press. σελίδες 276–296. ISBN 0-19-850346-6.
- ↑ Haddon, Robert; Itkis, Mikhail (March, 2008) (PDF). Measurement Issues in Single Wall Carbon Nanotubes. NIST, σελ. 20. Αρχειοθετήθηκε από το πρωτότυπο στις 2008-09-25. https://web.archive.org/web/20080925014906/http://www.nist.gov/public_affairs/practiceguides/NIST%20SP960-19.pdf. Ανακτήθηκε στις 2008-08-15.
- ↑ UK Chemical Reaction Hazards Forum Αρχειοθετήθηκε 2011-10-06 στο Wayback Machine. and references cited therein
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Γ. Βάρβογλη, Ν. Αλεξάνδρου: Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, Χημεία Οργανικών Ενώσεων, παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ν.Α. Πετάση: Ασκήσεις και προβλήματα Οργανικής Χημείας, 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.









