Εναντιομερές

Στη χημεία, ένα εναντιομερές [1] που ονομάζεται και οπτικό ισομερές,[2] αντίποδας,[3] ή οπτικός αντίποδας[4] – είναι ένα από τα δύο στερεοϊσομερή (stereoisomers) (που δεν μπορούν να ταυτιστούν με τη δική τους κατοπτρική εικόνα). Τα εναντιομερή μεταξύ τους μοιάζουν πολύ με το δεξί και το αριστερό χέρι, χωρίς να αντικατοπτρίζεται ένα από αυτά, τα χέρια δεν μπορούν να τοποθετηθούν το ένα πάνω στο άλλο.[5] Είναι αποκλειστικά μια σχέση χειρομορφίας και των μόνιμων τρισδιάστατων σχέσεων μεταξύ μορίων ή άλλων χημικών δομών: κανένας επαναπροσανατολισμός ενός μορίου στο σύνολό του ή διαμορφωτική αλλαγή δεν μετατρέπει μια χημική ουσία στο εναντιομερές της. Οι χημικές δομές με χειρομορφία περιστρέφουν το επίπεδο πολωμένο φως.[6] Ένα μείγμα ίσων ποσοτήτων κάθε εναντιομερούς, ένα ρακεμικό μείγμα (racemic mixture ή racemate), δεν περιστρέφει το φως.[7][8] [9] Τα στερεοϊσομερή περιλαμβάνουν τόσο τα εναντιομερή όσο και τα διαστερεομερή. Τα διαστερεομερή, όπως και τα εναντιομερή, μοιράζονται τον ίδιο μοριακό τύπο και είναι επίσης μη ταυτόσημα μεταξύ τους. Ωστόσο, δεν είναι κατοπτρικές εικόνες το ένα του άλλου.[10]
Συμβάσεις ονομασίας
[Επεξεργασία | επεξεργασία κώδικα]Υπάρχουν τρεις κοινές συμβάσεις ονομασίας για τον προσδιορισμό ενός από τα δύο εναντιομερή (η απόλυτη διαμόρφωση (absolute configuration)) ενός δεδομένου χειρόμορφου μορίου: το σύστημα R/S βασίζεται στη γεωμετρία του μορίου, το σύστημα (+)- και (−)- (επίσης γραμμένο χρησιμοποιώντας τα παρωχημένα ισοδύναμα d- και l-) βασίζεται στις ιδιότητες οπτικής περιστροφής του και το σύστημα D/L βασίζεται στη σχέση του μορίου με τα εναντιομερή της γλυκεριναλδεΰδης. Το σύστημα R/S βασίζεται στη γεωμετρία του μορίου σε σχέση με ένα χειρόμορφο κέντρο.[11] Το σύστημα R/S εκχωρείται σε ένα μόριο με βάση τους κανόνες προτεραιότητας που ορίζονται από τους κανόνες προτεραιότητας Cahn–Ingold–Prelog, όπου η ομάδα ή το άτομο με τον μεγαλύτερο ατομικό αριθμό έχει την υψηλότερη προτεραιότητα και στην ομάδα ή στο άτομο με τον μικρότερο ατομικό αριθμό αποδίδεται η μικρότερη προτεραιότητα. Το σύμβολο (+) ή (−) χρησιμοποιείται για να καθορίσει την οπτική περιστροφή ενός μορίου — την κατεύθυνση στην οποία περιστρέφεται η πόλωση του φωτός καθώς διέρχεται από ένα διάλυμα που περιέχει το μόριο.[12] Όταν ένα μόριο συμβολίζεται δεξιόστροφο, περιστρέφει το επίπεδο του πολωμένου φωτός δεξιόστροφα και μπορεί επίσης να συμβολιστεί ως (+).Όταν συμβολίζεται ως αριστερόστροφο, περιστρέφει το επίπεδο του πολωμένου φωτός αριστερόστροφα και μπορεί επίσης να συμβολιστεί ως (−).[11] Οι λατινικές λέξεις για το "αριστερά" είναι "laevus" και "sinister" και η λέξη για "δεξιά" είναι "dexter" (ή "rectus" με την έννοια του ορθού ή ενάρετου). Αυτή είναι η προέλευση των συμβολισμών D/L και R/S και η χρήση των προθεμάτων levo- και dextro- στο κοινά ονόματα. Το πρόθεμα ar-, από το λατινικό recto (δεξιά), εφαρμόζεται στη δεξιά έκδοση. es-, από το λατινικό sinister (αριστερά), στο αριστερόστροφο μόριο. Παράδειγμα: κεταμίνη, αρκεταμίνη, εσκεταμίνη.
Κέντρα χειρομορφίας
[Επεξεργασία | επεξεργασία κώδικα]
Το ασύμμετρο άτομο ονομάζεται κέντρο χειρομορφίας,[13][14] ένας τύπος στερεοκέντρου. Ένα κέντρο χειρομορφίας ονομάζεται επίσης "χειρόμορφο κέντρο"[15][16][17] ή ασύμμετρο κέντρο.[18] Ορισμένες πηγές χρησιμοποιούν τους όρους στερεόκεντρο, στερεογενές κέντρο, στερεογενές άτομο ή στερεογόνο για να αναφέρονται αποκλειστικά σε ένα κέντρο χειρομορφίας,[15][17][19] ενώ άλλοι χρησιμοποιούν τους όρους ευρύτερα για να αναφέρονται επίσης σε κέντρα που καταλήγουν σε διαστερεομερή (στερεοϊσομερή που δεν είναι εναντιομερή).[14][20][21] Οι ενώσεις που περιέχουν ακριβώς ένα (ή οποιονδήποτε περιττό αριθμό) ασύμμετρων ατόμων είναι πάντα χειρόμορφες. Ωστόσο, οι ενώσεις που περιέχουν άρτιο αριθμό ασύμμετρων ατόμων μερικές φορές στερούνται χειρομορφίας, επειδή είναι διατεταγμένες σε ζεύγη συμμετρικών κατόπτρων και είναι γνωστές ως μεσοενώσεις (meso compounds). Για παράδειγμα, το μέσο τρυγικό οξύ (φαίνεται στα δεξιά) έχει δύο ασύμμετρα άτομα άνθρακα, αλλά δεν παρουσιάζει εναντιομέρεια, επειδή υπάρχει ένα κατοπτρικό επίπεδο συμμετρίας. Αντίθετα, υπάρχουν χειρομορφές που δεν απαιτούν ασύμμετρα άτομα, όπως η αξονική, η επίπεδη και η ελικοειδής.[15]:pg. 3 Παρόλο που ένα χειρόμορφο μόριο δεν έχει συμμετρίες ανάκλασης (Cs) και στροφική ανάκλαση (S2n), μπορεί να έχει άλλες μοριακές συμμετρίες, και η συμμετρία του περιγράφεται από μία από τις χειρόμορφες ομάδες σημείων: Cn, D n, T, O ή I. Για παράδειγμα, το υπεροξείδιο του υδρογόνου είναι χειρόμορφο και έχει C2 (διπλή περιστροφική) συμμετρία. Μια κοινή χειρόμορφη περίπτωση είναι η ομάδα σημείων C1, που σημαίνει ότι δεν υπάρχουν συμμετρίες, κάτι που ισχύει για το γαλακτικό οξύ.
Παραδείγματα
[Επεξεργασία | επεξεργασία κώδικα]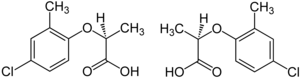

Ένα παράδειγμα τέτοιου εναντιομερούς είναι το ηρεμιστικό (sedative) θαλιδομίδη, το οποίο πωλήθηκε σε πολλές χώρες σε όλο τον κόσμο από το 1957 έως το 1961. Αποσύρθηκε από την αγορά όταν διαπιστώθηκε ότι προκαλεί γενετικές ανωμαλίες. Το ένα εναντιομερές προκάλεσε τα επιθυμητά ηρεμιστικά αποτελέσματα, ενώ το άλλο, [22] που υπήρχε σε ίσες ποσότητες, προκάλεσε γενετικές ανωμαλίες.[23] Το ζιζανιοκτόνο mecoprop είναι ένα ρακεμικό μείγμα, με το (R)-(+)-εναντιομερές ("Mecoprop-P", "Duplosan KV") να έχει την ζιζανιοκτόνο δράση.[24] Ένα άλλο παράδειγμα είναι τα αντικαταθλιπτικά φάρμακα εσιταλοπράμη και σιταλοπράμη. Η σιταλοπράμη είναι ένα ρακεμικό μείγμα [1:1 (S)-σιταλοπράμης και (R)-σιταλοπράμης]. Η εσιταλοπράμη [(S)-σιταλοπράμη] είναι ένα καθαρό εναντιομερές. Οι δόσεις για την εσιταλοπράμη είναι τυπικά το 1/2 αυτών για τη σιταλοπράμη. Εδώ, η (S)-σιταλοπράμη ονομάζεται χειρόμορφος διακόπτης (chiral switch) της σιταλοπράμης.
Χειρόμορφα φάρμακα
[Επεξεργασία | επεξεργασία κώδικα]Οι εναντιοκαθαρές ενώσεις αποτελούνται μόνο από ένα από τα δύο εναντιομερή. Η εναντιοκαθαρότητα είναι πρακτικής σημασίας αφού τέτοιες συνθέσεις έχουν βελτιωμένη θεραπευτική αποτελεσματικότητα.[25] Η μετάβαση από ένα ρακεμικό φάρμακο σε ένα εναντιοκαθαρό φάρμακο ονομάζεται χειρόμορφος διακόπτης (chiral switch). Σε πολλές περιπτώσεις, τα εναντιομερή έχουν διακριτά αποτελέσματα. Μία περίπτωση είναι αυτή της δεξτροπροποξυφαίνης (dextropropoxyphene). Το εναντιομερές ζεύγος προποξυφαίνης πωλείται ξεχωριστά από την Eli Lilly. Ο ένας από τους παράγοντες είναι της δεξτροπροποξυφαίνης, ένας αναλγητικός παράγοντας (Darvon) και ο άλλος ονομάζεται λεβοπροποξυφαίνη, ένα αποτελεσματικό αντιβηχικό (Novrad).[26][27] Είναι ενδιαφέρον να σημειωθεί ότι οι εμπορικές ονομασίες των φαρμάκων, DARVON και NOVRAD, αντικατοπτρίζουν επίσης τη σχέση χημικού καθρέφτη-εικόνας. Σε άλλες περιπτώσεις, μπορεί να μην υπάρχει κλινικό όφελος για τον ασθενή. Σε ορισμένες περιοχές, τα φάρμακα ενός εναντιομερούς μπορούν να κατοχυρωθούν χωριστά από το ρακεμικό μείγμα.[28] Είναι πιθανό ότι μόνο ένα από τα εναντιομερή είναι ενεργό. Ή, μπορεί να είναι και τα δύο ενεργά, οπότε ο διαχωρισμός του μείγματος δεν έχει αντικειμενικά οφέλη, αλλά επεκτείνει τη δυνατότητα κατοχύρωσης με δίπλωμα ευρεσιτεχνίας του φαρμάκου.[29]
Εναντιοεκλεκτικά σκευάσματα
[Επεξεργασία | επεξεργασία κώδικα]Ελλείψει αποτελεσματικού εναντιομερούς περιβάλλοντος πρόδρομης ουσίας, ο χειρόμορφος καταλύτης ή κινητικής επίλυσης (kinetic resolution), ο διαχωρισμός ενός ρακεμικού μίγματος στα εναντιομερή του συστατικά είναι αδύνατος, αν και ορισμένα ρακεμικά μείγματα κρυσταλλώνονται αυθόρμητα με τη μορφή ενός ρακεμικού συσσωματώματος, στο οποίο οι κρύσταλλοι των εναντιομερών διαχωρίζονται φυσικά και μπορούν να διαχωριστούν μηχανικά. Ωστόσο, τα περισσότερα ρακεμικά μείγματα σχηματίζουν κρυστάλλους που περιέχουν και τα δύο εναντιομερή σε αναλογία 1:1. Στην πρωτοποριακή του εργασία, ο Λουί Παστέρ μπόρεσε να απομονώσει τα ισομερή του εναμμώνιου τρυγικού νατρίου επειδή τα μεμονωμένα εναντιομερή κρυσταλλώνονται χωριστά από το διάλυμα. Βεβαίως, παράγονται ίσες ποσότητες των εναντιομόρφων κρυστάλλων, αλλά τα δύο είδη κρυστάλλων μπορούν να διαχωριστούν με τσιμπιδάκια. Αυτή η συμπεριφορά είναι ασυνήθιστη. Μια λιγότερο συνηθισμένη μέθοδος είναι η enantiomer self-disproportionation. Η δεύτερη στρατηγική είναι η ασύμμετρη σύνθεση: η χρήση διαφόρων τεχνικών για την προετοιμασία της επιθυμητής ένωσης σε υψηλή εναντιομερή περίσσεια (enantiomeric excess). Οι τεχνικές που περιλαμβάνονται περιλαμβάνουν τη χρήση χειρόμορφων αρχικών υλικών (σύνθεση χειρόμορφης δεξαμενής (chiral pool synthesis)), τη χρήση χειρόμορφων βοηθητικών ουσιών και χειρόμορφων καταλυτών και την εφαρμογή ασύμμετρης επαγωγής (asymmetric induction). Η χρήση ενζύμων (βιοκατάλυση) μπορεί επίσης να παράξει την επιθυμητή ένωση. Μια τρίτη στρατηγική είναι η εναντιοσυγκλίνουσα σύνθεση (Enantioconvergent synthesis), η σύνθεση ενός εναντιομερούς από έναν ρακεμικό πρόδρομο, χρησιμοποιώντας και τα δύο εναντιομερή. Με τη χρήση ενός χειρόμορφου καταλύτη, και τα δύο εναντιομερή του αντιδρώντος καταλήγουν σε ένα μόνο εναντιομερές του προϊόντος.[30] Τα εναντιομερή μπορεί να μην είναι απομονώσιμα, εάν υπάρχει μια προσιτή οδός για ρακεμοποίηση (αλληλομετατροπή μεταξύ εναντιομορφών για να δώσει ένα ρακεμικό μείγμα) σε μια δεδομένη θερμοκρασία και χρονική κλίμακα. Για παράδειγμα, οι αμίνες με τρεις διακριτούς υποκαταστάτες είναι χειρόμορφες, αλλά με λίγες εξαιρέσεις (π.χ. υποκατεστημένες Ν-χλωροαζιριδίνες), υφίστανται ταχέως "αναστροφή ομπρέλας (umbrella inversion)" σε θερμοκρασία δωματίου, οδηγώντας σε ρακεμοποίηση. Εάν η ρακεμοποίηση είναι αρκετά γρήγορη, το μόριο μπορεί συχνά να αντιμετωπιστεί ως μη χειρόμορφη δομή με μέσο όρο.
Παραβίαση ισοτιμίας
[Επεξεργασία | επεξεργασία κώδικα]Για όλες τις προθέσεις και σκοπούς, κάθε εναντιομερές σε ένα ζευγάρι έχει την ίδια ενέργεια. Ωστόσο, η θεωρητική φυσική προβλέπει ότι λόγω παραβίαση ισοτιμίας (parity violation) της ασθενούς πυρηνικής δύναμης (η μόνη δύναμη στη φύση που μπορεί να "διακρίνει αριστερά από δεξιά"), υπάρχει στην πραγματικότητα ένα "λεπτό" διαφορά ενέργειας μεταξύ των εναντιομερών (της τάξης των 10−12 eV ή 10−10 kJ/mol ή λιγότερο) λόγω του μηχανισμού ασθενούς ουδέτερου ρεύματος (weak neutral current) . Αυτή η διαφορά στην ενέργεια είναι πολύ μικρότερη από τις ενεργειακές αλλαγές που προκαλούνται από έστω και μικρές αλλαγές στη μοριακή διαμόρφωση, και πολύ μικρή για να μετρηθεί με την τρέχουσα τεχνολογία, και επομένως είναι χημικά ασήμαντη.[16][31][32] Με την έννοια που χρησιμοποιούν οι φυσικοί των σωματιδίων, το αληθινό εναντιομερές ενός μορίου, το οποίο έχει ακριβώς το ίδιο περιεχόμενο μάζας-ενέργειας με το αρχικό μόριο, είναι μια κατοπτρική εικόνα που είναι επίσης χτισμένη από αντιύλη (αντιπρωτόνια, αντινετρόνια και ποζιτρόνια).[16] Σε όλο αυτό το άρθρο, το "εναντιομερές" χρησιμοποιείται μόνο με τη χημική έννοια των ενώσεων της συνηθισμένης ύλης που δεν μπορούν να υπερτίθενται στην κατοπτρική τους εικόνα.
Οιονεί-εναντιομερή
[Επεξεργασία | επεξεργασία κώδικα]Τα οιονεί-εναντιομερή είναι μοριακά είδη που δεν είναι αυστηρά εναντιομερή, αλλά συμπεριφέρονται σαν να είναι. Στα οιονεί-εναντιομερή αντανακλάται το μεγαλύτερο μέρος του μορίου. Ωστόσο, ένα άτομο ή μια ομάδα εντός του μορίου αλλάζει σε ένα παρόμοιο άτομο ή ομάδα.[33] Τα οιονεί-εναντιομερή μπορούν επίσης να οριστούν ως μόρια που έχουν τη δυνατότητα να γίνουν εναντιομερή, εάν αντικατασταθεί ένα άτομο ή μια ομάδα στο μόριο.[34] Ένα παράδειγμα οιονεί-εναντιομερών θα ήταν (S)-βρωμοβουτάνιο και (R)-ιωδοβουτάνιο. Υπό κανονικές συνθήκες τα εναντιομερή για (S)-βρωμοβουτάνιο και (R)-ιωδοβουτάνιο θα ήταν (R)-βρωμοβουτάνιο και (S)-ιωδοβουτάνιο αντίστοιχα. Τα οιονεί-εναντιομερή θα παράγουν επίσης οιονεί ρακεμικά, τα οποία είναι παρόμοια με τα κανονικά ρακεμικά καθώς σχηματίζουν ένα ίσο μίγμα οιονεί-εναντιομερών.[33] Αν και δεν θεωρούνται πραγματικά εναντιομερή, η σύμβαση ονομασίας για τα οιονεί εναντιομερή επίσης' ακολουθεί την ίδια τάση με τα εναντιομερή όταν εξετάζουμε διαμορφώσεις (R) και (S) - οι οποίες θεωρούνται από γεωμετρική βάση (βλ. κανόνες προτεραιότητας Cahn–Ingold–Prelog). Τα οιονεί-εναντιομερή έχουν εφαρμογές σε παράλληλη κινητική ανάλυση.[35]
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ «Enantiomer: Definition & Meaning». Dictionary.com (στα Αγγλικά). Ανακτήθηκε στις 26 Απριλίου 2024.
- ↑ Chemistry (IUPAC), The International Union of Pure and Applied. IUPAC - optical isomers (O04308). doi:. https://goldbook.iupac.org/terms/view/O04308. Ανακτήθηκε στις 2022-11-17.
- ↑ Chemistry (IUPAC), The International Union of Pure and Applied. IUPAC - antipodes (A00403). doi:. https://goldbook.iupac.org/terms/view/A00403. Ανακτήθηκε στις 2022-11-17.
- ↑ Chemistry (IUPAC), The International Union of Pure and Applied. IUPAC - optical antipodes (O04304). doi:. https://goldbook.iupac.org/terms/view/O04304. Ανακτήθηκε στις 2022-11-17.
- ↑ McConathy, Jonathan; Owens, Michael J. (2003). «Stereochemistry in Drug Action». Primary Care Companion to the Journal of Clinical Psychiatry 5 (2): 70–73. doi:. ISSN 1523-5998. PMID 15156233.
- ↑ «Chirality and Optical Activity». chemed.chem.purdue.edu. Ανακτήθηκε στις 17 Νοεμβρίου 2022.
- ↑ Chemistry (IUPAC), The International Union of Pure and Applied. IUPAC - racemic (R05026). doi:. https://goldbook.iupac.org/terms/view/R05026. Ανακτήθηκε στις 2022-11-17.
- ↑ Chemistry (IUPAC), The International Union of Pure and Applied. IUPAC - racemate (R05025). doi:. https://goldbook.iupac.org/terms/view/R05025. Ανακτήθηκε στις 2022-11-17.
- ↑ Weber, Erin. «Library Guides: CHEM 221: Stereochemistry / Isomerism». libraryguides.salisbury.edu (στα Αγγλικά). Αρχειοθετήθηκε από το πρωτότυπο στις 16 Νοεμβρίου 2022. Ανακτήθηκε στις 17 Νοεμβρίου 2022.
- ↑ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th έκδοση), New York: Wiley-Interscience, ISBN 978-0-471-72091-1, https://books.google.com/books?id=JDR-nZpojeEC&printsec=frontcover
- ↑ 11,0 11,1 Brewster, James H. (December 1986). «The distinction of diastereomers in the Cahn-Ingold-Prelog (RS) notation» (στα αγγλικά). The Journal of Organic Chemistry 51 (25): 4751–4753. doi:. ISSN 0022-3263. https://pubs.acs.org/doi/abs/10.1021/jo00375a001.
- ↑ Caldwell, John; Wainer, Irving W. (December 2001). «Stereochemistry: definitions and a note on nomenclature» (στα αγγλικά). Human Psychopharmacology: Clinical and Experimental 16 (S2): S105–S107. doi:. ISSN 0885-6222. PMID 12404716. https://onlinelibrary.wiley.com/doi/10.1002/hup.334.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "chirality centre".
- ↑ 14,0 14,1 Wade, LeRoy G. (2006). «Precision in Stereochemical Terminology». J. Chem. Educ. 83 (12): 1793. doi:. ISSN 0021-9584. Bibcode: 2006JChEd..83.1793W.
- ↑ 15,0 15,1 15,2 Karras, Manfred (2018). "Synthesis of Enantiomerically Pure Helical Aromatics Such As NHC Ligands and Their Use in Asymmetric Catalysis (PhD). Charles University. Ανακτήθηκε στις 6 Αυγούστου 2021.
- ↑ 16,0 16,1 16,2 Eliel, Ernest L.· Wilen, Samuel H.· Mander, Lewis N. (1994). Stereochemistry of organic compounds. New York: Wiley. ISBN 0471016705. OCLC 27642721.
- ↑ 17,0 17,1 Clayden, Jonathan· Greeves, Nick· Warren, Stuart G. (2012). Organic chemistry. Oxford: Oxford University Press. ISBN 978-0-19-927029-3. OCLC 761379371.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "asymmetric centre".
- ↑ Clark, Andrew· Kitson, Russell R. A.· Mistry, Nimesh· Taylor, Paul· Taylor, Matthew· Lloyd, Michael· Akamune, Caroline (2021). Introduction to stereochemistry. Cambridge, UK. ISBN 978-1-78801-315-4. OCLC 1180250839.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "stereogenic unit (stereogen/stereoelement)".
- ↑ Mislow, Kurt; Siegel, Jay (1984). «Stereoisomerism and local chirality». J. Am. Chem. Soc. 106 (11): 3319–3328. doi:. ISSN 0002-7863.
- ↑ Knoche, B; Blaschke, G (1994). «Investigations on the in vitro racemization of thalidomide by high-performance liquid chromatography». Journal of Chromatography A 666 (1–2): 235–240. doi:.
- ↑ Voet, Donald· Voet, Judith G.· Pratt, Charlotte W. (2006). Fundamentals of Biochemistry. σελ. 89. ISBN 0-471-21495-7.
- ↑ G. Smith; C. H. L. Kennard; A. H. White; P. G. Hodgson (April 1980). «(±)-2-(4-Chloro-2-methylphenoxy)propionic acid (mecoprop)». Acta Crystallogr. B 36 (4): 992–994. doi:.
- ↑ Ariëns, Everardus J. (1986). «Stereochemistry: A source of problems in medicinal chemistry». Medicinal Research Reviews 6 (4): 451–466. doi:. ISSN 0198-6325. PMID 3534485. http://dx.doi.org/10.1002/med.2610060404.
- ↑ Drayer, Dennis E (1986). «Pharmacodynamic and pharmacokinetic differences between drug enantiomers in humans: An overview». Clinical Pharmacology and Therapeutics 40 (2): 125–133. doi:. ISSN 0009-9236. PMID 3731675. http://dx.doi.org/10.1038/clpt.1986.150.
- ↑ Ariens, E.J (1989). Chiral Separations by HPLC. Chichester: Ellis Horwwod. σελίδες 31–68.
- ↑ «European Medicines Agency - - Sepracor Pharmaceuticals Ltd withdraws its marketing authorisation application for Lunivia (eszopiclone)». www.ema.europa.eu. 17 Σεπτεμβρίου 2018. Αρχειοθετήθηκε από το πρωτότυπο στις 1 Δεκεμβρίου 2017. Ανακτήθηκε στις 14 Φεβρουαρίου 2011.
- ↑ Merrill Goozner (2004). The $800 Million Pill: The Truth Behind the Cost of New Drugs (excerpt). University of California Press. ISBN 0-520-23945-8.
- ↑ Mohr, J.T.; Moore, J.T.; Stoltz, B.M. (2016). «Enantioconvergent catalysis». Beilstein J. Org. Chem. 12: 2038–2045. doi:. PMID 27829909. PMC 5082454. https://www.beilstein-journals.org/bjoc/articles/12/192. Ανακτήθηκε στις 4 August 2021.
- ↑ Albert, Guijarro (2008). The origin of chirality in the molecules of life: a revision from awareness to the current theories and perspectives of this unsolved problem. Yus, Miguel. Cambridge, UK: Royal Society of Chemistry. ISBN 9781847558756. OCLC 319518566.
- ↑ Stickler, Benjamin A.; Diekmann, Mira; Berger, Robert; Wang, Daqing (2021-09-14). «Enantiomer Superpositions from Matter-Wave Interference of Chiral Molecules» (στα αγγλικά). Physical Review X 11 (3): 031056. doi:. ISSN 2160-3308. Bibcode: 2021PhRvX..11c1056S. https://link.aps.org/doi/10.1103/PhysRevX.11.031056.
- ↑ 33,0 33,1 Zhang, Qisheng; Rivkin, Alexey; Curran, Dennis P. (2002-05-01). «Quasiracemic Synthesis: Concepts and Implementation with a Fluorous Tagging Strategy to Make Both Enantiomers of Pyridovericin and Mappicine» (στα αγγλικά). Journal of the American Chemical Society 124 (20): 5774–5781. doi:. ISSN 0002-7863. PMID 12010052. https://pubs.acs.org/doi/10.1021/ja025606x.
- ↑ Zhang, Qisheng; Curran, Dennis P. (2005-08-19). «Quasienantiomers and Quasiracemates: New Tools for Identification, Analysis, Separation, and Synthesis of Enantiomers» (στα αγγλικά). Chemistry - A European Journal 11 (17): 4866–4880. doi:. ISSN 0947-6539. PMID 15915521. https://onlinelibrary.wiley.com/doi/10.1002/chem.200500076.
- ↑ G.S. Coumbarides, M. Dingjan, J. Eames, A. Flinn, J. Northen and Y. Yohannes, Tetrahedron Lett. 46 (2005), p. 2897er
Εξωτερικοί σύνδεσμοι
[Επεξεργασία | επεξεργασία κώδικα] Πολυμέσα σχετικά με το θέμα Enantiomers στο Wikimedia Commons
Πολυμέσα σχετικά με το θέμα Enantiomers στο Wikimedia Commons- chemwiki:stereoisomerism Αρχειοθετήθηκε 2014-02-22 στο Wayback Machine.