Θεωρία της γήρανσης λόγω ελευθέρων ριζών
Η θεωρία της γήρανσης λόγω ελεύθερων ριζών (FRTA) δηλώνει ότι οι οργανισμοί γερνούν επειδή τα κύτταρα συσσωρεύουν βλάβη από ελεύθερες ρίζες με την πάροδο του χρόνου.[1] Ελεύθερη ρίζα είναι κάθε άτομο ή μόριο που έχει ένα μόνο ασύζευκτο ηλεκτρόνιο σε ένα εξωτερικό περίβλημα.[2] Ενώ μερικές ελεύθερες ρίζες όπως η μελανίνη δεν είναι χημικά αντιδραστικές, οι περισσότερες βιολογικά σχετικές ελεύθερες ρίζες είναι εξαιρετικά αντιδραστικές.[3] Για τις περισσότερες βιολογικές δομές, η βλάβη από τις ελεύθερες ρίζες συνδέεται στενά με την οξειδωτική βλάβη. Τα αντιοξειδωτικά είναι αναγωγικοί παράγοντες και περιορίζουν την οξειδωτική βλάβη στις βιολογικές δομές παθητικοποιώντας τις από τις ελεύθερες ρίζες.[4]
Αυστηρά μιλώντας, η θεωρία των ελεύθερων ριζών ασχολείται μόνο με τις ελεύθερες ρίζες όπως το υπεροξείδιο (O 2 - ), αλλά έκτοτε έχει επεκταθεί για να συμπεριλάβει την οξειδωτική βλάβη από άλλα αντιδραστικά είδη οξυγόνου (ROS) όπως το υπεροξείδιο του υδρογόνου (H 2 O 2 ), ή υπεροξυνιτρώδες (OONO −).[4]
Ο Denham Harman πρότεινε για πρώτη φορά τη θεωρία της γήρανσης λόγω ελεύθερων ριζών στη δεκαετία του 1950,[5] και στη δεκαετία του 1970 επέκτεινε την ιδέα για να ενοχοποιήσει τη μιτοχονδριακή παραγωγή ROS.[6]
Σε ορισμένους οργανισμούς-μοντέλα, όπως η ζύμη και η Drosophila, υπάρχουν στοιχεία ότι η μείωση της οξειδωτικής βλάβης μπορεί να παρατείνει τη διάρκεια ζωής.[7] Ωστόσο, στα ποντίκια, μόνο 1 από τις 18 γενετικές αλλοιώσεις (διαγραφή SOD-1) που μπλοκάρουν την αντιοξειδωτική άμυνα, μείωσαν τη διάρκεια ζωής.[8] Ομοίως, στους στρογγυλούς σκώληκες ( Caenorhabditis elegans ), η παρεμπόδιση της παραγωγής της φυσικής αντιοξειδωτικής υπεροξειδικής δισμουτάσης έχει αποδειχθεί πρόσφατα ότι αυξάνει τη διάρκεια ζωής.[9] Το εάν η μείωση της οξειδωτικής βλάβης κάτω από τα φυσιολογικά επίπεδα είναι επαρκής για την παράταση της διάρκειας ζωής παραμένει ένα ανοιχτό και αμφιλεγόμενο ερώτημα.
Ιστορικό
[Επεξεργασία | επεξεργασία κώδικα]Η θεωρία των ελεύθερων ριζών της γήρανσης επινοήθηκε από τον Denham Harman τη δεκαετία του 1950, όταν η επικρατούσα επιστημονική γνώμη υποστήριξε ότι οι ελεύθερες ρίζες ήταν πολύ ασταθείς για να υπάρχουν σε βιολογικά συστήματα.[10] Αυτό συνέβαινε επίσης πριν κάποιος επικαλεστεί τις ελεύθερες ρίζες ως αιτία εκφυλιστικών ασθενειών.[11] Δύο πηγές ενέπνευσαν τον Harman: 1) η θεωρία του ρυθμού ζωής, η οποία υποστηρίζει ότι η διάρκεια ζωής είναι μια αντίστροφη συνάρτηση του μεταβολικού ρυθμού που με τη σειρά του είναι ανάλογη με την κατανάλωση οξυγόνου και 2) η παρατήρηση της Rebbeca Gershman ότι η τοξικότητα του υπερβαρικού οξυγόνου και η τοξικότητα της ακτινοβολίας θα μπορούσαν να εξηγηθούν από το ίδιο υποκείμενο φαινόμενο: ελεύθερες ρίζες οξυγόνου.[10][12] Σημειώνοντας ότι η ακτινοβολία προκαλεί "μετάλλαξη, καρκίνο και γήρανση", ο Harman υποστήριξε ότι οι ελεύθερες ρίζες οξυγόνου που παράγονται κατά τη διάρκεια της κανονικής αναπνοής θα προκαλούσαν αθροιστική βλάβη που θα οδηγούσε τελικά σε απώλεια της λειτουργικότητας του οργανισμού και τελικά θάνατο.[10][12]
Στα μεταγενέστερα χρόνια, η θεωρία των ελεύθερων ριζών επεκτάθηκε για να συμπεριλάβει όχι μόνο τη γήρανση αυτή καθεαυτή, αλλά και ασθένειες που σχετίζονται με την ηλικία.[11] Η βλάβη των ελεύθερων ριζών εντός των κυττάρων έχει συνδεθεί με μια σειρά από διαταραχές όπως ο καρκίνος, η αρθρίτιδα, η αθηροσκλήρωση, η νόσος του Αλτσχάιμερ και ο διαβήτης .[13] Υπάρχουν κάποια στοιχεία που υποδηλώνουν ότι οι ελεύθερες ρίζες και ορισμένα αντιδραστικά είδη αζώτου πυροδοτούν και αυξάνουν μηχανισμούς κυτταρικού θανάτου εντός του σώματος, όπως η απόπτωση και σε ακραίες περιπτώσεις η νέκρωση .[14]
Το 1972, ο Harman τροποποίησε την αρχική του θεωρία.[11] Στην τρέχουσα μορφή της, αυτή η θεωρία προτείνει ότι τα αντιδραστικά είδη οξυγόνου (ROS) που παράγονται στα μιτοχόνδρια, προκαλούν βλάβη σε ορισμένα μακρομόρια, συμπεριλαμβανομένων των λιπιδίων, των πρωτεϊνών και κυρίως του μιτοχονδριακού DNA.[15] Αυτή η βλάβη προκαλεί στη συνέχεια μεταλλάξεις που οδηγούν σε αύξηση της παραγωγής ROS και ενισχύουν σημαντικά τη συσσώρευση ελεύθερων ριζών μέσα στα κύτταρα.[15] Αυτή η μιτοχονδριακή θεωρία έχει γίνει ευρύτερα αποδεκτή ότι θα μπορούσε να παίξει σημαντικό ρόλο στη συμβολή στη διαδικασία γήρανσης.[16]
Ο Denham Harman πρότεινε για πρώτη φορά τη θεωρία της γήρανσης λόγω ελεύθερων ριζών στη δεκαετία του 1950,[5] και στη δεκαετία του 1970 επέκτεινε την ιδέα για να ενοχοποιήσει τη μιτοχονδριακή παραγωγή ROS.[6]
Διαδικασίες
[Επεξεργασία | επεξεργασία κώδικα]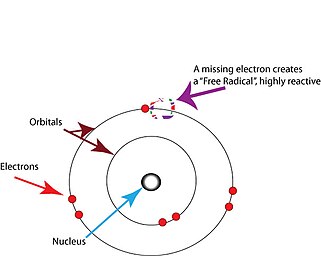
Οι ελεύθερες ρίζες είναι άτομα ή μόρια που περιέχουν ασύζευκτα ηλεκτρόνια.[2] Τα ηλεκτρόνια υπάρχουν συνήθως σε ζεύγη σε συγκεκριμένα τροχιακά σε άτομα ή μόρια.[17] Οι ελεύθερες ρίζες, που περιέχουν μόνο ένα ηλεκτρόνιο σε οποιοδήποτε τροχιακό, είναι συνήθως ασταθείς στο να χάσουν ή να πάρουν ένα επιπλέον ηλεκτρόνιο, έτσι ώστε όλα τα ηλεκτρόνια στο άτομο ή στο μόριο να ζευγαρωθούν.[17]
Το ασύζευκτο ηλεκτρόνιο δεν συνεπάγεται φορτίο. Οι ελεύθερες ρίζες μπορεί να είναι θετικά φορτισμένες, αρνητικά φορτισμένες ή ουδέτερες.
Η ζημιά συμβαίνει όταν η ελεύθερη ρίζα συναντά ένα άλλο μόριο και ψάχνει να βρει άλλο ηλεκτρόνιο για να ζευγαρώσει το ασύζευκτο ηλεκτρόνιό της. Η ελεύθερη ρίζα συχνά τραβά ένα ηλεκτρόνιο από ένα γειτονικό μόριο, με αποτέλεσμα το μόριο που επηρεάζεται να γίνει το ίδιο μια ελεύθερη ρίζα. Η νέα ελεύθερη ρίζα μπορεί στη συνέχεια να τραβήξει ένα ηλεκτρόνιο από το επόμενο μόριο και εμφανίζεται μια χημική αλυσιδωτή αντίδραση παραγωγής ριζών.[18] Οι ελεύθερες ρίζες που παράγονται σε τέτοιες αντιδράσεις συχνά τερματίζονται αφαιρώντας ένα ηλεκτρόνιο από ένα μόριο που μεταβάλλεται ή δεν μπορεί να λειτουργήσει χωρίς αυτό, ειδικά στη βιολογία. Ένα τέτοιο γεγονός προκαλεί βλάβη στο μόριο, και άρα στο κύτταρο που το περιέχει (καθώς το μόριο συχνά γίνεται δυσλειτουργικό).
Η αλυσιδωτή αντίδραση που προκαλείται από τις ελεύθερες ρίζες μπορεί να οδηγήσει σε διασταυρούμενη σύνδεση των ατομικών δομών. Σε περιπτώσεις όπου η αλυσιδωτή αντίδραση που προκαλείται από ελεύθερες ρίζες περιλαμβάνει μόρια ζευγών βάσεων σε μια αλυσίδα DNA, το DNA μπορεί να διασταυρωθεί.[19]
Η διασύνδεση του DNA μπορεί με τη σειρά της να οδηγήσει σε διάφορες επιπτώσεις της γήρανσης, ιδιαίτερα στον καρκίνο .[20] Άλλες διασταυρώσεις μπορεί να προκύψουν μεταξύ μορίων λίπους και πρωτεΐνης, γεγονός που οδηγεί σε ρυτίδες.[21] Οι ελεύθερες ρίζες μπορούν να οξειδώσουν την LDL, και αυτό είναι ένα σημαντικό γεγονός στον σχηματισμό πλάκας στις αρτηρίες, που οδηγεί σε καρδιακές παθήσεις και εγκεφαλικό .[22] Αυτά είναι παραδείγματα του πώς η θεωρία της γήρανσης λόγω των ελεύθερων ριζών έχει χρησιμοποιηθεί για να «εξηγήσει» με ακρίβεια την προέλευση πολλών χρόνιων ασθενειών .[23]
Οι ελεύθερες ρίζες που πιστεύεται ότι εμπλέκονται στη διαδικασία της γήρανσης περιλαμβάνουν το υπεροξείδιο και το μονοξείδιο του αζώτου .[24] Συγκεκριμένα, η αύξηση του υπεροξειδίου επηρεάζει τη γήρανση, ενώ η μείωση του σχηματισμού μονοξειδίου του αζώτου ή της βιοδιαθεσιμότητας του, το ίδιο.[24]
Τα αντιοξειδωτικά είναι χρήσιμα στη μείωση και την πρόληψη της βλάβης από τις αντιδράσεις των ελεύθερων ριζών λόγω της ικανότητάς τους να δωρίζουν ηλεκτρόνια που εξουδετερώνουν τη ρίζα χωρίς να σχηματίζουν άλλη. Το ασκορβικό οξύ, για παράδειγμα, μπορεί να χάσει ένα ηλεκτρόνιο σε μια ελεύθερη ρίζα και να παραμείνει σταθερό το ίδιο περνώντας το ασταθές ηλεκτρόνιό του γύρω από το αντιοξειδωτικό μόριο.[25]
Αυτό οδήγησε στην υπόθεση ότι μεγάλες ποσότητες αντιοξειδωτικών,[26] με την ικανότητά τους να μειώνουν τον αριθμό των ελεύθερων ριζών, μπορεί να μειώσουν τη ριζική βλάβη που προκαλεί χρόνιες ασθένειες, ακόμη και ριζικές βλάβες που ευθύνονται για τη γήρανση.
Απόδειξη
[Επεξεργασία | επεξεργασία κώδικα]Πολυάριθμες μελέτες έχουν αποδείξει το ρόλο των ελεύθερων ριζών στη διαδικασία της γήρανσης και έτσι υποστηρίζουν δοκιμαστικά τη θεωρία της γήρανσης λόγω των ελεύθερων ριζών. Μελέτες έχουν δείξει σημαντική αύξηση του σχηματισμού ριζών υπεροξειδίου (SOR) και της υπεροξείδωσης των λιπιδίων σε ηλικιωμένους αρουραίους.[27] Οι Chung et al. προτείνουν ότι η παραγωγή ROS αυξάνεται με την ηλικία και υποδεικνύεται ότι η μετατροπή της XDH σε XOD μπορεί να είναι ένας σημαντικός παράγοντας που συμβάλλει.[28] Αυτό υποστηρίχθηκε από μια μελέτη που έδειξε ότι η παραγωγή υπεροξειδίου από την οξειδάση της ξανθίνης και τη συνθάση του ΝΟ στις μεσεντέριες αρτηρίες ήταν υψηλότερη στους ηλικιωμένους επίμυες από τους νεαρούς.[29]
Οι Hamilton et al. εξέτασε τις ομοιότητες στην εξασθενημένη ενδοθηλιακή λειτουργία στην υπέρταση και τη γήρανση στους ανθρώπους και βρήκε σημαντική υπερπαραγωγή υπεροξειδίου και στα δύο.[30] Αυτό το εύρημα υποστηρίζεται από μια μελέτη του 2007 που διαπίστωσε ότι το ενδοθηλιακό οξειδωτικό στρες αναπτύσσεται με τη γήρανση σε υγιείς άνδρες και σχετίζεται με μειώσεις της εξαρτώμενης από το ενδοθήλιο διαστολής.[31] Επιπλέον, μια μελέτη που χρησιμοποιούσε καλλιεργημένα λεία μυϊκά κύτταρα εμφάνισε αυξημένο ROS σε κύτταρα που προέρχονται από ηλικιωμένα ποντίκια.[32] Αυτά τα ευρήματα υποστηρίχθηκαν από μια δεύτερη μελέτη που χρησιμοποιεί κύτταρα Leydig που απομονώθηκαν από όρχεις νεαρών και ηλικιωμένων αρουραίων.[33]
Οι Choksi et al. Το πείραμα με ποντίκια νάνου Ames (DW) υποδηλώνει ότι τα χαμηλότερα επίπεδα παραγωγής ενδογενούς ROS σε ποντίκια DW μπορεί να είναι ένας παράγοντας για την αντοχή τους στο οξειδωτικό στρες και τη μεγάλη διάρκεια ζωής.[34] Οι Lener et al. προτείνουν ότι η δραστηριότητα Nox4 αυξάνει την οξειδωτική βλάβη στα ενδοθηλιακά κύτταρα της ανθρώπινης ομφαλικής φλέβας μέσω υπερπαραγωγής υπεροξειδίου.[35] Επιπλέον, οι Rodriguez-Manas et al. διαπιστώθηκε ότι η ενδοθηλιακή δυσλειτουργία στα ανθρώπινα αγγεία οφείλεται στη συλλογική επίδραση της αγγειακής φλεγμονής και του οξειδωτικού στρες.[36]
Οι Sasaki et al. αναφέρθηκε ότι η εξαρτώμενη από το υπεροξείδιο χημειοφωταύγεια ήταν αντιστρόφως ανάλογη με τη μέγιστη διάρκεια ζωής σε ποντίκια, αρουραίους Wistar και περιστέρια.[37] Προτείνουν ότι η σηματοδότηση ROS μπορεί να είναι καθοριστικός παράγοντας στη διαδικασία γήρανσης.[37] Στους ανθρώπους, οι Mendoza-Nunez et al. προτείνουν ηλικία 60 ετών και άνω μπορεί να συνδέεται με αυξημένο οξειδωτικό στρες.[38] Ο Miyazawa διαπίστωσε ότι η παραγωγή ανιόντων μιτοχονδριακού υπεροξειδίου μπορεί να οδηγήσει σε ατροφία οργάνων και δυσλειτουργία μέσω της απόπτωσης που προκαλείται από μιτοχόνδρια.[39] Επιπλέον, προτείνουν ότι το μιτοχονδριακό ανιόν υπεροξειδίου παίζει ουσιαστικό ρόλο στη γήρανση.[40] Οι Lund et al. κατέδειξε τον ρόλο της ενδογενούς εξωκυτταρικής υπεροξειδικής δισμουτάσης στην προστασία έναντι της ενδοθηλιακής δυσλειτουργίας κατά τη διάρκεια της διαδικασίας γήρανσης χρησιμοποιώντας ποντίκια.[41]
Τροποποιήσεις της θεωρίας
[Επεξεργασία | επεξεργασία κώδικα]Μία από τις κύριες επικρίσεις της θεωρίας της γήρανσης λόγω των ελεύθερων ριζών στρέφεται στην πρόταση ότι οι ελεύθερες ρίζες είναι υπεύθυνες για τη βλάβη των βιομορίων, αποτελώντας έτσι έναν κύριο λόγο για τη γήρανση των κυττάρων και τη γήρανση του οργανισμού.[42] :81Έχουν προταθεί αρκετές τροποποιήσεις για την ενσωμάτωση της τρέχουσας έρευνας στη συνολική θεωρία.
Μιτοχονδριακή θεωρία γήρανσης
[Επεξεργασία | επεξεργασία κώδικα]
Η μιτοχονδριακή θεωρία της γήρανσης προτάθηκε για πρώτη φορά το 1978,[43][44] και δύο χρόνια αργότερα, εισήχθη η θεωρία της γήρανσης λόγω των μιτοχονδριακών ελεύθερων ριζών.[45] Η θεωρία εμπλέκει τα μιτοχόνδρια ως τον κύριο στόχο ριζικής βλάβης, καθώς υπάρχει ένας γνωστός χημικός μηχανισμός με τον οποίο τα μιτοχόνδρια μπορούν να παράγουν ROS, τα μιτοχονδριακά συστατικά όπως το mtDNA δεν προστατεύονται τόσο καλά όσο το πυρηνικό DNA και από μελέτες που συγκρίνουν τη βλάβη στο πυρηνικό και το mtDNA που δείχνουν υψηλότερα επίπεδα ριζικής βλάβης στα μιτοχονδριακά μόρια.[46] Τα ηλεκτρόνια μπορεί να διαφύγουν από μεταβολικές διεργασίες στα μιτοχόνδρια όπως η αλυσίδα μεταφοράς ηλεκτρονίων, και αυτά τα ηλεκτρόνια μπορεί με τη σειρά τους να αντιδράσουν με το νερό για να σχηματίσουν ROS όπως η ρίζα υπεροξειδίου ή μέσω μιας έμμεσης οδού τη ρίζα υδροξυλίου . Αυτές οι ρίζες καταστρέφουν στη συνέχεια το DNA και τις πρωτεΐνες των μιτοχονδρίων, και αυτά τα συστατικά της βλάβης με τη σειρά τους είναι πιο πιθανό να παράγουν υποπροϊόντα ROS. Έτσι δημιουργείται ένας βρόχος θετικής ανάδρασης του οξειδωτικού στρες που, με την πάροδο του χρόνου, μπορεί να οδηγήσει σε φθορά των κυττάρων και αργότερα των οργάνων και ολόκληρου του σώματος.[42]
Αυτή η θεωρία έχει συζητηθεί ευρέως [47] και δεν είναι ακόμη σαφές πώς αναπτύσσονται οι μεταλλάξεις του mtDNA που προκαλούνται από ROS.[42] Conte et al. προτείνουν ότι τα δάχτυλα ψευδάργυρου με υποκατάσταση σιδήρου μπορεί να δημιουργήσουν ελεύθερες ρίζες λόγω της εγγύτητας του δακτύλου ψευδαργύρου στο DNA και έτσι να οδηγήσουν σε βλάβη του DNA.[48]
Ο Afanas'ev προτείνει ότι η δραστηριότητα δυσμετάλλαξης υπεροξειδίου του CuZnSOD καταδεικνύει μια σημαντική σχέση μεταξύ της διάρκειας ζωής και των ελεύθερων ριζών.[49] Η σχέση μεταξύ CuZnSOD και διάρκειας ζωής καταδείχθηκε από τους Perez et al. ο οποίος έδειξε ότι η διάρκεια ζωής των ποντικών επηρεάστηκε από τη διαγραφή του γονιδίου Sod1 που κωδικοποιεί το CuZnSOD.[50]
Σε αντίθεση με τη συνήθως παρατηρούμενη συσχέτιση μεταξύ των μιτοχονδριακών ROS (mtROS) και της μείωσης της μακροζωίας, οι Yee et al. πρόσφατα παρατηρήθηκε αυξημένη μακροζωία που προκαλείται από τη σηματοδότηση mtROS σε μια οδό απόπτωσης. Αυτό χρησιμεύει για να υποστηρίξει την πιθανότητα ότι οι παρατηρούμενες συσχετίσεις μεταξύ της βλάβης των ROS και της γήρανσης δεν είναι απαραίτητα ενδεικτικές της αιτιώδους εμπλοκής των ROS στη διαδικασία γήρανσης, αλλά είναι πιο πιθανό να οφείλονται στις τροποποιητικές οδούς μεταγωγής σήματος που αποτελούν μέρος των κυτταρικών αποκρίσεων στη διαδικασία γήρανσης.[51]
Επιγενετική οξειδωτική οξειδοαναγωγική μετατόπιση (EORS) θεωρία γήρανσης
[Επεξεργασία | επεξεργασία κώδικα]Ο Brewer πρότεινε μια θεωρία που ενσωματώνει τη θεωρία των ελεύθερων ριζών της γήρανσης με τα αποτελέσματα σηματοδότησης της ινσουλίνης στη γήρανση.[52] Η θεωρία του Brewer προτείνει ότι «η καθιστική συμπεριφορά που σχετίζεται με την ηλικία πυροδοτεί μια οξειδωμένη οξειδοαναγωγική μετατόπιση και εξασθενημένη μιτοχονδριακή λειτουργία».[52] Αυτή η μιτοχονδριακή βλάβη οδηγεί σε πιο καθιστική συμπεριφορά και επιτάχυνση της γήρανσης.[52]
Θεωρία μεταβολικής σταθερότητας της γήρανσης
[Επεξεργασία | επεξεργασία κώδικα]Η θεωρία της μεταβολικής σταθερότητας της γήρανσης υποδηλώνει ότι είναι η ικανότητα των κυττάρων να διατηρούν σταθερή συγκέντρωση ROS που είναι ο κύριος καθοριστικός παράγοντας της διάρκειας ζωής.[53] Αυτή η θεωρία επικρίνει τη θεωρία των ελεύθερων ριζών επειδή αγνοεί ότι τα ROS είναι συγκεκριμένα μόρια σηματοδότησης που είναι απαραίτητα για τη διατήρηση των φυσιολογικών λειτουργιών των κυττάρων.[53]
Mitohormesis
[Επεξεργασία | επεξεργασία κώδικα]Το οξειδωτικό στρες μπορεί να προάγει το προσδόκιμο ζωής του Caenorhabditis elegans προκαλώντας μια δευτερεύουσα απόκριση σε αρχικά αυξημένα επίπεδα ROS.[54] Στα θηλαστικά, το ζήτημα της καθαρής επίδρασης των ενεργών ειδών οξυγόνου στη γήρανση είναι ακόμη λιγότερο σαφές.[55][56][57] Πρόσφατα επιδημιολογικά ευρήματα υποστηρίζουν τη διαδικασία της μιτοχόρμησης στον άνθρωπο και μάλιστα υποδηλώνουν ότι η πρόσληψη εξωγενών αντιοξειδωτικών μπορεί να αυξήσει τον επιπολασμό της νόσου στον άνθρωπο (σύμφωνα με τη θεωρία, επειδή εμποδίζουν τη διέγερση της φυσικής απόκρισης του οργανισμού στις οξειδωτικές ενώσεις που όχι μόνο εξουδετερώνουν αλλά παρέχει και άλλα οφέλη).
Επιπτώσεις του περιορισμού των θερμίδων
[Επεξεργασία | επεξεργασία κώδικα]Μελέτες έχουν δείξει ότι ο περιορισμός των θερμίδων εμφανίζει θετικά αποτελέσματα στη διάρκεια ζωής των οργανισμών, παρόλο που συνοδεύεται από αύξηση του οξειδωτικού στρες.[49] Πολλές μελέτες προτείνουν ότι αυτό μπορεί να οφείλεται σε αντιοξειδωτική δράση,[49] καταστολή οξειδωτικού στρες,[58] ή αντίσταση στο οξειδωτικό στρες [59] που εμφανίζεται στον περιορισμό των θερμίδων. Fontana et al. υποδηλώνουν ότι ο περιορισμός των θερμίδων επηρέασε πολυάριθμες οδούς σήματος μέσω της μείωσης του αυξητικού παράγοντα Ι που μοιάζει με ινσουλίνη (IGF-1).[60] Επιπλέον, προτείνουν ότι το αντιοξειδωτικό SOD και η καταλάση εμπλέκονται στην αναστολή αυτής της οδού σηματοδότησης θρεπτικών συστατικών.[60]
Η αύξηση του προσδόκιμου ζωής που παρατηρείται κατά τη διάρκεια ορισμένων μελετών περιορισμού των θερμίδων που μπορεί να συμβεί με έλλειψη μειώσεων ή ακόμη και αυξήσεων στην κατανάλωση O 2 συχνά συμπεραίνεται ως αντίθετη με τη θεωρία της γήρανσης λόγω των μιτοχονδριακών ελεύθερων ριζών.[49][61] Σύμφωνα με μια μελέτη του G. Barja, σημαντικές μειώσεις στην παραγωγή μιτοχονδριακών ριζών οξυγόνου (ανά μονάδα O 2 που καταναλώνεται) συμβαίνουν κατά τη διάρκεια διατροφικού περιορισμού, αερόβιας άσκησης, χρόνιας άσκησης και υπερθυρεοειδισμού .[61] Επιπλέον, η παραγωγή μιτοχονδριακών ριζών οξυγόνου είναι χαμηλότερη σε μακρόβια πτηνά από ό,τι σε βραχύβια θηλαστικά με συγκρίσιμο μέγεθος σώματος και μεταβολικό ρυθμό . Έτσι, η παραγωγή μιτοχονδριακών ROS πρέπει να ρυθμίζεται ανεξάρτητα από την κατανάλωση O 2 σε διάφορα είδη, ιστούς και φυσιολογικές καταστάσεις.[61]
Προκλήσεις στη θεωρία
[Επεξεργασία | επεξεργασία κώδικα]Γυμνός τυφλοπόντικας-αρουραίος
[Επεξεργασία | επεξεργασία κώδικα]Ο γυμνός τυφλοπόντικας είναι ένα μακρόβιο τρωκτικό (32 ετών). Όπως αναθεωρήθηκε από τους Lewis et al.,[62] (2013), τα επίπεδα παραγωγής ROS στον γυμνό μωρό αρουραίο είναι παρόμοια με αυτά ενός άλλου τρωκτικού, του σχετικά βραχύβιου ποντικού (4 χρόνια). Κατέληξαν στο συμπέρασμα ότι δεν είναι το οξειδωτικό στρες που ρυθμίζει την υγεία και τη μακροζωία σε αυτά τα τρωκτικά, αλλά άλλοι κυτταροπροστατευτικοί μηχανισμοί που επιτρέπουν στα ζώα να αντιμετωπίσουν υψηλά επίπεδα οξειδωτικής βλάβης και στρες.[62] Στον γυμνό μόλο-αρουραίο, ένας πιθανός σημαντικός κυτταροπροστατευτικός μηχανισμός που θα μπορούσε να παρέχει διασφάλιση μακροζωίας είναι η αυξημένη έκφραση των γονιδίων επιδιόρθωσης του DNA που εμπλέκονται σε πολλά βασικά μονοπάτια επιδιόρθωσης του DNA.[63] (Βλέπε θεωρία βλάβης του DNA της γήρανσης . ) Σε σύγκριση με το ποντίκι, ο γυμνός μόλος αρουραίος είχε σημαντικά υψηλότερα επίπεδα έκφρασης γονιδίων που είναι απαραίτητα για τις οδούς επιδιόρθωσης DNA της επιδιόρθωσης ασυμφωνίας DNA, της μη ομόλογης σύνδεσης άκρου και της επιδιόρθωσης εκτομής βάσης .[63]
Πουλιά
[Επεξεργασία | επεξεργασία κώδικα]Μεταξύ των πτηνών, οι παπαγάλοι ζουν περίπου πέντε φορές περισσότερο από τα ορτύκια . Η παραγωγή ROS στην καρδιά, τους σκελετικούς μύες, το ήπαρ και τα άθικτα ερυθροκύτταρα βρέθηκε να είναι παρόμοια στους παπαγάλους και τα ορτύκια και δεν έδειξε αντιστοιχία με τη διαφορά μακροζωίας.[64] Αυτά τα ευρήματα κατέληξαν στο συμπέρασμα ότι θέτουν αμφιβολίες σχετικά με την ευρωστία της θεωρίας του οξειδωτικού στρες της γήρανσης.[64]
Δείτε επίσης
[Επεξεργασία | επεξεργασία κώδικα]- Αμερικανική Ένωση Γήρανσης
- Παράταση ζωής
- Λίστα θεμάτων που σχετίζονται με την παράταση ζωής
- Γηρασμός
- Περιορισμός θερμίδων
- Ντένχαμ Χάρμαν
- Μιτοχονδριακή θεωρία γήρανσης
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Hekimi S, Lapointe J, Wen Y. Taking a "good" look at free radicals in the aging process. Trends In Cell Biology. 2011;21(10) 569-76.
- ↑ 2,0 2,1 Erbas M, Sekerci H. "Importance of Free Radicals and Occurring During Food Processing". Serbest Radïkallerïn Onemï Ve Gida Ïsleme Sirasinda Olusumu. 2011: 36(6) 349–56.
- ↑ «The role of melanin as protector against free radicals in skin and its role as free radical indicator in hair». Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy 69 (5): 1429–35. 2008. doi:. PMID 17988942. Bibcode: 2008AcSpA..69.1429H.
- ↑ 4,0 4,1 Halliwell B (2012). «Free radicals and antioxidants: updating a personal view». Nutrition Reviews 70 (5): 257–65. doi:. PMID 22537212. https://archive.org/details/sim_nutrition-reviews_2012-05_70_5/page/257.
- ↑ 5,0 5,1 Harman, D (1956). «Aging: a theory based on free radical and radiation chemistry». Journal of Gerontology 11 (3): 298–300. doi:. PMID 13332224. https://archive.org/details/sim_journal-of-gerontology_1956-07_11_3/page/298.
- ↑ 6,0 6,1 Harman, D (1972). «A biologic clock: the mitochondria?». Journal of the American Geriatrics Society 20 (4): 145–147. doi:. PMID 5016631.
- ↑ Fontana, Luigi; Partridge, Linda; Longo, Valter D. (16 April 2010). «Extending Healthy Life Span—From Yeast to Humans». Science 328 (5976): 321–326. doi:. PMID 20395504. PMC 3607354. Bibcode: 2010Sci...328..321F. https://archive.org/details/sim_science_2010-04-16_328_5976/page/321.
- ↑ «Is the oxidative stress theory of aging dead?». Biochimica et Biophysica Acta (BBA) - General Subjects 1790 (10): 1005–14. 2009. doi:. PMID 19524016.
- ↑ Van Rammsdonk, Jeremy M.; Hekimi, Siegfried (2009). «Deletion of the Mitochondrial Superoxide Dismutase sod-2 Extends Lifespan in Caenorhabditis elegans». PLOS Genetics 5 (2): e1000361. doi:. PMID 19197346.
- ↑ 10,0 10,1 10,2 Harman D (Jul 1956). «Aging: a theory based on free radical and radiation chemistry». J Gerontol 11 (3): 298–300. doi:. PMID 13332224. https://archive.org/details/sim_journal-of-gerontology_1956-07_11_3/page/298.
- ↑ 11,0 11,1 11,2 Harman D (2009). «Origin and evolution of the free radical theory of aging: a brief personal history, 1954–2009». Biogerontology 10 (6): 773–81. doi:. PMID 19466577.
- ↑ 12,0 12,1 «The free-radical damage theory: Accumulating evidence against a simple link of oxidative stress to ageing and lifespan». BioEssays 33 (4): 255–9. 2011. doi:. PMID 21290398.
- ↑ Clancy D, Birdsall J. Flies, worms and the Free Radical Theory of ageing. Ageing Research Reviews. (0).
- ↑ «Oxidative stress induces protein and DNA radical formation in follicular dendritic cells of the germinal center and modulates its cell death patterns in late sepsis». Free Radical Biology and Medicine 50 (8): 988–99. 2011. doi:. PMID 21215311.
- ↑ 15,0 15,1 «The mitochondrial theory of aging: Insight from transgenic and knockout mouse models». Experimental Gerontology 44 (4): 256–60. 2009. doi:. PMID 19171187.
- ↑ «The mitochondrial free radical theory of ageing--where do we stand?». Frontiers in Bioscience 13 (13): 6554–79. 2008. doi:. PMID 18508680.
- ↑ 17,0 17,1 Orchin M, Macomber RS, Pinhas A, Wilson RM, editors. The Vocabulary and Concepts of Organic Chemistry. 2 ed: John Wiley & Sons; 2005.
- ↑ Cui Hang; Kong Yahui; Zhang Hong (2011). «Oxidative Stress, Mitochondrial Dysfunction, and Aging». Journal of Signal Transduction 2012: 646354. doi:. PMID 21977319.
- ↑ «Intrastrand G-U cross-links generated by the oxidation of guanine in 5′-d(GCU) and 5′-r(GCU)». Free Radical Biology and Medicine 45 (8): 1125–34. 2008. doi:. PMID 18692567.
- ↑ Dizdaroglu M, Jaruga P. Mechanisms of free radical-induced damage to DNA. Free Radical Research. [Article]. 2012;46(4) 382-419.
- ↑ Pageon H, Asselineau D. An in Vitro Approach to the Chronological Aging of Skin by Glycation of the Collagen: The Biological Effect of Glycation on the Reconstructed Skin Model" Annals of the New York Academy of Sciences 2005;1043(1) 529-32.
- ↑ Bamm VV, Tsemakhovich VA, Shaklai N. Oxidation of low-density lipoprotein by hemoglobin–hemichrome. The International Journal of Biochemistry & Cell Biology. 2003;35(3) 349-58.
- ↑ C. Richter, JW Park, BN Ames "Normal oxidative damage to mitochondrial and nuclear DNA is extensive" "PNAS", 1988.
- ↑ 24,0 24,1 Afanas'ev IB (2005). «Free radical mechanisms of aging processes under physiological conditions». Biogerontology 6 (4): 283–90. doi:. PMID 16333762.
- ↑ Bagchi D. et al "Oxygen free radical scavenging abilities of vitamins C and E, and a grape seed proanthocyanidin extract in vitro" "Research Communications in Molecular Pathology and Pharmacology" 1997.
- ↑ Biesalski H. Free radical theory of aging. Current Opinion in Clinical Nutrition and Metabolic Care. 2002 January 2002;5(1) 5 -10.
- ↑ «Changes in superoxide radical and lipid peroxide formation in the brain, heart and liver during the lifetime of the rat». Mechanisms of Ageing and Development 41 (1–2): 125–37. 1987. doi:. PMID 2828774.
- ↑ «Modulation of renal xanthine oxidoreductase in aging: gene expression and reactive oxygen species generation». The Journal of Nutrition, Health & Aging 3 (1): 19–23. 1999. PMID 10888479.
- ↑ «Aging enhances pressure-induced arterial superoxide formation». American Journal of Physiology. Heart and Circulatory Physiology 293 (3): H1344–H50. 2007. doi:. PMID 17557915.
- ↑ «Superoxide excess in hypertension and aging: a common cause of endothelial dysfunction». Hypertension 37 (2 Pt 2): 529–34. 2001. doi:. PMID 11230330.
- ↑ «Direct evidence of endothelial oxidative stress with aging in humans: relation to impaired endothelium-dependent dilation and upregulation of nuclear factor-kappaB». Circulation Research 100 (11): 1659–66. 2007. doi:. PMID 17478731.
- ↑ «Aging, oxidative responses, and proliferative capacity in cultured mouse aortic smooth muscle cells». American Journal of Physiology. Heart and Circulatory Physiology 280 (6): H779–H88. 2001. doi:. PMID 11356636.
- ↑ «Age-related increase in mitochondrial superoxide generation in the testosterone-producing cells of Brown Norway rat testes: relationship to reduced steroidogenic function?». Experimental Gerontology 36 (8): 1361–73. 2001. doi:. PMID 11602210. https://archive.org/details/sim_experimental-gerontology_2001-08_36_8/page/1361.
- ↑ «Lower levels of F2-isoprostanes in serum and livers of long-lived Ames dwarf mice». Biochemical and Biophysical Research Communications 364 (4): 761–4. 2007. doi:. PMID 17964285.
- ↑ «The NADPH oxidase Nox4 restricts the replicative lifespan of human endothelial cells». The Biochemical Journal 423 (3): 363–74. 2009. doi:. PMID 19681754.
- ↑ «Endothelial dysfunction in aged humans is related with oxidative stress and vascular inflammation». Aging Cell 8 (3): 226–38. 2009. doi:. PMID 19245678.
- ↑ 37,0 37,1 «Age-related increase of superoxide generation in the brains of mammals and birds». Aging Cell 7 (4): 459–69. 2008. doi:. PMID 18419797.
- ↑ Mendoza-Núñez VM, Ruiz-Ramos M, Sánchez-Rodríguez MA, Retana-Ugalde R, Muñoz-Sánchez JL. Aging-related oxidative stress in healthy humans. The Tohoku Journal of Experimental Medicine. 2007;213(3) 261-8.
- ↑ «The role of mitochondrial superoxide anion (O2(-)) on physiological aging in C57BL/6J mice». Journal of Radiation Research 50 (1): 73–83. 2009. doi:. PMID 19218782. Bibcode: 2009JRadR..50...73M.
- ↑ Miyazawa M, Ishii T, Yasuda K, Noda S, Onouchi H, Hartman PS, et al.
- ↑ «Protective effect of extracellular superoxide dismutase on endothelial function during aging». American Journal of Physiology. Heart and Circulatory Physiology 296 (6): H1920–H5. 2009. doi:. PMID 19376805.
- ↑ 42,0 42,1 42,2 Afanas'ev I (2010). «Signaling and Damaging Functions of Free Radicals in Aging-Free Radical Theory, Hormesis, and TOR». Aging and Disease 1 (2): 75–88. PMID 22396858.
- ↑ Lobachev A.N. Role of mitochondrial processes in the development and aging of organism. Aging and cancer, Chemical abstracts. 1979 v. 91 N 25 91:208561v.Deposited Doc., VINITI 2172-78, 1978, σελ. 48, http://aiexandr2010.narod.ru/rol.pdf
- ↑ Lobachev A.N. Biogenesis of mitochondria during cell differentiation and aging, Deposited Doc. VINITI 19.09.85, №6756-В85, 1985, σελ. 28, http://aiexandr2010.narod.ru/Biogenesis.pdf
- ↑ Miquel J, Economos AC, Fleming J, et al. Mitochondrial role in cell aging, Exp Gerontol, 15, 1980, σελ. 575–591
- ↑ Weindruch, Richard (January 1996). «Calorie Restriction and Aging». Scientific American: 49–52.
- ↑ «Stochastic drift in mitochondrial DNA point mutations: a novel perspective ex silico». PLOS Computational Biology 5 (11): e1000572. 2009. doi:. PMID 19936024. Bibcode: 2009PLSCB...5E0572P.
- ↑ «In vivo and in vitro iron-replaced zinc finger generates free radicals and causes DNA damage». The Journal of Biological Chemistry 271 (9): 5125–30. 1996. doi:. PMID 8617792.
- ↑ 49,0 49,1 49,2 49,3 Afanas'ev I. Signaling and Damaging Functions of Free Radicals in Aging-Free Radical Theory, Hormesis, and TOR. Aging And Disease. 2010;1(2) 75-88.
- ↑ «Is the oxidative stress theory of aging dead?». Biochimica et Biophysica Acta (BBA) - General Subjects 1790 (10): 1005–14. 2009. doi:. PMID 19524016.
- ↑ «The Intrinsic Apoptosis Pathway Mediates the Pro-Longevity Response to Mitochondrial ROS in C. elegans». Cell 157 (4): 897–909. 2014. doi:. PMID 24813612.
- ↑ 52,0 52,1 52,2 Brewer GJ (2010). «Epigenetic oxidative redox shift (EORS) theory of aging unifies the free radical and insulin signaling theories». Experimental Gerontology 45 (3): 173–9. doi:. PMID 19945522.
- ↑ 53,0 53,1 «Age-related transcriptional changes in gene expression in different organs of mice support the metabolic stability theory of aging». Biogerontology 10 (5): 549–64. 2009. doi:. PMID 19031007.
- ↑ «Glucose restriction extends Caenorhabditis elegans life span by inducing mitochondrial respiration and increasing oxidative stress». Cell Metabolism 6 (4): 280–93. 2007. doi:. PMID 17908557.
- ↑ «Mechanisms of aging: an appraisal of the oxidative stress hypothesis». Free Radic Biol Med 33 (5): 575–86. 2002. doi:. PMID 12208343.
- ↑ Sohal R (2002). «Role of oxidative stress and protein oxidation in the aging process». Free Radic Biol Med 33 (1): 37–44. doi:. PMID 12086680.
- ↑ Rattan S (2006). «Theories of biological aging: genes, proteins, and free radicals». Free Radic Res 40 (12): 1230–8. doi:. PMID 17090411.
- ↑ Castello LΣφάλμα έκφρασης: Μη αναγνωρισμένη λέξη "etal" (2005). «Calorie restriction protects against age-related rat aorta sclerosis». FASEB Journal 19 (13): 1863–5. doi:. PMID 16150801. https://archive.org/details/sim_faseb-journal_2005-11_19_13/page/1863.
- ↑ Ungvari Z, Parrado-Fernandez C, Csiszar A, de Cabo R. Mechanisms underlying caloric restriction and lifespan regulation: implications for vascular aging" Circulation Research 2008;102(5) 519-28.
- ↑ 60,0 60,1 Fontana L, Partridge L, Longo VD. Extending healthy life span--from yeast to humans. Science (New York, NY). 2010;328(5976) 321-6.
- ↑ 61,0 61,1 61,2 Barja G. Mitochondrial oxygen consumption and reactive oxygen species production are independently modulated: implications for aging studies. Rejuvenation Research. 2007;10(2) 215-24.
- ↑ 62,0 62,1 «The naked mole-rat response to oxidative stress: just deal with it». Antioxid. Redox Signal. 19 (12): 1388–99. 2013. doi:. PMID 23025341.
- ↑ 63,0 63,1 «DNA repair in species with extreme lifespan differences». Aging 7 (12): 1171–84. 2015. doi:. PMID 26729707.
- ↑ 64,0 64,1 «Does the oxidative stress theory of aging explain longevity differences in birds? I. Mitochondrial ROS production». Exp. Gerontol. 47 (3): 203–10. 2012. doi:. PMID 22123429.