Καρβένια


Τα καρβένια είναι οργανικές χημικές ενώσεις που τα μόριά τους περιέχουν άτομα άνθρακα με σθένος δύο (2) και δύο (2) μη δεσμικά ηλεκτρόνια σθένους. Δύο (2) γενικοί τύποι αντιστοιχούν σε καρβένια: R-(C:)-R΄ και R=C:, όπου R και R΄, άτομα υδρογόνου, αλογόνου, χαλκογόνου, υδροκαρβύλια ή υδροκαρβιλυδένια, με ή χωρίς ετεροάτομα.
Ο όρος «καρβένιο» μπορεί επίσης να αναφέρεται στο ειδικά μεθυλένιο (:CH2), που είναι το «μητρικό» υδρίδιο του δισθενούς άνθρακα, από τα οποία τα άλλα καρβένια (τυπικά) μπορεί να προκύψουν.[1][2] Τα καρβένια κατατάσσονται ως απλέτες ή τριπλέτες, ανάλογα με την ηλεκτρονική τους δομή. Τα περισσότερα καρβένια είναι πολύ βραχύβια, παρ' όλο που είναι γνωστά και κάποια επίμονα (λιγότερο βραχύβια) καρβένια. Ένα καλά μελετημένο καρβένιο είναι το διχλωροκαρβένιο (Cl2C:), το οποίο μπορεί να παραχθεί in situ από το χλωροφόρμιο (CHCl3) και μια ισχυρή βάση, συνήθως υδροξείδιο του καλίου (KOH).
Ιστορία
[Επεξεργασία | επεξεργασία κώδικα]Η ύπαρξη των καρβενίων υποτέθηκε για πρώτη φορά από τον Έντουαρτ Μπούχνερ (Eduard Buchner) το 1903, κατά τις μελέτες κυκλοπροπανίωσης αιθυλοδιαζωαιθανικού οξέος με τολουόλιο.[3] Το 1912 ο Χέρμαν Στάουντιγκερ (Hermann Staudinger) μετέτρεψε αλκένια σε κυκλοπροπάνια με διαζωμεθάνιο,[4] δηλαδή χρησιμοποιώντας μεθυλένιο ως ενδιάμεσο. Ο Γουΐλλιαμ φον Έγκερς Ντέριγνκ (William von Eggers Doering) το 1954 επέδειξε τη συνθετική ικανότητα διχλωρομεθυλενίου.[5]
Δομή και δεσμολογία
[Επεξεργασία | επεξεργασία κώδικα]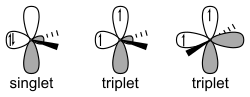
Οι δύο ισομερείς τάξεις καρβενίων είναι οι απλέτες και τριπλέτες. Τα καρβένια απλέτες περιέχουν μονήρη ζεύγη ηλεκτρονίων και αντιπαράλληλο σπιν (spin). Στη γλώσσα της θεωρίας σθένους - δεσμού, τα μόριά τους υιοθετούν υβριδισμό sp². Τα καρβένια τριπλέτες έχουν δύο (2) μονήρη ηλεκτρόνια με παράλληλο σπιν. Τα περισσότερα καρβένια έχουν μια μη γραμμική βασική κατάσταση τριπλέτας, εκτός από αυτά που περιέχουν άτομα αζώτου, οξυγόνου ή θείου, ή αλογόνου άμεσα συνδεμένα με το δισθενές άτομο άνθρακα.
Τα καρβένια ονομάζονται απλετικά ή τριπλετικά, ανάλογα με τo ηλεκτρονιακό σπιν που έχουν. Τα τριπλετικά καρβένια είναι παραμαγνητικά και μπορούν να παρατηρηθούν με φασματοσκοπία ηλεκτρονιακού συντονισμού, αν είναι αρκετά επίμονα, ώστε να δώσουν τον απαραίτητο χρόνο για τέτοια παρατήρηση. Το συνολικό σπιν των απλετών καρβενίων είναι 0, ενώ των τριπλετικών 1 (εκφρασμένα σε μονάδες ). Οι δεσμικές γωνίες είναι 125-140° για το τριπλετικό μεθυλένιο και 102° για το απλετικό μεθυλένιο (όπως καθορίζεται από τη φασματοσκοπία ηλεκτρονιακού συντονισμού). Τα τριπλετικά καρβένια είναι γενικά σταθερότερα στην αέρια κατάσταση, ενώ τα απλετικά καρβένια υπάρχουν πιο συχνά διαλυμένα σε ένυδρα μέσα.
Για απλούς υδρογονάνθρακες, τα τριπλετικά καρβένια συνήθως έχουν ενέργειες κατά 8 kcal/mol μικρότερες από τα ισομερή τα απλετικά καρβένια. Έτσι, γενικά, η τριπλετική είναι η πιο σταθερή κατάσταση (βασική κατάσταση), ενώ η απλετική είναι διεγερμένο χημικό είδος. Υποκαταστάτες που μπορούν να δώσουν ηλεκτρονιακά ζεύγη σταθεροποιούν την απλετική κατάσταση απεντοπίζοντας το μονήρες ηλεκτρονιακό ζεύγος σε ένα άδειο p τροχιακό. Αν η ενέργεια της απλετικής κατάστασης μειωθεί σημαντικά, τελικά γίνεται βασική κατάσταση. Δεν υπάρχουν αξιόπιστες στρατηγικές για τη σταθεροποίηση της τριπλετικής κατάστασης. Το καρβένιο 9-φλωρενυλιδένιο έχει αποδείξει ότι μπορεί τάχιστα να εξισορροπήσει μείγματα απλετικής και τριπλετικής κατάστασης και τριπλέτας με περίπου διαφορά ενέργειας 1,1 kcal/mol.[6] Ωστόσο, είναι συζητήσιμο το αν τα διαρυλοκαρβένια, όπως το 9-φλωρενυλιδένιο, είναι πραγματικά καρβένια, γιατί σε αυτά τα ηλεκτρόνια μπορούν να απεντοπιστούν τόσο εκτεταμένα που στην πραγματικότητα γίνονται δίριζες. Πειράματα in silico προτείνουν ότι οι τριπλετικές καταστάσεις μπορεί να είναι θερμοδυναμικά σταθεροποιούμενες με ηλεκτροθετικά ετεροάτομα, όπως τα σιλυλο- και τα σιλυλοξυ- καρβένια, ιδιαίτερα τα τριφθοροσιλυλοκαρβένια.[7]
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Μέθοδος 1η
[Επεξεργασία | επεξεργασία κώδικα]Μια μέθοδος που είναι ευρύτατα εφαρμόσιμη στην οργανική σύνθεση περιλαμβάνει τις αντιδράσεις απόσπασης gem-διαλογονοπαραγώγων εμπλέκοντας οργανολιθιακά αντιδραστήρια. Είναι αβέβαιο αν υπό τέτοιες συνθήκες σχηματίζονται ελεύθερα καρβένια ή σύμπλοκα μετάλλου-καρβενίου. Σε κάθε περίπτωση αυτά τα μεταλλοκαρβένια (ή καρβενοειδή) δίνουν τα αναμενόμενα οργανικά προϊόντα:
Μέθοδος 2η
[Επεξεργασία | επεξεργασία κώδικα]Για κυκλοπροπανιώσεις, χρησιμοποιείται ο ψευδάργυρος, μέσω της αντίδρασης Σίμμονς-Σμιθ. Σε ειδική αλλά διδακτική περίπτωση μπορούν να απομονωθούν α-αλυδραργυρικές ενώσεις και να θερμολυθούν ξεχωριστά. Για παράδειγμα, το αντιδραστήριο Σεϋφέρθ απελευθερώνει διχλωροκαρβένια με θέρμανση:
Μέθοδος 3η
[Επεξεργασία | επεξεργασία κώδικα]Πιο συνηθισμένα, καρβένια παράγονται από διαζωαλκάνια, μέσω φωτολυτικής, θερμολυτικής ή καταλυτικής από μεταβατικά μέταλλα παραγωγικής οδού. Μέταλλα που χρησιμοποιούνται ως καταλύτες γι' αυτήν τη μέθοδο είναι το ρόδιο και ο χαλκός. Η αντίδραση Μπάμφορντ-Στήβενς δίνει καρβένια σε απρωτικούς διαλύτες και καρβενιωνίου σε πρωτικούς διαλύτες.
Μέθοδος 4η
[Επεξεργασία | επεξεργασία κώδικα]Με απόσπαση υδραλογόνου (HX) από αλοφόρμια (CHX3), υπό συνθήκες μεταφοράς φάσης.
Μέθοδος 5η
[Επεξεργασία | επεξεργασία κώδικα]Η φωτόλυση διαζιρινών και εποξειδίων επίσης χρησιμοποιείται. Οι διαζιρίνες είναι ετεροκυκλικές μορφές διαζωαλκανίων. Η ενέργεια παραμόρφωσης δεσμών των τριμελών τους δακτυλίων κάνει τη φωτόλυση εύκολη. Η φωτόλυση εποξειδίων δίνει καρβονυλικές ενώσεις ως παραπροϊόντα. Σε ασύμμετρα εποξείδια σχηματίζονται δυο διαφορετικές καρβονυλικές ενώσεις. Ένας από τους δυο δεσμούς C-O έχει μεγαλύτερο χαρακτήρα διπλού δεσμού και έτσι είναι ισχυρότερος και λιγότερο πιθανό να σπάσει. Οι δομές συντονισμού μπορούν να οδηγήσουν στον καθορισμό του ποιου τμήματος θα συνεισφέρει περισσότερο στο σχηματισμό του καρβονυλίου. Όταν ο ένας αποκαταστάτης είναι αλκύλιο και ο άλλος αρύλιο, το άτομο άνθρακα με υποκαταστάτη αρύλιο συνήθως απελευθερώνεται ως καρβένιο.
Μέθοδος 6η
[Επεξεργασία | επεξεργασία κώδικα]Τα καρβένια είναι ενδιάμεσα της μετάθεσης Βολφφ.
Αντιδραστικότητα
[Επεξεργασία | επεξεργασία κώδικα]
Τα απλετικά και τα τριπλετικά καρβένια παρουσιάζουν διαφοροποιούμενη αντιδραστικότητα. Τα απλετικά καρβένια γενικά παίρνουν μέρος σε χηλιτροπικές αντιδράσεις τόσο ως ηλεκτρονιόφιλα, όσο και ως πυρηνόφιλα μέσα. Τα απλετικά καρβένια με μη συμπληρωμένα p-τροχιακά συνήθως είναι ηλεκτρονιόφιλα. Τα τριπλετικά καρβένια μπορούν να θεωρηθούν δίριζες, και παίρνουν μέρος σε βηματικές αντιδράσεις προσθήκης ριζών. Τα τριπλετικά καρβένια τείνουν να αντιδρούν με ενδιάμεσα που περιέχουν δυο μονήρη (όχι σε ζεύγη) ηλεκτρόνια, ενώ τα απλετικά καρβένια μπορούν να αντιδρούν σε ένα απλό συντονισμένο βήμα.
Εξαιτίας των δυο αυτών τρόπων αντιδρατικότητας, οι αντιδράσεις του απλετικού μεθυλενίου είναι στερεοειδικές, ενώ αυτές του τριπλετικού είναι στερεοεκλεκτικές. Αυτή η διαφορά μπορεί να χρησιμοποιηθεί για την απόδειξη της φύσης ενός καρβενίου. Για παράδειγμα, η αντίδραση μεθυλενίου που παράγεται από φωτόλυση διαζωμεθανίου σε cis-2-βουτένιο ή σε trans-2-βουτένιο δίνει ως προϊόν απλό διαστερεομερές 1,2-διμεθυλοκυκλοπροπάνιο, δηλαδή cis-1,2-διμεθυλοκυκλοπροπάνιο από cis-2-βουτένιο και trans-1,2-διμεθυλοκυκλοπροπάνιο από trans-2-βουτένιο, αντίστοιχα, γεγονός που αποδεικνύει ότι είναι απλετικό μεθυλένιο,[8] αυτό που παράγεται από αυτήν τη φωτόλυση. Αν ήταν τριπλετικό θα αναμένονταν να παράγεται περίπου ισομοριακό μείγμα και των δυο γεωμετρικών ισομερών, ανεξάρτητα από το ποιο αρχικό γεωμετρικό ισομερές 2-βουτένιο χρησιμοποιήθηκε.
Η αντιδραστικότητα ενός συγκεκριμένου καρβενίου εξαρτάται από τις ομάδες υποκαταστατών του. Η αντιδραστικότητά τους επηρεάζεται από μέταλλα. Κάποιες από τις αντιδράσεις των καρβενίων μπορεί να είναι οι παρεμβολές τους σε δεσμούς C-H, οι συντακτικές ανακατατάξεις και προσθήκες σε διπλούς δεσμούς. Τα καρβένια μπορούν να ταξινομηθούν ως πυρηνόφιλα, ως ηλεκτρονιόφιλα ή και ως αμφίφιλα. Για παράδειγμα, αν ένας υποκαταστάτης είναι ικανός να δώσει ένα ζεύγος ηλεκτρονίων, πολύ πιθανώς το καρβένιο αυτό δεν μπορεί να είναι ηλεκτρονιόφιλο. Τα αλκυλοκαρβένια παρεμβάλλονται πολύ πιο εκελεκτικά από ότι το μεθυλένιο, το οποίο δεν κάνει διάκριση ανάμεσα σε δεσμούς C-H από πρωτοταγή, δευτεροταγή ή τριτοταγή άτομα άνθρακα.
Κυκλοπροπανίωση
[Επεξεργασία | επεξεργασία κώδικα]
Τα καρβένια μπορούν να δώσουν αντιδράσεις προσθήκης σε διπλούς δεσμούς σχηματίζοντας κυκλοπροπάνια.
Ένας συντονισμένος μηχανισμός είναι διαθέσιμος για απλετικά καρβένια. Τα τριπλετικά καρβένια δεν διατηρούν τη στερεοχημεία στο παραγώμενο προΊόν. Οι αντιδράσεις προσθήκης είναι συνήθως πολύ γρήγορες και εξώθερμες. Το πιο αργό βήμα στις περισσότερες περιπτώσεις είναι η παραγωγή του καρβενίου. Ένα πολύ καλά μελετημένο αντιδραστήριο που εμπλέκεται σε αντιδράσεις κυκλοπροπανίωσης είναι το αποκαλούμενο αντιδραστήριο Σίμμονς - Σμιθ (Simmons-Smith reagent). Αυτό το αντιδραστηριακό σύστημα περιέχει χαλκό, ψευδάργυρο και ιώδιο. Πιστεύεται ότι το δραστικό συστατικό είναι ο ιωδιούχος ιωδομεθυλοψευδάργυρος [(ICH2Zn)I]. Το αντιδραστήριο αυτό συμπλέκται με υδροξυλομάδες, έτσι ώστε η προσθήκη συνήθως συμβαίνει συν σε τέτοιες ομάδες.
Αντιδράσεις παρεμβολής
[Επεξεργασία | επεξεργασία κώδικα]



Οι αντιδράσεις παρεμβολής είναι ένας άλλος συνηθισμένος τύπος αντιδραστικότητας των καρβενίων. Βασικά, τα καρβένια μπορούν να παρεμβάλλουν τον εαυτό τους σε κάθε υπάρχοντα δεσμό. Η σειρά «προτιμήσεως» που παρουσιάζουν είναι η ακόλουθη:
- Δεσμοί X-H, όπου X όχι άνθρακας.
- Δεσμοί C-H.
- Δεσμοί C-C.
Οι παρεμβολές αυτές μπορεί να πραγματοποιούνται σε ένα απλό βήμα, αλλά μπορεί και να απαιτηθούν περισσότερα βήματα.
Σε κάποιες περιπτώσεις είναι δυνατές και αντιδράσεις ενδομοριακής παρεμβολής, που παρουσιάζουν καινούργιες συνθετικές λύσεις. Γενικά, άκαμπτες δομές ευνοούν την πραγματοποίηση τέτοιων παρεμβολών. Όταν είναι πιθανή τέτοια ενδομοριακή παρεμβολή, οι διαμοριακές παρεμβολές δεν εμφανίζονται. Σε ευέλικτες δομές, ο σχηματισμός ενός πενταμελούς δακτυλίου είναι προτιμάται σε σύγκριση με το σχηματισμό ενός εξαμελούς. Τόσο οι διαμοριακές όσο και οι ενδομοριακές παρεμβολές είναι τροποποιήσιμες σε ασύμμετρη επαγωγή με την επιλογή χειρόμορφων συναρμοτών σε μεταλλικά κέντρα.
Τα αλκιλιδένια (είδος καρβενίων) είναι δελεαστικά στο να προσφέρουν το σχηματισμό ομάδων κυκλοπεντενίων. Για να παραχθεί ένα αλκυλιδένιο μια κετόνη μπορεί να εκτεθεί σε διαζω(τριμεθυλοσιλυλο)μεθάνιο (Me3SiCHN2).
Διμερισμός καρβενίων
[Επεξεργασία | επεξεργασία κώδικα]
Τα καρβένια και τα πρόδρομά τους καρβενοειδή μπορούν να δώσουν αντιδράσεις διμερισμού, σχηματίζοντας αλκένια. Ενώ αυτές οι αντιδράσεις είναι συχνά ανεπιθύμητες παράπλευρες αντιδράσεις, μπορούν από την άλλη να χρησιμοποιηθούν ως συνθετικό εργαλείο και ο άμεσος διμερισμός μεταλλοκαρβενίου έχει χρησιμοποιηθεί για τη σύνθεση πολυαλκινυλαιθενίων.
Τα επίμονα καρβένια (αυτά που είναι πολύ σταθερότερα από τα συνηθισμένα) βρίσκονται σε χημική ισορροπία με τα αντίστοιχα διμερή τους. Αυτό το φαινόμενο είναι γνωστό ως ισορροπία Βανζλίκ.
Καρβένια ως συναρμοτές στην οργανομεταλλική χημεία
[Επεξεργασία | επεξεργασία κώδικα]
Σε οργανομεταλλικά χημικά είδη, μεταλλικά σύμπλοκα με γενικό τύπο LnMCRR΄ συχνά περιγράφονται ως σύμπλοκα καρβενίων. Τέτοια χημικά είδη, ωστόσο, δεν αντιδρούν όπως τα ελεύθερα καρβένια, ενώ σπανίως παράγονται από πρόδρομα καρβένια, εκτός από τα επίμονα καρβένια (που χρησιμοποιούνται πιο συχνά για το σχηματισμό συμπλόκων). Τα σύμπλοκα καρβενίων των μεταβατικών μετάλλων μπορούν να ταξινομηθούν ανάλογα με τη αντιδραστικότητά τους, με τις δυο πρώτες κατηγορίες να ορίζονται πιο ξεκάθαρα:
- Καρβένια Φίσερ, στα οποία το καρβένιο συνδέεται με μέταλλο που φέρει ηλεκτρονιοδεκτική ομάδα (συνήθως ένα καρβονύλιο). Σε αυτές τις περιπτώσεις το καρβενοειδές άτομο άνθρακα είναι ήπια ηλεκτρονιόφιλο.
- Καρβένια Σροκ, στα οποία το καρβένιο συνδέεται με μέταλλο που φέρει ηλεκτρονιοδοτική ομάδα. Σε αυτές τις περιπτώσεις το καρβενοειδές άτομο άνθρακα είναι πυρηνόφιλο και μοιάζει με αντιδραστήριο Βίττινγκ, που δεν θεωρείται παράγωγο καρβενίου.
- Καρβενικές ρίζες, στα οποία το καρβένιο συνδέεται με μέταλλο με χάσμα οκτάδας, όπου το άτομο άνθρακα του καρβενίου παρουσιάζει χαρακτήρα ρίζας. Οι καρβενικές ρίζες παρουσιάζουν ιδιότητες τόσο των καρβενίων Φίσερ, όσο και των καρβενίων Σροκ, αλλά στην πραγματικότητα είναι μακρύβια ενδιάμεσα αντιδράσεων.
- Τα N-ετεροκυκλικά καρβένια (NHCs)[9] παράγονται με C-αποπρωτονίωση αλάτων ιμιδαζωλώνιου ή διυδροϊμιδαζωλώνιου. Συχνά αναπτύσσονται ως βοηθητικοί συναρμοτές στην οργανομεταλλική χημεία. Τέτοια καρβένια συνήθως είναι πολύ ισχυροί σ-δότες, που συχνά γίνονται δέκτες σύγκρισης με τις φωσφίνες.[10][11] Οι ίδιοι οι συναρμοτές, ιδιαίτερα όταν απομονώνονται ελεύθεροι από το μέταλλο, μερικές φορές είναι γνωστοί ως καρβένια Αρντουένγκο ή ως καρβένια Βάνζλικ.
Εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]Μια μεγάλης κλίμακας εφαρμογή των καρβενίων στη βιομηχανική παραγωγή τετραφθοραιθυλένιου (CF2=CF2), που είναι με τη σειρά της η πρόδρομη ένωση για την παραγωγή τεφλόν. Το τετραφθοραιθυλένιο παράγεται με ενδιάμεσο το διφθορομεθυλένιο:[12]
Η παρεμβολή καρβενίων σε δεσμούς C-H επίσης πλατιά έχει βρει εφαρμογές, όπως για παράδειγμα η αύξηση της λειτουργικότητας πολυμερικών υλικών[13] και η ηλεκτροσκλήρυνση συμπλόκων.[14] Οι εφαρμογές βασίζονται στις συνθετικές 3-αρυλο-3-τριφθορομεθυλοδιαζιρίνες,[15][16] πρόδρομο καρβένιο που μπορεί να ενεργοποιηθεί με θερμότητα,[17] φως[16][17] ή διαφορά δυναμικού.[14][18]
Δείτε επίσης
[Επεξεργασία | επεξεργασία κώδικα]- Καρβενοειδή, δηλαδή σύμπλοκα καρβενίων και μεταβατικών μετάλλων.
- Ατομικός άνθρακας, μοναδικό άτομο άνθρακα με χημικό τύπο [:C:], που μπορεί να θεωρηθεί και να τύχει εφαρμογών ως δικαρβένιο. Χρησιμοποιήθηκε επίσης για την παραγωγή «πραγματικών καρβενίων» in situ.
- Φωλιασμένα καρβένια, που αυξάνουν τη σταθερότητά τους χάρη στη γειτνίαση διπλού δεσμού, που εξασφαλίζει το σχηματισμό συζυγιακών συστημάτων.
- Ανάλογα καρβενίων, ενώσεις άλλων στοιχείων (κυρίως της ομάδας 14) που παρουσιάζουν ομοιότητες με τα καρβένια.
- Κατιόντα καρβενιωνίων, δηλαδή πρωτονιωμένα καρβένια.
- Πολυμερισμός μετάθεσης με διάνοιξη δακτυλίου.
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Hoffmann, Roald (2005). Molecular Orbitals of Transition Metal Complexes. Oxford. σελ. 7. ISBN 0-19-853093-5.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "carbenes".
- ↑ Buchner, E.; Feldmann, L. (1903). «Diazoessigester und Toluol». Berichte der Deutschen Chemischen Gesellschaft 36 (3): 3509. doi:.
- ↑ Staudinger, H.; Kupfer, O. (1912). «Über Reaktionen des Methylens. III. Diazomethan». Berichte der Deutschen Chemischen Gesellschaft 45: 501–509. doi:.
- ↑ Von E. Doering, W.; Hoffmann, A. K. (1954). «The Addition of Dichlorocarbene to Olefins». Journal of the American Chemical Society 76 (23): 6162. doi:.
- ↑ Grasse, P. B.; Brauer, B. E.; Zupancic, J. J.; Kaufmann, K. J.; Schuster, G. B. (1983). «Chemical and physical properties of fluorenylidene: equilibration of the singlet and triplet carbenes». Journal of the American Chemical Society 105 (23): 6833. doi:.
- ↑ Nemirowski, A; Schreiner, P. R. (November 2007). «Electronic Stabilization of Ground State Triplet Carbenes». J. Org. Chem. 72 (25): 9533–9540. doi:. PMID 17994760.
- ↑ Skell, P. S.; Woodworth, R. C. (1956). «Structure of Carbene, Ch2». Journal of the American Chemical Society 78 (17): 4496. doi:.
- ↑ For a general review with a focus on applications with diaminocarbenes, see: Hopkinson, M. N.; Richter, C.; Schedler, M.; Glorius, F. Nature 2014, 510, 485-496.
- ↑ S. P. Nolan "N-Heterocyclic Carbenes in Synthesis" 2006, Wiley-VCH, Weinheim. Print (ISBN 9783527314003). Online (ISBN 9783527609451).
- ↑ Marion, N.; Diez-Gonzalez, S.; Nolan, S. P., "N-heterocyclic carbenes as organocatalysts", Angew. Chem. Int. Ed. 2007, volume 46, 2988-3000.
- ↑ Bajzer, W. X. (2004). «Fluorine Compounds, Organic». Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons. doi:10.1002/0471238961.0914201802011026.a01.pub2. ISBN 978-0471238966.
- ↑ Yang, Peng; Yang, Wantai (2013-07-10). «Surface Chemoselective Phototransformation of C–H Bonds on Organic Polymeric Materials and Related High-Tech Applications». Chemical Reviews 113 (7): 5547–5594. doi:. ISSN 0009-2665. PMID 23614481. https://archive.org/details/sim_chemical-reviews_2013-07_113_7/page/5547.
- ↑ 14,0 14,1 Ping, Jianfeng; Gao, Feng; Chen, Jian Lin; Webster, Richard D.; Steele, Terry W. J. (2015-08-18). «Adhesive curing through low-voltage activation» (στα αγγλικά). Nature Communications 6: 8050. doi:. ISSN 2041-1723. PMID 26282730. Bibcode: 2015NatCo...6E8050P.
- ↑ Nakashima, Hiroyuki; Hashimoto, Makoto; Sadakane, Yutaka; Tomohiro, Takenori; Hatanaka, Yasumaru (2006-11-01). «Simple and Versatile Method for Tagging Phenyldiazirine Photophores». Journal of the American Chemical Society 128 (47): 15092–15093. doi:. ISSN 0002-7863. PMID 17117852.
- ↑ 16,0 16,1 Blencowe, Anton; Hayes, Wayne (2005-08-05). «Development and application of diazirines in biological and synthetic macromolecular systems» (στα αγγλικά). Soft Matter 1 (3): 178. doi:. ISSN 1744-6848. Bibcode: 2005SMat....1..178B.
- ↑ 17,0 17,1 Liu, Michael T. H. (1982-01-01). «The thermolysis and photolysis of diazirines» (στα αγγλικά). Chemical Society Reviews 11 (2): 127. doi:. ISSN 1460-4744.
- ↑ Elson, Clive M.; Liu, Michael T. H. (1982-01-01). «Electrochemical behaviour of diazirines» (στα αγγλικά). Journal of the Chemical Society, Chemical Communications (7): 415. doi:. ISSN 0022-4936. http://xlink.rsc.org/?DOI=c39820000415.


![{\displaystyle \mathrm {R_{2}C(Br)Li{\xrightarrow {}}[R_{2}C:]+LiBr} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/365c8012c276ca35fd7efa19e8c964ad16d83ecb)
![{\displaystyle \mathrm {PhHgCCl_{3}{\xrightarrow {}}[:CCl_{2}]+PhHgCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ab3cd579cb774b154fee7037df3f086ac6526420)
![{\displaystyle \mathrm {CHClF_{2}{\xrightarrow {}}[:CF_{2}]+HCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f2b1f721d15e8fb117fda1ec27ca338e59318b1e)
![{\displaystyle \mathrm {2[:CF_{2}]{\xrightarrow {}}CF_{2}=CF_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7dafa95cdb4da9501c4772d28f488a8702d963c1)
