Κατανομή Μάξγουελ-Μπόλτσμαν
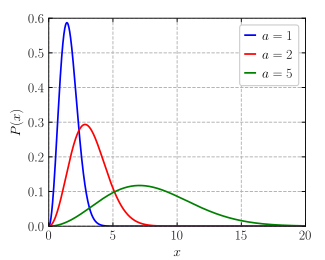

Στη φυσική, και συγκεκριμένα στη στατιστική μηχανική, η κατανομή Μάξγουελ-Μπόλτσμαν (αγγλ. Maxwell-Boltzmann distribution) ή απλούστερα κατανομή Μάξγουελ είναι μια συγκεκριμένη κατανομή πιθανότητας, που φέρει τα ονόματα των Τζέιμς Κλερκ Μάξγουελ και Λούντβιχ Μπόλτσμαν.
Ορίσθηκε και χρησιμοποιήθηκε για πρώτη φορά για να περιγράψει τις ταχύτητες των σωματιδίων που αποτελούν ένα ιδανικό αέριο. Σε αυτό τα σωματίδια κινούνται ελεύθερα μέσα σε ένα ακίνητο δοχείο χωρίς να αλληλεπιδρούν μεταξύ τους εκτός από πρακτικά στιγμιαίες συγκρούσεις, κατά τις οποίες ανταλλάσσουν ενέργεια και ορμή μεταξύ τους ή με το θερμικό περιβάλλον τους. Ο όρος «σωματίδιο» εδώ αναφέρεται στα άτομα ή τα μόρια του αερίου και το σύστημα των σωματιδίων θεωρείται ότι έχει φθάσει σε θερμοδυναμική ισορροπία.[1] Οι ενέργειες τέτοιων σωματιδίων ακολουθούν τη λεγόμενη στατιστική Μάξγουελ-Μπόλτσμαν, ενώ η στατιστική κατανομή των ταχυτήτων εξάγεται θεωρώντας ότι όλη η ενέργειά τους είναι κινητική.
Από μαθηματικής απόψεως, η κατανομή Μάξγουελ-Μπόλτσμαν είναι η κατανομή χ με τρεις βαθμούς ελευθερίας (τις συνιστώσες του διανύσματος της ταχύτητας στον ευκλείδειο χώρο), με μία παράμετρο κλίμακας.[2]
Η κατανομή Μάξγουελ-Μπόλτσμαν είναι ένα αποτέλεσμα της κινητικής θεωρίας των αερίων, η οποία παρέχει μια απλουστευμένη ερμηνεία πολλών θεμελιωδών ιδιοτήτων των αερίων, όπως είναι η πίεση και η διάχυση.[3] Η κατανομή αφορά τη διανυσματική ταχύτητα, αλλά εξαρτάται μόνο από το μέτρο της ταχύτητας των σωματιδίων και μάς υποδεικνύει ποια είναι τα πιθανότερα μέτρα ταχύτητας. Η κινητική θεωρία των αερίων ισχύει μόνο για τα κλασικά ιδανικά αέρια, που αποτελούν εξιδανίκευση των πραγματικών αερίων. Στα τελευταία υπάρχουν διάφορες επιδράσεις (π.χ. δυνάμεις van der Waals, κβαντικές αλληλεπιδράσεις ανταλλαγής, κλπ.), που διαφοροποιούν την κατανομή ταχυτήτων των σωματιδίων τους από την κατανομή Μάξγουελ-Μπόλτσμαν. Ωστόσο, τα αραιά αέρια σε θερμοκρασίες μακριά από το σημείο υγροποιήσεώς τους συμπεριφέρονται σχεδόν σαν ένα ιδανικό αέριο και η κατανομή ταχυτήτων Μάξγουελ αποτελεί μια πολύ καλή προσέγγιση.
Η κατανομή διατυπώθηκε πρώτα από τον Μάξγουελ το 1860 ως ερμηνεία πειραματικών δεδομένων.[4] Αργότερα, κατά τη δεκαετία του 1870, ο Μπόλτσμαν διεξήγαγε σημαντικές διερευνήσεις της φυσικής προελεύσεως της κατανομής.
Η κατανομή Μάξγουελ-Μπόλτσμαν μπορεί να εξαχθεί μαθηματικώς έχοντας ως ζητούμενο τη μεγιστοποίηση της εντροπίας του συστήματος, με τον περιορισμό της διατηρήσεως της μέσης ενέργειας.
Συνάρτηση της κατανομής
[Επεξεργασία | επεξεργασία κώδικα]Δεχόμενοι ότι το σύστημα περιέχει πολύ μεγάλο αριθμό σωματιδίων, το κλάσμα των σωματιδίων που βρίσκονται μέσα σε ένα απειροστό «στοιχείο» (διάστημα) του τριδιάστατου χώρου των ταχυτήτων, , με κέντρο ένα διάνυσμα μέτρου , είναι και ισχύει:
όπου είναι η μάζα του κάθε σωματιδίου και το γινόμενο της σταθεράς του Μπόλτσμαν και της θερμοδυναμικής θερμοκρασίας.
Το στοιχείο του χώρου των ταχυτήτων μπορεί να γραφεί ως d = ddd σε καρτεσιανό σύστημα συντεταγμένων, ή ως d = dd σε σύστημα σφαιρικών συντεταγμένων, όπου το υποδηλώνει στερεά γωνία. Εδώ η είναι η συνάρτηση πιθανότητας της κατανομής, κανονικοποιημένη έτσι ώστε το d πάνω σε όλες τις ταχύτητες να είναι ίσο με τη μονάδα. Στη φυσική πλάσματος η κατανομή πιθανότητας πολλαπλασιάζεται συχνά με την πυκνότητα των σωματιδίων (αριθμητική πυκνότητα), έτσι ώστε το ολοκλήρωμα της προκύπτουσας συναρτήσεως κατανομής να ισούται με την πυκνότητα αυτή.
Θεωρώντας τη συνάρτηση της κατανομής Μάξγουελ για σωματίδια που κινούνται μόνο σε μία διεύθυνση (μονοδιάστατη κίνηση), έστω την , έχουμε
αποτέλεσμα που μπορεί να βρεθεί ολοκληρώνοντας την τριδιάστατη μορφή ως προς τις συνιστώσες και .
Αναγνωρίζοντας τη συμμετρία της ως προς όλες τις διευθύνσεις, μπορούμε να ολοκληρώσουμε ως προς τη στερεά γωνία και να γράψουμε μια κατανομή πιθανότητας των ταχυτήτων ως τη συνάρτηση[5]:
Αυτή η συνάρτηση πυκνότητας πιθανότητας δίνει την πιθανότητα ανά μονάδα ταχύτητας να βρούμε ένα σωματίδιο με ταχύτητα κοντά στη .
Η απλούστερη συνήθης διαφορική εξίσωση που ικανοποιείται από την κατανομή είναι η:
- με
ή, σε αδιάστατη μορφή,
- με
όπου
Τυπικά μέτρα ταχύτητας
[Επεξεργασία | επεξεργασία κώδικα]Το μέσο μέτρο της ταχύτητας των σωματιδίων, το πιθανότερο μέτρο ταχύτητας για ένα σωματίδιο και η «rms» () μπορούν να βρεθούν από τις ιδιότητες της κατανομής Μάξγουελ.
Τα αποτελέσματα είναι σχεδόν ακριβή για μονοατομικά αέρια (όπως τα ευγενή αέρια), αλλά και για μοριακά αέρια, όπως το διατομικό οξυγόνο. Αυτό συμβαίνει επειδή, παρά τη μεγαλύτερη ειδική θερμότητα εξαιτίας των περισσότερων βαθμών ελευθερίας τους, η μεταφορική κινητική τους ενέργεια (και άρα η ταχύτητά τους) παραμένει αμετάβλητη.[6]
- H πιθανότερη ταχύτητα vp (κατά μέτρο) είναι το μέτρο της ταχύτητας που είναι πιθανότερο να έχει ένα τυχαίο σωματίδιο (της ίδιας μάζας m) του συστήματος και αντιστοιχεί στη μέγιστη τιμή της f(v). Για να τη βρούμε, υπολογίζουμε την παράγωγο df/dv, τη θέτουμε ίση με το μηδέν και επιλύουμε ως προς v:
Βρίσκουμε τη φυσική λύση:
(η δεύτερη λύση αντιπροσωπεύει τη «λιγότερο πιθανή ταχύτητα»).
Η R είναι η παγκόσμια σταθερά των αερίων και η M η γραμμομοριακή μάζα του αερίου, δηλαδή η μάζα του ενός σωματιδίου του επί τον αριθμό του Αβογκάντρο, Na:
Για το διατομικό άζωτο (N2, το βασικό συστατικό του αέρα), σε θερμοκρασία 300 K, αυτό δίνει
- Το μέσο μέτρο της ταχύτητας είναι η αναμενόμενη τιμή της κατανομής των μέτρων των ταχυτήτων. Θέτοντας :
- Η ταχύτητα rms είναι η ροπή δευτέρας τάξεως της κατανομής των μέτρων των ταχυτήτων. Πρόκειται για την τετραγωνική ρίζα της μέσης τιμής των τετραγώνων των ταχυτήτων, που αντιστοιχεί στο μέτρο της ταχύτητας ενός σωματιδίου που έχει τη διάμεση κινητική ενέργεια. Θέτοντας :
Τα τρία παραπάνω μέτρα ταχύτητας σχετίζονται μεταξύ τους ως εξής:
Η ταχύτητα rms συνδέεται απευθείας με την ταχύτητα του ήχου c μέσα στο συγκεκριμένο αέριο, με τη σχέση
όπου είναι ο αδιαβατικός δείκτης και f είναι ο αριθμός των βαθμών ελευθερίας του κάθε σωματιδίου του αερίου. Για το παράδειγμα του διατομικού αζώτου στους 300 K, και:
ενώ η πραγματική τιμή για τον αέρα είναι πολύ κοντά, 347 m/s στους 300 K (οι διορθώσεις για μεταβλητή υγρασία είναι της τάξεως του 0,1% έως 0,6%).
Εξαγωγή και σχετιζόμενες κατανομές
[Επεξεργασία | επεξεργασία κώδικα]Στατιστική Μάξγουελ-Μπόλτσμαν
[Επεξεργασία | επεξεργασία κώδικα]Η αρχική εξαγωγή της κατανομής από τον Μάξγουελ το 1860 βασιζόταν στις μοριακές συγκρούσεις της κινητικής θεωρίας των αερίων και σε συμμετρίες της συναρτήσεως κατανομής ταχυτήτων. Ο Μάξγουελ έδωσε και ένα πρώτο επιχείρημα ότι αυτές οι μοριακές κρούσεις συνεπάγονται μία τάση προς την ισορροπία.[4][7] Μετά, ο Μπόλτσμαν[8] το 1872 εξήγαγε επίσης μια κατανομή με βάση την κλασική μηχανική και υπεστήριξε ότι τα αέρια θα έπρεπε με την πάροδο του χρόνου να τείνουν προς αυτή την κατανομή εξαιτίας των συγκρούσεων μεταξύ των σωματιδίων τους («θεώρημα H»). Πέντε χρόνια αργότερα[9] ο Μπόλτσμαν εξήγαγε και πάλι την κατανομή μέσα από το πλαίσιο της στατιστικής θερμοδυναμικής. Σε αυτή την εξαγωγή άρχισε με τη λεγόμενη στατιστική Μάξγουελ-Μπόλτσμαν. Η στατιστική αυτή δίνει τον μέσο αριθμό σωματιδίων που βρίσκονται σε μια δοσμένη μικροκατάσταση. Υπό ορισμένες προϋποθέσεις, ο λογάριθμός του κλάσματος των σωματιδίων που βρίσκονται σε μια συγκεκριμένη μικροκατάσταση είναι ανάλογος του λόγου της ενέργειας αυτής της καταστάσεως προς τη θερμοκρασία του συστήματος:
Οι παραδοχές για να ισχύει αυτή η σχέση είναι ότι τα σωματίδια δεν αλληλεπιδρούν και ότι είναι «κλασικά», δηλαδή η κατάσταση του καθενός μπορεί να θεωρηθεί ανεξάρτητη από τις καταστάσεις των άλλων σωματιδίων. Επιπλέον, το σύστημα των σωματιδίων θεωρείται ότι βρίσκεται σε θερμική ισορροπία.[1][10]
Αυτή η σχέση μπορεί να γραφεί ως εξίσωση εισάγοντας έναν εξισωτικό παράγοντα:
όπου:
- Ni είναι ο αναμενόμενος αριθμός σωματιδίων στη μικροκατάσταση i,
- N είναι ο συνολικός αριθμός σωματιδίων στο σύστημα,
- Ei είναι η ενέργεια της μικροκαταστάσεως i,
- το άθροισμα επί του δείκτη j λαβαίνει υπόψη όλες τις μικροκαταστάσεις,
- T είναι η θερμοκρασία ισορροπίας του συστήματος,
- k είναι η σταθερά του Μπόλτσμαν.
Ο παρονομαστής στην εξίσωση είναι απλώς ένας κανονικοποιητικός παράγοντας, έτσι ώστε οι λόγοι να αθροίζονται σε μονάδα.
Επειδή η ταχύτητα σχετίζεται με την ενέργεια, η παραπάνω εξίσωση μπορεί να χρησιμοποιηθεί για την εξαγωγή σχέσεων μεταξύ της θερμοκρασίας και των μέτρων των ταχυτήτων των σωματιδίων του αερίου. Το μόνο που χρειάζεται είναι να βρεθεί η πυκνότητα των μικροκαταστάσεων ενέργειας, η οποία προσδιορίζεται υποδιαιρώντας τον χώρο των ορμών σε ίσες μεταξύ τους περιοχές.
Κατανομή των ορμών
[Επεξεργασία | επεξεργασία κώδικα]Η δυναμική ενέργεια λαμβάνεται ίση με μηδέν, έτσι ώστε όλη η ενέργεια θεωρείται ότι είναι κινητική. Η σχέση μεταξύ κινητικής ενέργειας και ορμής για μη σχετικιστικά μη μηδενικής μάζας σωματίδια είναι
όπου p2 είναι το τετράγωνο της διανυσματικής ορμής p = [px, py, pz]. Μπορούμε έτσι να ξαναγράψουμε την εξίσωση της προηγούμενης ενότητας ως:
όπου Z είναι η συνάρτηση μερισμού. Εδώ m είναι η μάζα του κάθε σωματιδίου του αερίου, T η θερμοδυναμική θερμοκρασία και k η σταθερά Μπόλτσμαν. Αυτή η κατανομή είναι ανάλογη της συναρτήσεως πυκνότητας πιθανότητας fp (πιθανότητα να βρεθεί ένα σωματίδιο με αυτές τις τιμές συνιστωσών της ορμής του, οπότε:
Η σταθερά κανονικοποιήσεως μπορεί να προσδιορισθεί θέτοντας την πιθανότητα να έχει ένα σωματίδιο μια οποιαδήποτε ορμή ίση με 1. Ολοκληρώνοντας το εκθετικό σε αυτή τη σχέση πάνω σε όλες τις px, py και pz δίνει έναν παράγοντα
Η κανονικοποιημένη συνάρτηση κατανομής είναι έτσι:
Η κατανομή φαίνεται να είναι το γινόμενο τριών ανεξάρτητων μεταβλητών σε κανονική κατανομή, των , και . Επιπλέον, μπορούμε να δούμε ότι το μέτρο της ορμής θα ακολουθεί μια κατανομή Μάξγουελ-Μπόλτσμαν, με .
Κατανομή των ενεργειών
[Επεξεργασία | επεξεργασία κώδικα]Η κατανομή της ενέργειας βρίσκεται θέτοντας όπου είναι ο απειροστός όγκος στον χώρο φάσεων των ορμών, ο οποίος αντιστοιχεί στο διάστημα ενεργειών . Εκμεταλλευόμενοι τη σφαιρική συμμετρία της σχέσεως διασποράς ενέργειας-ορμής , αυτό μπορεί να εκφρασθεί με το ως Από τις παραπάνω σχέσεις, εκφράζοντας τα πάντα με όρους της ενέργειας , παίρνουμε
και τελικώς
Αφού η ενέργεια είναι ανάλογη με το άθροισμα των τετραγώνων των τριών συνιστωσών της ορμής και αυτές έχουν κανονική κατανομή, η ενέργεια παρουσιάζει κατανομή Γ, και ειδικότερα κατανομή χ2 με τρεις βαθμούς ελευθερίας.
Σύμφωνα με το θεώρημα της ισοκατανομής, αυτή η ενέργεια κατανέμεται εξίσου και στους τρεις βαθμούς ελευθερίας, έτσι ώστε η ενέργεια ανά βαθμό ελευθερίας κατανέμεται σε κατανομή χ2 με έναν βαθμό ελευθερίας[11]:
όπου είναι η ενέργεια ανά βαθμό ελευθερίας. Στην ισορροπία αυτή η κατανομή θα ισχύει για οσουσδήποτε βαθμούς ελευθερίας. Π.χ. αν τα σωματίδια έχουν τη μορφή ανένδοτων διπόλων με σταθερή διπολική ροπή, θα έχουν τρεις μεταφορικούς βαθμούς ελευθερίας και δύο πρόσθετους περιστροφικούς βαθμούς ελευθερίας. Η ενέργεια σε κάθε βαθμό ελευθερίας θα περιγράφεται από την παραπάνω κατανομή χ2 με έναν βαθμό ελευθερίας, και η συνολική ενέργεια θα κατανέμεται σύμφωνα με μια κατανομή χ2 με 5 βαθμούς ελευθερίας. Αυτό σχετίζεται με την ειδική θερμότητα ενός αερίου.
Η κατανομή Μάξγουελ-Μπόλτσμαν μπορεί να εξαχθεί και αν θεωρήσουμε το σύστημα ενός κβαντικού αερίου για το οποίο μπορεί να γίνει η προσέγγιση ε >> k T.
Κατανομή των διανυσματικών ταχυτήτων
[Επεξεργασία | επεξεργασία κώδικα]Παρατηρώντας ότι η πυκνότητα πιθανότητας για τις διανυσματικές ταχύτητες fv είναι ανάλογη της συναρτήσεως πυκνότητας πιθανότητας για τις ορμές,
και επειδή p = mv, έχουμε:
σχέση η οποία δίνει την κατανομή ταχυτήτων Μάξγουελ-Μπόλτσμαν. Η πιθανότητα να βρεθεί ένα σωματίδιο με ταχύτητα εντός του απειροστού διαστήματος [dvx, dvy, dvz] γύρω από την τιμή v = [vx, vy, vz] είναι
Καθώς συμβαίνει και με την ορμή, αυτή η κατανομή είναι το γινόμενο τριών ανεξάρτητων κανονικώς κατανεμημένων μεταβλητών , και , αλλά με διακύμανση . Μπορούμε επίσης να παρατηρήσουμε ότι η κατανομή Μάξγουελ-Μπόλτσμαν για τις διανυσματικές ταχύτητες [vx, vy, vz] είναι το γινόμενο των κατανομών για την κάθε συνιστώσα των ταχυτήτων:
όπου η κατανομή για μία μόνο διεύθυνση είναι
Η κάθε συνιστώσα των διανυσμάτων ταχύτητας των σωματιδίων έχει μια κανονική κατανομή με μέσο όρο και τυπική απόκλιση , έτσι ώστε το διάνυσμα έχει μια τριδιάστατη κανονική κατανομή, ένα είδος κανονικής κατανομής πολλών μεταβλητών, με μέση τιμή και τυπική απόκλιση .
Κατανομή των μέτρων των ταχυτήτων
[Επεξεργασία | επεξεργασία κώδικα]Η κατανομή ταχυτήτων Μάξγουελ-Μπόλτσμαν για τα μέτρα των ταχυτήτων των σωματιδίων έπεται από την κατανομή για τις διανυσματικές ταχύτητες. Το μέτρο είναι
και το στοιχείο όγκου σε σφαιρικές συντεταγμένες
όπου και είναι οι γωνίες στις σφαιρικές συντεταγμένες του διανύσματος της ταχύτητας. Η ολοκλήρωση της συναρτήσεως πυκνότητας πιθανότητας των ταχυτήτων επί των στερεών γωνιών δίνει έναν πρόσθετο παράγοντα . Η κατανομή των μέτρων των ταχυτήτων με αντικατάσταση του μέτρου με το άθροισμα των τετραγώνων των συνιστωσών του διανύσματος δίνει:
Δείτε επίσης
[Επεξεργασία | επεξεργασία κώδικα]
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,0 1,1 F. Mandl: Statistical Physics (2η έκδ.), John Wiley & Sons, 2008
- ↑ University Physics – With Modern Physics (12η έκδ.) των H.D. Young & R.A. Freedman (συγγραφείς της αρχικής εκδ.), Addison-Wesley (Pearson International), 2008
- ↑ Encyclopaedia of Physics (2η έκδ.) των R.G. Lerner & G.L. Trigg, VHC publishers, 1991
- ↑ 4,0 4,1 Δείτε:
- Maxwell, J.C. (1860 A): «Illustrations of the dynamical theory of gases. Part I. On the motions and collisions of perfectly elastic spheres», The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science, 4η σειρά, τόμ. 19, σσ. 19-32. [1]
- Maxwell, J.C. (1860 B): «Illustrations of the dynamical theory of gases. Part II. On the process of diffusion of two or more kinds of moving particles among one another», The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science, 4η σειρά, τόμ. 20, σσ. 21-37. [2]
- ↑ H.J.W. Müller-Kirsten (2013): Basics of Statistical Physics, 2η έκδ., World Scientific, κεφ. 2.
- ↑ Raymond A. Serway· Jerry S. Faughn & Chris Vuille (2011). College Physics, volume 1 (9η έκδοση). σελ. 352. ISBN 9780840068484.
- ↑ Gyenis, Balazs (2017). «Maxwell and the normal distribution: A colored story of probability, independence, and tendency towards equilibrium». Studies in History and Philosophy of Modern Physics 57: 53–65. doi:. Bibcode: 2017SHPMP..57...53G.
- ↑ Boltzmann, L.: «Weitere studien über das Wärmegleichgewicht unter Gasmolekülen», Sitzungsberichte der Kaiserlichen Akademie der Wissenschaften in Wien, mathematisch-naturwissenschaftliche Classe, τόμος 66 (1872), σσ. 275-370.
- ↑ Boltzmann, L.: «Über die Beziehung zwischen dem zweiten Hauptsatz der mechanischen Wärmetheorie und der Wahrscheinlichkeitsrechnung respektive den Sätzen über das Wärmegleichgewicht», Sitzungsberichte der Kaiserlichen Akademie der Wissenschaften in Wien, Mathematisch-Naturwissenschaftliche Classe. Abt. II, τόμ. 76 (1877), σσ. 373-435. Ανατυπώθηκε στο Wissenschaftliche Abhandlungen, τόμ. II, σσ. 164-223, Barth, Λειψία 1909.
- ↑ McGraw Hill Encyclopaedia of Physics (2η έκδ.), C.B. Parker, 1994
- ↑ Laurendeau, Normand M. (2005). Statistical thermodynamics: fundamentals and applications. Cambridge University Press. σελ. 434. ISBN 0-521-84635-8., Παράρτημα N, σελ. 434
Βιβλιογραφία
[Επεξεργασία | επεξεργασία κώδικα]- L.K. Nash: Elements of Statistical Thermodynamics (2η έκδ.), σειρά Principles of Chemistry, Addison-Wesley, 1974
- A. Shavit & C. Gutfinger: Thermodynamics, From Concepts to Applications (2η έκδ.), CRC Press (Taylor and Francis Group), ΗΠΑ 2009
Εξωτερικοί σύνδεσμοι
[Επεξεργασία | επεξεργασία κώδικα]- «Η κατανομή ταχυτήτων Maxwell» από το Wolfram Demonstrations Project
















































![{\displaystyle {\frac {N_{i}}{N}}={\frac {1}{Z}}\exp \left[-{\frac {p_{i,x}^{2}+p_{i,y}^{2}+p_{i,z}^{2}}{2mkT}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8dc173ee0113a100c4713d64801c5f4d028cff71)
![{\displaystyle f_{\mathbf {p} }(p_{x},p_{y},p_{z})\propto \exp \left[-{\frac {p_{x}^{2}+p_{y}^{2}+p_{z}^{2}}{2mkT}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3712e79fe2355995f5c9ee99a51c83127dff8a0a)
![{\displaystyle \iiint _{-\infty }^{+\infty }\exp \left[-{\frac {p_{x}^{2}+p_{y}^{2}+p_{z}^{2}}{2mkT}}\right]dp_{x}\ dp_{y}\ dp_{z}={({\sqrt {\pi }}{\sqrt {2mkT}})^{3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/70f4955201fb75e0921b1738f340ca8d935c95b6)
![{\displaystyle f_{\mathbf {p} }(p_{x},p_{y},p_{z})=\left(2\pi mkT\right)^{-3/2}\exp \left[-{\frac {p_{x}^{2}+p_{y}^{2}+p_{z}^{2}}{2mkT}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/76fdc75e9040e7fa2bb88d60729f7183c2b1bf1a)












![{\displaystyle f_{\epsilon }(\epsilon )\,d\epsilon ={\sqrt {\frac {1}{\pi \epsilon kT}}}~\exp \left[{\frac {-\epsilon }{kT}}\right]\,d\epsilon }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d0b957722f14b4f35ca02434218927e2ffff4d4)


![{\displaystyle f_{\mathbf {v} }(v_{x},v_{y},v_{z})=\left({\frac {m}{2\pi kT}}\right)^{3/2}\exp \left[-{\frac {m(v_{x}^{2}+v_{y}^{2}+v_{z}^{2})}{2kT}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/efc0617ed7d78e1282e9dffef06398cadf8b74b9)



![{\displaystyle f_{v}(v_{i})={\sqrt {\frac {m}{2\pi kT}}}\exp \left[{\frac {-mv_{i}^{2}}{2kT}}\right].}](https://wikimedia.org/api/rest_v1/media/math/render/svg/86a6d2151bda2079488be11059d0320477fb8eb8)










![{\displaystyle f(v)=\left({\frac {2}{\pi }}\right)^{1/2}\left({\frac {m}{kT}}\right)^{3/2}v^{2}\exp \left[-{\frac {mv^{2}}{2kT}}\right].}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8efeebc81e96ca2166aa4652f1228131ab1eeb66)