Κινολίνη
| Το λήμμα παραθέτει τις πηγές του αόριστα, χωρίς παραπομπές. |
| Κινολίνη | |||
|---|---|---|---|

| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Κινολίνη | ||
| Άλλες ονομασίες | 1-βενζαζίνη, 1-αζαναφθαλίνιο, βενζο[b]πυριδίνη, λευκολίνη | ||
| Χημικά αναγνωριστικά | |||
| Μοριακή μάζα | 129.16 g/mol | ||
| Αριθμός CAS | 91-22-5 | ||
| SMILES | C1=CC=C2C(=C1)C=CC=N2 | ||
| InChI | 1/C9H7N/c1-2-6-9-8(4-1) 5-3-7-10-9/h1-7H | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -15°C (5°F) (258.15 K) | ||
| Σημείο βρασμού | 238°C (460.4°F) (511.15 K) | ||
| Πυκνότητα | 1.093 g/ml | ||
| Διαλυτότητα στο νερό |
Αδιάλυτη (6.1 mg/L) | ||
| Διαλυτότητα σε άλλους διαλύτες |
Διαιθυλαιθέρας αιθανόλη | ||
| Ιξώδες | 3.76 cP | ||
| Δείκτης διάθλασης , nD |
1.625 | ||
| Χημικές ιδιότητες | |||
| pKa | 4.9 | ||
| Σημείο αυτανάφλεξης | 480 °C | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
101.1 °C | ||
| Επικινδυνότητα | |||
| Φράσεις κινδύνου | 40, 41, 45, 20/21/22, 36/37/38, 68, 51/53 | ||
| Φράσεις ασφαλείας | 23, 26, 36, 53, 45, 61 | ||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Η κινολίνη είναι ετεροκυκλική αρωματική οργανική ένωση με μοριακό τύπο C9H7N.
Παρασκευές
[Επεξεργασία | επεξεργασία κώδικα]Η κινολίνη απομονώθηκε από τη λιθανθρακόπισσα για πρώτη φορά το 1834 από τον Φρίντλιμπ Ρούνγκε (Friedlieb Ferdinand Runge). Η λιθανθρακόπισσα εξακολουθεί να παραμένει η σημαντικότερη βιομηχανική πηγή παραγωγής αν και, επειδή δεν υπάρχει ιδιαίτερο εμπορικό ενδιαφέρον, η κινολίνη παρασκευάζεται κυρίως συνθετικά.
Παράγωγα της κινολίνης
[Επεξεργασία | επεξεργασία κώδικα]Παράγωγα της κινολίνης μπορούν να συντεθούν με πολλούς τρόπους με πρώτη ύλη κυρίως ανιλίνη (Ph-NH2) :
- Σύνθεση Combes: Μη-υποκατεστημένη ανιλίνη συμπυκνώνεται με β-δικετόνες με ενδιάμεσο σχηματισμό μιας βάσης του Schiff.
- Σύνθεση Conrad-Limpach: Η ανιλίνη αντιδρά με β-κετοεστέρες οπότε παράγεται 4-υδροξυ-κινολίνη με ενδιάμεσο σχηματισμό βάσης του Schiff.
- Αντίδραση Doebner-Miller, όπου ανιλίνη αντιδρά με α,β-ακόρεστες καρβονυλικές ενώσεις. Έτσι παράγονται 2-υποκατεστημένα παράγωγα κινολίνης. Η μέθοδος είναι γνωστή και ως σύνθεση Skraup-Doebner-Von Miller και αν οι καρβονυλικές ενώσεις παράγονται in situ (με αλδολική συμπύκνωση), ονομάζεται και μέθοδος Beyer.
- Σύνθεση Friedländer, κατά την οποία κετόνες αντιδρούν με 2-αμινο-βενζαλδεΰδη.
- Σύνθεση Camps: Η αντίδραση είναι γνωστή και ως κυκλοποίηση Camps και σ'αυτή η ο-ακυλο-αμινο-ακετοφαινόνη αντιδρά με ιόντα ΟΗ- και μετατρέπεται σε δύο ισομερείς υδροξυ-κινολίνες με τα υδροξύλια σε θέσεις 2- και 4-.
- Αντίδραση Gould-Jacobs: Η ανιλίνη ή κάποιο παράγωγό της πρώτα αντιδρά με μηλονικό οξύ οπότε παράγεται προϊόν από αντικατάσταση της αιθοξυ-ομάδας από άζωτο. Στη συνέχεια με κυκλοποίηση, θέρμανση, υδρόλυση με NaOH και αποκαρβοξυλίωση, προκύπτει τελικά 4-υδροξυ-κινολίνη.
Η σύνθεση Skraup
[Επεξεργασία | επεξεργασία κώδικα]Η κινολίνη παρασκευάζεται κυρίως με τη σύνθεση Skraup : Η ανιλίνη θερμαίνεται με θειικό οξύ, γλυκερόλη και οξειδωτικά μέσα, όπως το νιτροβενζόλιο. Η συνήθως βίαιη αυτή αντίδραση μετριάζεται με την προσθήκη FeSO4.
Το γενικό σχήμα είναι :
Τα επιμέρους στάδια του μηχανισμού είναι :
- Αφυδάτωση της γλυκερόλης (Ι) προς ακρολεΐνη (προπενάλη, ΙΙ)
- Προσθήκη τύπου Michael
- Κλείσιμο του δακτυλίου με προσβολή του ηλεκτρονιόφιλου καρβονυλικού άνθρακα στον αρωματικό δακτύλιο και σε θέση ορθο- ως προς το δότη ηλεκτρονίων -ΝΗ. Η 2οταγής αλκοόλη που σχηματίζεται αφυδατώνεται προς 1,2-διϋδροκινολίνη (ΙΙΙ) με τη βοήθεια του ισχυρού οξέος.
- Το νιτροβενζόλιο (ArNO2) οξειδώνει τη διϋδροκινολίνη προς κινολίνη που είναι αρωματική ένωση. Το ArNO2 ανάγεται προς ανιλίνη (ArNH2), η οποία στη συνέχεια αντιδρά με άλλη ακρολεΐνη.

Το νιτροβενζόλιο συχνά αντικαθίσταται ως οξειδωτικό αντιδραστήριο από το αρσενικικό οξύ, H3As3O4, το οποίο συνήθως δίνει μια λιγότερο έντονη αντίδραση. Μερικές φορές προστίθεται ως καταλύτης πεντοξείδιο του βαναδίου (V2O5). Το θειικό οξύ μπορεί να αντικατασταθεί από φωσφορικό οξύ ή άλλα οξέα.
Φυσικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Είναι υγρό υγροσκοπικό, άχρωμο με έντονη οσμή. Παλιά δείγματα, αν εκτεθούν στο φως, γίνονται πρώτα κίτρινα και μετά καφέ. Η κινολίνης διαλύεται εύκολα σε ζεστό νερό και σε οργανικούς διαλύτες.
Χημικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]- Η κινολίνη έχει βασικές ιδιότητες αφού το Ν έχει ασύζευκτο ζεύγος ηλεκτρονίων.
- Οξειδώνεται από KMnO4 με θέρμανση προς κινολινικό οξύ :
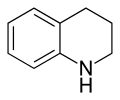
- Υδρογονώνεται καταλυτικά (καταλύτης Ni-Raney) προς 1,2,3,4-τετραϋδροκινολίνη :
- Αντιδρά με ΗΝΟ3 παρουσία Η2SO4 στους 0 °C προς ισομοριακό μίγμα 5-νιτροκινολίνης και 8-νιτροκινολίνης :
- Αντιδρά με NaNH2 ή ΚΝΗ2 δίνοντας μίγμα 2-αμινο- και 4-αμινοκινολίνη. Όπως και η πυριδίνη, έτσι και η κινολίνη υφίσταται πυρηνόφιλη υποκατάσταση στις θέσεις 2- και 4- :
- Αντιδρά με ArLi δίνοντας 2-φαινυλοκινολίνη :
- Βρωμιώνεται με 1 mol Br2 οπότε προκύπτει μίγμα 5- και 8-βρωμοκινολίνης. Ο βενζολικός δακτύλιος είναι δραστικότερος και υφίσταται προσβολή από το ηλεκτρονιόφιλο σε α-θέση :
Χρήσεις
[Επεξεργασία | επεξεργασία κώδικα]Η κινολίνη χρησιμοποιείται κυρίως για την παρασκευή άλλων χημικών ενώσεων και κυρίως της 8-υδροξυ-κινολίνης η οποία αποτελεί χηλικό παράγοντα και χρησιμοποιείται ως φυτοφάρμακο. Αποτελεί επίσης ενδιάμεση ένωση στις μεταλλουργικές διεργασίες και σε βαφές. Το 2-μεθυλο-παράγωγο (κιναλδίνη) και το 4-μεθυλο-παράγωγο (λεπιδίνη) της κινολίνης αποτελούν τις πρόδρομες ενώσεις για τις βαφές κυανίνης. Η οξείδωση της κινολίνης οδηγεί στο σχηματισμό του κινολινικού οξέος που χρησιμοποιείται για την παρασκευή ζιζανιοκτόνων.
Τοξικότητα
[Επεξεργασία | επεξεργασία κώδικα]Η κινολίνη είναι τοξική ένωση. Ακόμα και έκθεση για μικρό χρονικό διάστημα σε ατμούς της, προκαλεί ερεθισμό της μύτης, των ματιών και του λαιμού καθώς και ζάλη και ναυτία. Μακροχρόνιες εκθέσεις σε ατμούς κινολίνης έχουν συνδεθεί με ηπατικές βλάβες και ενδεχομένως καρκινογόνα και μεταλλαξιογόνα αποτελέσματα.
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Morrison R. T., Boyd R. N. "Οργανική Χημεία" Τόμοι 1ος,2ος,3ος, Μετάφραση:Σακαρέλλος-Πηλίδης-Γεροθανάσης, Ιωάννινα 1991.
- Βάρβογλης Α. "Χημεία Οργανικών Ενώσεων", Θεσσαλονίκη 1986.
- Μανωλκίδης Κ., Μπέζας Κ. "Στοιχεία οργανικής χημείας", Έκδοση 13η, Αθήνα 1985.
- Αλεξάνδρου Ν. Ε. "Γενική Οργανική Χημεία, Δομή-Φάσματα-Μηχανισμοί", Τόμοι 1ος και 2ος, Θεσσαλονίκη 1985.
- Κεχαγιόγλου Α. Χ. "Βιομηχανική Οργανική Χημεία", Θεσσαλονίκη 1989.
- Meislich H., Nechamkin H., Sharefkin J. "Οργανική Χημεία", Μετάφραση:Βάρβογλης Α., Αθήνα 1983.
- Ιακώβου Π. "Οργανική Χημεία. Σύγχρονη Θεωρία και Ασκήσεις", Θεσσαλονίκη 1995.
- Βασάλος Ι. Α. "Τεχνολογία Πετρελαίου", Θεσσαλονίκη 1988.
- Βασάλος Ι. Α. "Πετροχημική Τεχνολογία", Θεσσαλονίκη 1988.

![{\displaystyle \mathrm {\xrightarrow[{\Delta }]{KMnO_{4}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/073f8b8de10bf79a6d70268476b7631df067d734)


![{\displaystyle \mathrm {\xrightarrow[{H_{2}SO_{4},\;0^{o}C}]{HNO_{3}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a2c7207e2ec6035aa5fe1365a90f2e15f822e66e)











