Κορτικοστεροειδή

Τα κορτικοστεροειδή ή κορτικοειδή είναι μία τάξη χημικών ενώσεων που περιλαμβάνει τις στεροειδείς ορμόνες που παράγονται με φυσικό τρόπο στον φλοιό των επινεφριδίων του ανθρώπου και γενικά των σπονδυλωτών, καθώς και ανάλογες αυτών των ορμονών που παρασκευάζονται συνθετικά σε εργαστήρια. Τα κορτικοστεροειδή εμπλέκονται σε ένα ευρύ φάσμα φυσιολογικών διεργασιών, όπως την απόκριση στο στρες, στο ανοσοποιητικό σύστημα και στη ρύθμιση των φλεγμονών, τον μεταβολισμό των υδατανθράκων, τον καταβολισμό των πρωτεϊνών, τη ρύθμιση των επιπέδων των ηλεκτρολυτών στο αίμα και τη συμπεριφορά. Διακρίνονται σε δύο κατηγορίες:
- Τα γλυκοκορτικοειδή, όπως η κορτιζόλη, ελέγχουν τον μεταβολισμό των υδατανθράκων, των λιπών και των πρωτεϊνών, ενώ ασκούν αντιφλεγμονώδη δράση αποτρέποντας την απελευθέρωση φωσφολιπιδίων, μειώνοντας τη δράση των ηωσινόφιλων κλπ..
- Τα αλατοκορτικοειδή (mineralcorticoids), όπως η αλδοστερόνη, ελέγχουν τα επίπεδα των ηλεκτρολυτών και του νερού, κυρίως προκαλώντας την κατακράτηση νατρίου στα νεφρά.
Ορισμένες κοινές φυσικές κορτικοειδείς ορμόνες είναι η κορτικοστερόνη, η κορτιζόνη και η αλδοστερόνη.
Βιοσύνθεση
[Επεξεργασία | επεξεργασία κώδικα]
Τα κορτικοειδή συντίθενται από την χοληστερόλη μέσα στον φλοιό των επινεφριδίων. Οι περισσότερες στεροειδογόνες χημικές αντιδράσεις καταλύονται από ένζυμα της οικογένειας του κυτοχρώματος P450. Αυτά εντοπίζονται μέσα στα μιτοχόνδρια και απαιτούν αδρενοδοξίνη ως συμπαράγοντα (εκτός της 21-υδροξυλάσης και της 17α-υδροξυλάσης). Τοπική σύνθεση στεροειδών από τη χοληστερόλη, λαμβάνει χώρα και στον εγκέφαλο. Τα τοπικά παραγόμενα στεροειδή όπως η πρεγνενολόνη και τα παράγωγά της, ονομάζονται νευροστεροειδή αν και ο όρος έχει επεκταθεί σήμερα, για να περιλάβει όλα τα στεροειδή με δράση στο κεντρικό νευρικό σύστημα (ΚΝΣ). Το κύριο γλυκοκορτικοειδές στον άνθρωπο είναι η κορτιζόλη.
Η αλδοστερόνη και η κορτικοστερόνη έχουν κοινό το πρώτο μέρος της βιοσυνθέσεώς τους. Το τελευταίο μέρος καταλύεται από τη συνθάση της αλδοστερόνης για την πρώτη και από την 11β-υδροξυλάση για τη δεύτερη. Αυτά τα ένζυμα είναι σχεδόν ταυτόσημα.
Τα γλυκοκορτικοειδή στο αίμα είναι προσδεμένα σε πρωτεΐνες φορείς τους. Η τρανσκορτίνη (corticosteroid-binding globulin-CBG) είναι η κύρια πρωτεΐνη φορέας τους και λειτουργεί ως μια μικρής χωρητικότητας και υψηλής συγγένειας δεξαμενή, ενώ υπό ορισμένες συνθήκες, η αλβουμίνη στο αίμα μπορεί επίσης να λειτουργήσει ως φορέας με μεγαλύτερη χωρητικότητα και χαμηλότερη συγγένεια από την CBG. Λόγω της λιπιδικής φύσης τους, τα γλυκοκορτικοειδή εξαρτώνται από την CBG για την μεταφορά τους στον εγκέφαλο μέσω της κυκλοφορίας του αίματος. Επιπλέον, η CBG αποτελεί ένα σημαντικό ρυθμιστή για την πρόσβαση και δράση των ορμονών αυτών στον εγκέφαλο. Τα επίπεδα της CBG στο αίμα είναι σχετικά σταθερά, παρόλο που μπορεί να εμφανιστούν κατάτι μειωμένα στις μεγαλύτερες ηλικίες στους ανθρώπους, αλλά παρατηρούνται αξιοσημείωτες διαφορές ανάμεσα στα φύλα (τα θήλεα έχουν υψηλότερα επίπεδα) [1][2].
Υποδοχείς γλυκοκορτικοειδών στον εγκέφαλο
[Επεξεργασία | επεξεργασία κώδικα]Στον εγκέφαλο τα κορτικοστεροειδή προσδένονται με διαφορετική συγγένεια σε δύο τύπους υποδοχέων: τον κλασικό υποδοχέα γλυκοκορτικοειδών (glucocorticoid receptor GR), και τον υποδοχέα αλατοκορτικοειδών (mineralocorticoid receptor, MR). Οι GR και οι MR είναι μέλη της οικογένειας των στεροειδικών υποδοχέων που ανήκουν στην υπεροικογένεια των πυρηνικών υποδοχέων, με πάνω από 150 μέλη σε όλα τα είδη. Μαζί με τους υποδοχείς της προγεστερόνης, των οιστρογόνων και των ανδρογόνων, οι GR και οι MR σχηματίζουν την οικογένεια των υποδοχέων των στεροειδών. Ο GR και ο MR στην μη συνδεμένη με την ορμόνη μορφή τους εντοπίζονται κατά κύριο λόγο στο κυτταρόπλασμα, εν μέρει ως έτερο – ολιγομερή σύμπλοκα που περιέχουν τις πρωτεΐνες 90, 70 και 50 του θερμικού σοκ και πιθανά άλλες πρωτεΐνες [3]. Κάτι το αξιοπερίεργο είναι το ότι οι MR, παρά το όνομά τους, έχουν μεγάλη συγγένεια τόσο για τα αλατοκορτικοειδή όσο και για τα γλυκοκορτικοειδή, ενώ οι GR έχουν περίπου δέκα φορές μικρότερη συγγένεια για τα γλυκοκορτικοειδή από τους MR. Ένα δεύτερο αξιοπερίεργο γεγονός, είναι ότι τόσο οι MR όσο και οι GR, μετά από την πρόσδεση με τους ορμονικούς συνδέτες τους μετακινούνται στον πυρήνα και προσδένονται στην ίδια αλληλουχία του DNA (που συνήθως καλείται στοιχείο απάντησης στα γλυκοκορτικοειδή – glucocorticoid response element: GRE). Παρόλα αυτά υπάρχουν αρκετές ενδείξεις που δείχνουν ότι κάθε τύπος υποδοχέα έχει το δικό του φάσμα δράσης ακόμα και στο ίδιο κύτταρο, καθώς και σε διαφορετικούς ιστούς και φαίνεται ακόμα και σε διαφορετικά μέρη του εγκεφάλου. Στον εγκέφαλο μια από τις διαφορές στις δράσεις των υποδοχέων βασίζεται στη συγκέντρωση των κορτικοστεροειδών. Λόγω της διαφορετικής συγγένειας πρόσδεσης που έχουν, οι MR θα είναι πλήρως κορεσμένοι σε χαμηλές συγκεντρώσεις γλυκοκορτικοειδούς, ενώ οι GR δεσμεύουν τα γλυκοκορτικοειδή όταν αυτά βρίσκονται σε υψηλότερες συγκεντρώσεις, όπως είναι αυτές κατά τη διάρκεια της έκθεσης σε κάποιο φυσιολογικό ή ψυχολογικό στρες [4][5].
Η περιοχή του ιππόκαμπου, που είναι μια κύρια περιοχή - στόχος των κορτικοστεροειδών, διαθέτει τόσο GR όσο και MR υποδοχείς. Οι GR και οι MR συνεντοπίζονται στους πυραμιδικούς νευρώνες CA1 και CA2 (από το Cornu Ammonis) περιοχής και στα κοκκιώδη κύτταρα του οδοντωτού γύρου του ιππόκαμπου, ενώ ανοσοαντιδραστικότητα για τον MR εντοπίζεται και στους πυραμιδικούς νευρώνες CA3 και στους CA4 του ιππόκαμπου. Συνεντόπιση της ανοσοαντιδραστικότητας των GR και των MR παρατηρείται επίσης και στους μικροκυτταρικούς αλλά όχι στους μεγαλοκυτταρικούς νευρώνες του παρακοιλιακού πυρήνα του υποθαλάμου [6][7]. Σε νευρώνες από ιππόκαμπο μελετήθηκε η εντόπιση των ΜR και των GR και παρατηρήθηκε ότι οι ΜR και οι GR είναι μη ομογενώς κατανεμημένοι στον πυρήνα. Και οι δυο υποδοχείς είναι συγκεντρωμένοι σε περίπου 1000 αθροίσματα που είναι διασκορπισμένα στο πυρηνόπλασμα, με μερικά από αυτά τα αθροίσματα να περιέχουν αποκλειστικά είτε ΜR είτε GR, παρότι βρέθηκε ότι ένας σημαντικός αριθμός περιέχει και τους δυο τύπους του υποδοχέα [8].
Γλυκοκορτικοειδή και αναπαραγωγική φυσιολογία
[Επεξεργασία | επεξεργασία κώδικα]Τα γλυκοκορτικοειδή έχουν ανασταλτική επίδραση στην παραγωγή τεστοστερόνης από τα κύτταρα Leydig. Συγκεκριμένα αναστέλουν την βιοσύνθεση της τεστοστερόνης, αναχαιτίζοντας την παραγωγή Δ5 πρεγνενολόνης από χοληστερόλη και των ενζύμων που μετατρέπουν την πρεγνενολόνη και την προγεστερόνη σε ανδογόνα (C-19 στεροειδή), και επάγοντας τον κυτταρικό θάνατο των κυττάρων Leydig. Η αύξηση της ωχρινοτρόπου ορμόνης (LH) και της τεστοστερόνης στο αίμα μειώνουν την οξείδωση της κορτιζόλης σε αδρανή κορτιζόνη από την 11β-HSD, ώστε να δημιουργείται ένας μηχανισμός αρνητικής παλίδρομης ρύθμισης. Σε αντίθεση με ό,τι συμβαίνει στα αρσενικά, τα γλυκοκορτικοειδή σε βασικά επίπεδα έκκρισης προάγουν την αναπαραγωγική δραστηριότητα στα θηλυκά άτομα. Τα γλυκοκορτικοειδή επάγουν την βασική και την επαγόμενη από την εκλυτική ορμόνη των γοναδοτροπινών (GnRH) έκκριση της ωοθυλακιοτρόπου ορμόνης (FSH) για την ωοθυλακική ανάπτυξη. Στις ωοθήκες, στο θυλακικό υγρό, η συγκέντρωση της ελεύθερης κορτιζόλης είναι 10πλάσια από αυτή του πλάσματος και θεωρείται ότι προσφέρει ένα αντιφλεγμονώδες περιβάλλον για το ωοθυλάκιο, το ωχρό σωμάτιο και τη σάλπιγγα στο πρώτο μισό του κύκλου. Αντιθέτως, υψηλά επίπεδα γλυκοκορτικοειδών, όπως για παράδειγμα σε καταστάσεις παρατεταμένου στρες, καταστέλλουν τον άξονα υποθαλάμου-υπόφυσης-γονάδων. Η κορτιζόλη σε υψηλές συγκεντρώσεις καταστέλλει την παραγωγή της GnRH κατά ώσεις, που είναι απαραίτητη για τις κυκλικές διακυμάνσεις της LH και της FSH, μειώνει την ανταπόκριση της αδενοϋπόφυσης στην GnRH και ενισχύει την αρνητική παλίνδρομη ρύθμιση των οιστρογόνων στην έκκριση της GnRH [9]
Ταξινόμηση
[Επεξεργασία | επεξεργασία κώδικα]Κατά τη χημική δομή
[Επεξεργασία | επεξεργασία κώδικα]Γενικά τα κορτικοστεροειδή κατατάσσονται σε 4 τάξεις με βάση τη χημική δομή τους. Αλλεργικές αντιδράσεις σε ένα μέλος μιας από αυτές τις τάξεις συνήθως υποδεικνύουν αλλεργία προς όλα τα μέλη της τάξεως αυτής. Αυτο είναι γνωστό ως «ταξινόμηση Coopman»[10], από το όνομα του S. Coopman, που την όρισε το 1989[11].
Ομάδα A — Τύπου υδροκορτιζόνης
[Επεξεργασία | επεξεργασία κώδικα]Υδροκορτιζόνη, οξική υδροκορτιζόνη, οξική κορτιζόνη, tixocortol pivalate, πρεδνιζολόνη, μεθυλπρεδνιζολόνη και πρεδνιζόνη (γλυκοκορτικοειδή βραχείας προς μέσης δράσεως).
Ομάδα B — Ακετονούχα (και σχετικές ουσίες)
[Επεξεργασία | επεξεργασία κώδικα]Ακετονούχος τριαμκινολόνη, αλκοόλη της τριαμκινολόνης, μομεταζόνη, αμκινονίδη, βουδεσονίδη, δεσονίδη, φλουοκινονίδη, ακετονούχος φλουοκινολόνη και halcinonide.
Ομάδα C — Τύπου βηταμεθαζόνης
[Επεξεργασία | επεξεργασία κώδικα]Βηταμεθαζόνη, φωσφορική νατριοβηταμεθαζόνη, δεξαμεθαζόνη, φωσφορική νατριοδεξαμεθαζόνη και φλουοκορτολόνη.
Ομάδα D — Εστέρες
[Επεξεργασία | επεξεργασία κώδικα]Ομάδα D1 — Αλογονωμένοι
[Επεξεργασία | επεξεργασία κώδικα]17-βαλερική υδροκορτιζόνη, διπροπιονική ακλομεταζόνη, βαλερική βηταμεθαζόνη, διπροπιονική βηταμεθαζόνη, prednicarbate, 17-βουτυρική κλοβηταζόνη, προπιονική κλοβηταζόλη, καπροϊκή φλουοκορτολόνη, fluocortolone pivalate και οξική φλουπρεδνιδένη.
Ομάδα D2
[Επεξεργασία | επεξεργασία κώδικα]17-βουτυρική υδροκορτιζόνη, 17-aceponate, 17-buteprate, and Prednicarbate.
Κατά τον τρόπο χορηγήσεως
[Επεξεργασία | επεξεργασία κώδικα]Τοπική χρήση
[Επεξεργασία | επεξεργασία κώδικα]Για τοπική χρήση στο δέρμα, το μάτι και σε ουλώδη ιστό. Τα τοπικά κορτικοστεροειδή υποδιαιρούνται σε κλάσεις ισχύος από I έως IV.
Εισπνοές
[Επεξεργασία | επεξεργασία κώδικα]Για αντιμετώπιση των βλενογόννων της μύτης, των βρόγχων και των πνευμόνων[12]. Αυτή η ομάδα περιλαμβάνει:
- Flunisolide[13]
- Προπιονική φλουτικασόνη[13]
- Ακετονική τριαμκινολόνη[13]
- διπροπιονική βεκλομεθασόνη[13]
- βουδεσονίδη[13]
Λήψη από το στόμα
[Επεξεργασία | επεξεργασία κώδικα]Τέτοιες ουσίες είναι η πρεδνιζόνη και η πρεδνιζολόνη[14].
Χρήσεις των κορτικοειδών
[Επεξεργασία | επεξεργασία κώδικα]Συνθετικά κορτικοειδή ή ουσίες με παρόμοια δράση χρησιμοποιούνται σε ένα ευρύ φάσμα καταστάσεων, από εγκεφαλικούς όγκους μέχρι δερματικές ασθένειες. Η δεξαμεθαζόνη και τα παράγωγά της είναι σχεδόν καθαρά γλυκοκορτικοειδή, ενώ η πρεδνιζόνη και τα δικά της παράγωγα έχουν και κάποια ορυκτοκορτικοειδή δράση. Η φλουδροκορτιζόνη (Florinef) είναι ένα συνθετικό ορυκτοκορτικοειδές. Η υδροκορτιζόνη (κορτιζόλη) διατίθεται για θεραπεία υποκαταστάσεως, π.χ. σε περιπτώσεις επινεφριδιακής ανεπάρκειας και συγγενούς επινεφριδιακής υπερπλασίας.
Συνθετικά γλυκοκορτικοειδή χρησιμοποιούνται στην αντιμετώπιση πόνων ή φλεγμονών των αρθρώσεων (αρθρίτιδα), temporal arteritis, δερματίτιδας, αλλεργικών αντιδράσεων, άσθματος, ηπατίτιδας, συστηματικού ερυθηματώδους λύκου, ελκώδους κολίτιδας και νόσου του Κρον, σαρκοείδωσης, κ.ά.. Επίσης, για υποκατάσταση γλυκοκορτικοειδών στη νόσο του Άντισον ή άλλες μορφές επινεφριδιακής ανεπάρκειας. Μορφές για τοπική χρήση είναι επίσης διαθέσιμες για το δέρμα, τα μάτια, τους πνεύμονες (άσθμα), τη μύτη (ρινίτιδα) και το έντερο. Τα κορτικοστεροειδή χρησιμοποιούνται και υποστηρικτικά για την πρόληψη της ναυτίας, συχνά σε συνδυασμό με ανταγωνιστές του 5-HT3.
Τυπικές παρενέργειες από τη χρήση γλυκοκορτικοειδών παρουσιάζονται αρκετά ομοιόμορφα ως φαρμακογενές σύνδρομο Cushing. Τυπικές παρενέργειες από τη χρήση ορυκτοκορτικοειδών είναι η αρτηριακή υπέρταση, η υποκαλιαιμία (χαμηλά επίπεδα καλίου στο αίμα) και η υπερνατριαιμία (υψηλά επίπεδα νατρίου στο αίμα). Μπορεί επίσης να παρατηρηθεί κακή επούλωση πληγών ή σχηματισμός έλκους εξαιτίας των ανοσοκατασταλτικών ιδιοτήτων τους.
Κλινικές και πειραματικές ενδείξεις συνηγορούν στο ότι τα κορτικοειδή μπορούν να επιφέρουν μόνιμες οφθαλμικές βλάβες επάγοντας κεντρική ορώδη αμφιβληστροειδοπάθεια (CSR ή CSC). Ποικίλα στεροειδή σκεάσματα, από αντιαλλεργικά σπρέι για τη μύτη μέχρι δερματικές κρέμες και σταγόνες για τα μάτια έχουν ενοχοποιηθεί στην ανάπτυξη CSR[15][16].
Τα κορτικοστεροειδή έχουν χρησιμοποιηθεί πλατιά σε περιπτώσεις τραυματισμού του εγκεφάλου. Μία συστηματική μελέτη με 20 τυχαιοποιημένες δοκιμές και 12.303 συμμετέχοντες συνέκρινε ασθενείς που πήραν κορτικοειδή με ασθενείς που δεν πήραν φάρμακο. Οι συγγραφείς της μελέτης συνέστησαν ότι οι άνθρωποι με τραυματισμό του εγκεφάλου δεν πρέπει να παίρνουν κορτικοειδή στη γενική περίπτωση[17].
Ιστορία
[Επεξεργασία | επεξεργασία κώδικα]Η πρώτη γνωστή χρήση κορτικοστεροειδών έλαβε χώρα το 1944[18]. Οι Ταντέους Ράιχσταϊν, Έντουαρντ Κάλβιν Κένταλ και Φίλιπ Χεντς βραβεύθηκαν με το Βραβείο Νόμπελ Ιατρικής το 1950 για την εργασία τους στις ορμόνες του φλοιού των επινεφριδίων, η οποία κορυφώθηκε με την απομόνωση της κορτιζόνης[19].
Ο Λιούις Σάρετ ήταν ο πρώτος που συνέθεσε κορτιζόνη, με μία πολύπλοκη διαδικασία 36 βημάτων που άρχισε με δεοξυχολικό οξύ το οποίο εξάχθηκε από χολή βοδιού[20]. Η μικρή απόδοση αυτής της μετατροπής είχε ως αποτέλεσμα ένα κόστος 200 δολαρίων το γραμμάριο. Ο Ράσελ Μάρκερ ανεκάλυψε μία πολύ φθηνότερη πρώτη ύλη, τη διοσγενίνη από άγριες μεξικανικές γλυκοπατάτες. Η μετατροπή από αυτόν της διοσγενίνης σε προγεστερόνη με μία διαδικασία 4 βημάτων γνωστή σήμερα ως υποβάθμιση Μάρκερ, υπήρξε ένα σημαντικό βήμα για τη μαζική παραγωγή όλων των στεροειδών ορμονών, μεταξύ των οποίων της κορτιζόνης και των ουσιών που χρησιμοποιούνται στα αντισυλληπτικά χάπια[21]. Το 1952 οι D.H. Peterson και H.C. Murray ανέπτυξαν μία διαδικασία που χρησιμοποιούσε μούχλα του γένους ριζόπους για να οξειδώσει την προγεστερόνη σε μία ουσία που μετατρεπόταν εύκολα σε κορτιζόνη[22]. Η μέθοδος με τις γλυκοπατάτες έφερε την πτώση της τιμής της κορτιζόνης στα 6 δολάριο το γραμμάριο, τιμή που έπεσε στα 46 σεντς ως το 1980. Οι έρευνες του Πέρσυ Τζούλιαν βοήθησαν επίσης στην πρόοδο στο πεδίο αυτό[23]. Η ακριβής φύση της αντιφλεγμονώδους δράσεως των κορτικοειδών παρέμεινε ένα μυστήριο για πολλά χρόνια ακόμα, μέχρι που ο ρόλος της προσκολλήσεως των λευκοκυττάρων και της φωσφολιπάσης Α2 στην παραγωγή προσταγλανδινών και λευκοτριενών κατανοήθηκε πλήρως το 1980-1984.
Παρενέργειες
[Επεξεργασία | επεξεργασία κώδικα]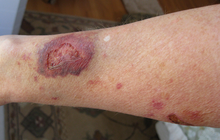
Το σύνδρομο από τη διακοπή λήψεως κορτικοστεροειδών (rebound effect), γνωστό και ως «σύνδρομο του κόκκινου δέρματος», απαντάται συχνά: η πλήρης διακοπή των στεροειδών είναι υποχρεωτική και, παρότι αντιστρεπτή, η κατάσταση αυτή μπορεί να απαιτήσει δύσκολη και μακρά διαδικασία για να παρέλθει[24][25].
Παρενέργειες όπως ο εθισμός με την ανάπτυξη δερματικών βλαβών μπορεί να επισυμβούν με τη λήψη μόλις ενός σωληναρίου 15 γραμμαρίων μέτριας ισχύος στεροειδούς κατά τη διάρκεια ενός ολόκληρου έτους[26].
Η χρήση κορτικοστεροειδών έχει αρκετές βαριές παρενέργειες, όπως: υπεργλυκαιμία[27], αντίσταση στην ινσουλίνη, σακχαρώδη διαβήτη[28], οστεοπόρωση, καταρράκτη, άγχος[29], κατάθλιψη, κολίτιδα, υπέρταση, υπογοναδισμό, υποθυρεοειδισμό, αμηνόρροια και αμφιβληστροειδοπάθεια.
Μολονότι οι αποδείξεις για την πρόκληση πεπτικών ελκών από κορτικοστεροειδή είναι ανεπαρκείς, εκτός από υψηλές δόσεις επί ένα και πλέον μήνα[30], πολλοί ιατροί πιστεύουν ακόμα σε κάτι τέτοιο[31].
Κορτικοειδή και εγκυμοσύνη
[Επεξεργασία | επεξεργασία κώδικα]Τα κορτικοστεροειδή έχουν μία μικρή αλλά όχι ασήμαντη τερατογενετική δράση, που προκαλεί λίγες βλάβες σε έμβρυα ανά 1000 έγκυες γυναίκες που λαμβάνουν τις ουσίες αυτές. Για τον λόγο αυτό τα κορτικοστεροειδή αντενδείκνυνται κατά την εγκυμοσύνη[32].
Ασφάλεια
[Επεξεργασία | επεξεργασία κώδικα]Τα κορτικοστεροειδή ψηφίσθηκαν «αλλεργιογόνο της χρονιάς» το 2005 από την Αμερικανική Contact Dermatitis Society[33].
Δείτε επίσης
[Επεξεργασία | επεξεργασία κώδικα]Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Netherton, C., Goodyer, I., Tamplin, A. and Herbert, J., Salivary cortisol and dehydroepiandrosterone in relation to puberty and gender, Psychoneuroendocrinology, 2004, 29, 125-140.
- ↑ Purnell, J.Q., Brandon, D.D., Isabelle, L.M., Loriaux, D.L. and Samuels, M.H., Association of 24-hour cortisol production rates, cortisol-binding globulin, and plasma-free cortisol levels with body composition, leptin levels, and aging in adult men and women, J Clin Endocrinol Metab, 2004, 89, 281-287.
- ↑ Kino, T. and Chrousos, G.P., Glucocorticoid and mineralocorticoid resistance/hypersensitivity syndromes, J Endocrinol, 2001, 169, 437-445.
- ↑ de Kloet, E.R., Hormones, brain and stress, Endocr Regul, 2003, 37, 51-68
- ↑ Herbert, J., Goodyer, I.M., Grossman, A.B., Hastings, M.H., de Kloet, E.R., Lightman, S.L., Lupien, S.J., Roozendaal, B. and Seckl, J.R., Do corticosteroids damage the brain?, J Neuroendocrinol, 2006, 18, 393-411.
- ↑ Ito, T., Morita, N., Nishi, M. and Kawata, M., In vitro and in vivo immunocytochemistry for the distribution of mineralocorticoid receptor with the use of specific antibody, Neurosci Res, 2000, 37, 173-182.
- ↑ Han, F., Ozawa, H., Matsuda, K., Nishi, M. and Kawata, M., Colocalization of mineralocorticoid receptor and glucocorticoid receptor in the hippocampus and hypothalamus, Neurosci Res, 2005, 51, 371-381.
- ↑ de Kloet, E.R., Van Acker, S.A., Sibug, R.M., Oitzl, M.S., Meijer, O.C., Rahmouni, K. and de Jong, W., Brain mineralocorticoid receptors and centrally regulated functions, Kidney Int, 2000, 57, 1329-1336.
- ↑ Cooke, P.S., Holsberger, D.R., Witorsch, R.J., Sylvester, P.W., Meredith, J.M., Treinen, K.A. and Chapin, R.E., Thyroid hormone, glucocorticoids, and prolactin at the nexus of physiology, reproduction, and toxicology, Toxicol Appl Pharmacol 2004, 194, 309-335.
- ↑ Rietschel, Robert L. (2007). Fisher's Contact Dermatitis, 6/e. Hamilton, Ont: BC Decker Inc. σελ. 256. ISBN 1-55009-378-9.
- ↑ Coopman S, Degreef H, Dooms-Goossens A (July 1989). «Identification of cross-reaction patterns in allergic contact dermatitis from topical corticosteroids». Br. J. Dermatol. 121 (1): 27–34. doi:. PMID 2757954. https://archive.org/details/sim_british-journal-of-dermatology_1989-07_121_1/page/27.
- ↑ http://www.webmd.com/asthma/guide/asthma_control_with_anti-inflammatory-drugs
- ↑ 13,0 13,1 13,2 13,3 13,4 Frieden, Thomas R. (Μάρτιος 2004). «Inhaled Corticosteroids — Long-Term Control Asthma medicine» (PDF). New York City Asthma Initiative. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 23 Απριλίου 2010. Ανακτήθηκε στις 19 Οκτωβρίου 2012.
- ↑ http://dermnetnz.org/treatments/systemic-steroids.html
- ↑ Carvalho-Recchia, CA; Yannuzzi, LA; Negrão, S; Spaide, RF; Freund, KB; Rodriguez-Coleman, H; Lenharo, M; Iida, T (2002). «Corticosteroids and central serous chorioretinopathy». Ophthalmology 109 (10): 1834–7. doi:. PMID 12359603. https://archive.org/details/sim_ophthalmology_2002-10_109_10/page/1834.
- ↑ «Αρχειοθετημένο αντίγραφο». Αρχειοθετήθηκε από το πρωτότυπο στις 24 Ιουλίου 2012. Ανακτήθηκε στις 19 Οκτωβρίου 2012.
- ↑
- ↑ Webster. «First therapeutic use of Corticosteroid». Ανακτήθηκε στις 30 Ιουλίου 2012.
- ↑ http://nobelprize.org/nobel_prizes/medicine/laureates/1950/kendall-lecture.pdf Αρχειοθετήθηκε 2017-04-15 στο Wayback Machine..
- ↑ Sarett, Lewis H. (1947). “Process of Treating Pregnene Compounds”, U.S. Patent 2,462,133
- ↑ Marker, Russell E.; Wagner, R. B.; Ulshafer, Paul R.; Wittbecker, Emerson L.; Goldsmith, Dale P. J.; Ruof, Clarence H. (1947). «Steroidal Sapogenins». J. Am. Chem. Soc. 69 (9): 2167. doi:. PMID 20262743.
- ↑ Peterson D.H., Murray, H.C. (1952). «Microbiological Oxygenation of Steroids at Carbon 11». J. Am. Chem. Soc. 74 (7): 1871–2. doi:.
- ↑ Julian, Percy L., Cole, John Wayne, Meyer, Edwin W., and Karpel, William J. (1956) “Preparation of Cortisone”. U. S. Patent 2,752,339
- ↑ Mototsugu Fukaya MD (2010). «Steroid Addiction 2010».
- ↑ Marvin J. Rapaport and Vicki Rapaport (2006). «The red skin syndromes: corticosteroid addiction and withdrawal» (PDF). Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 17 Μαρτίου 2012. Ανακτήθηκε στις 19 Οκτωβρίου 2012.
- ↑ Kenneth P Fowler and David J Elpern (2001). «"Tortured tube" sign».
- ↑ Donihi AC, Raval D, Saul M, Korytkowski MT, DeVita MA (2006). «Prevalence and predictors of corticosteroid-related hyperglycemia in hospitalized patients». Endocr Pract 12 (4): 358–62. PMID 16901792.
- ↑ Blackburn D, Hux J, Mamdani M (2007). «Quantification of the risk of corticosteroid-induced diabetes mellitus among the elderly». Journal of General Internal Medicine 17 (9): 1525–1497. doi:.
- ↑ Korte SM (2001). «Corticosteroids in relation to fear, anxiety and psychopathology». Neurosci Biobehav Rev 25 (2): 117–42. doi:. PMID 11323078. https://archive.org/details/sim_neuroscience-and-biobehavioral-reviews_2001_25_2/page/117.
- ↑ Pecora PG, Kaplan B (1996). «Corticosteroids and ulcers: is there an association?». Ann Pharmacother 30 (7–8): 870–2. PMID 8826575.
- ↑ Martínek J, Hlavova K, Zavada F, et al. (June 2010). «"A surviving myth" — corticosteroids are still considered ulcerogenic by a majority of physicians». Scand J Gastroenterol 45 (10): 1156–61. doi:. PMID 20569095.
- ↑ Shepard, TH.; Brent, RL.; Friedman, JM.; Jones, KL.; Miller, RK.; Moore, CA.; Polifka, JE. (April 2002). «Update on new developments in the study of human teratogens». Teratology 65 (4): 153–61. doi:. PMID 11948561.
- ↑ http://www.medscape.com/viewarticle/505245