Λευκίνη
| Λευκίνη | |
|---|---|
| |

| |
| Γενικά | |
| Όνομα IUPAC | 2-αμινο-4-μεθυλοπεντανικό οξύ |
| Άλλες ονομασίες | Λευκίνη |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C6H13NO2 |
| Μοριακή μάζα | 131,17 amu |
| Σύντομος συντακτικός τύπος |
(CH3)2CHCH2CH(NH2)COOH |
| Συντομογραφίες | leu, L |
| Αριθμός CAS | 61-90-5 |
| SMILES | CC(C)CC(N)C(=O)O |
| InChI | 1S/C6H13NO2/c1-4(2)3-5(7)6(8)9/h4-5H,3,7H2,1-2H3,(H,8,9)/t5-/m0/s1 Y |
| Αριθμός EINECS | 200-773-6 |
| Αριθμός UN | GMW67QNF9C |
| PubChem CID | 6106 |
| ChemSpider ID | 5880 |
| Κωδικός προσθέτου τροφίμων |
E641 |
| Ισομέρεια | |
| Ισομερή θέσης | >175 |
| Οπτικά ισομερή | 2 |
| Φυσικές ιδιότητες | |
| Διαλυτότητα στο νερό |
διαλυτή |
| Εμφάνιση | λευκό κρυσταλλικό στερεό |
| Χημικές ιδιότητες | |
| pKa | 2,36 (-COOH) 9,60 (-NH2) |
| pI | 5,98[1] |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
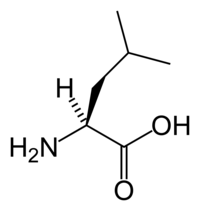
Η λευκίνη ή 2-αμινο-4-μεθυλοπεντανικό οξύ (συμβολίζεται με Leu ή L)[2] είναι ένα α-αμινοξύ με σύντομο συντακτικό τύπο (CH3)2CHCH2CH(NH2)COOH. Η L-λευκίνη είναι ένα από τα πρωτεϊνογόνα αμινοξέα. Οι τριπλέτες της είναι: UUA, UUG, CUU, CUC, CUA και CUG. Ανήκει στα απαραίτητα αμινοξέα, δηλαδή σε αυτά που δεν μπορεί να βιοσυνθέσει ο ανθρώπινος οργανισμός και πρέπει να λαμβάνονται έτοιμα, με την τροφή. Επειδή το τμήμα του μορίου της από το #2 άτομο άνθρακα και μετά [R = (CH3)2CHCH2-, δηλαδή ισοβουτύλιο] είναι ένα αλκύλιο, ταξινομείται στα «υδρόφοβα» αμινοξέα.[3] Είναι ένα σημαντικό συστατικό υπομονάδων της φερριτίνης, της αστακίνης και άλλων αμυντικών και μεταφορικών πρωτεϊνών.
Πίνακας τροφίμων που περιέχουν λευκίνη
[Επεξεργασία | επεξεργασία κώδικα]| Τρόφιμο | g/100g |
|---|---|
| πρωτεΐνες σόγιας | 4,917 |
| φυστίκια | 1,672 |
| ψύχα σίτου | 1,571 |
| αμύγδαλα | 1,488 |
| βρώμη | 1,284 |
| φασόλια (μαγειρευμένα) | 0,765 |
| φακές (μαγειρευμένες) | 0,654 |
| ρεβίθια (μαγειρευμένα) | 0,631 |
| αραβόσιτος (κίτρινος) | 0,348 |
| ρύζι (καφέ, μαγειρευμένο) | 0,191 |
Ισομέρεια
[Επεξεργασία | επεξεργασία κώδικα]Με βάση το χημικό τύπο της, C6H13NO2, έχει πολλά ισομερή θέσης, τα σημαντικότερα από τα οποία είναι τα ακόλουθα αμινοξέα:
Δομή
[Επεξεργασία | επεξεργασία κώδικα]| Δεσμοί[5] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C#1'-C#4 | σ | 2sp3-2sp3 | 154 pm | |
| C#5-C#4 | σ | 2sp3-2sp3 | 154 pm | |
| C#4-C#3 | σ | 2sp3-2sp3 | 154 pm | |
| C#3-C#2 | σ | 2sp3-2sp3 | 154 pm | |
| C#2-C#1 | σ | 2sp3-2sp2 | 151 pm | |
| C-N | σ | 2sp3-2sp3 | 152 pm | 6% C+ Ν- |
| Ν-H | σ | 2sp3-1s | 101,7 pm | 17% N- H+ |
| C=O | σ | 2sp2-2sp2 | 132 pm | 19% C+ O- |
| π | 2p-2p | |||
| C-O | σ | 2sp2-2sp3 | 147 pm | 19% C+ O- |
| O-H | σ | 2sp3-1s | 96 pm | 32% O- H+ |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| -O | -0,51 | |||
| -N | -0,40 | |||
| =O | -0,38 | |||
| C#1' | -0,09 | |||
| C#5 | -0,09 | |||
| C#3 | -0,06 | |||
| C#4 | -0,03 | |||
| C#2 | +0,03 | |||
| H(CH) | +0,03 | |||
| H(NH2) | +0,17 | |||
| H(OH) | +0,32 | |||
| C#1 | +0,57 | |||
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Βιοσύνθεση
[Επεξεργασία | επεξεργασία κώδικα]Ως ένα βασικό αμινοξύ, η λευκίνη δεν μπορεί να συνθεθεί από τα ζώα, και γι' αυτό πρέπει να προσλαμβάνεται έτοιμη με την τροφή, συνήθως ως συνστατικό των πρωτεϊνών. Μπορεί όμως να βιοσυνθεθεί από τα φυτά και από μικροοργανισμούς, μέσω αρκετών σταδίων, αρχίζοντας από το πυροσταφυλικό οξύ. Το αρχικό τμήμα της πορείας αυτής είναι κοινό με το αντίστοιχο της βαλίνης. Το ενδιάμεσο α-κετοβαλερικό οξύ, μετατρέπεται σε α-ισοπροπυλομηλικό οξύ και μετά σε β-ισοπροπυλομηλικό οξύ, που αφυδρογονώνεται σε α-κετοϊσοκαπρικό οξύ που τελικά δίνει τη λευκίνη με αναγωγική αμμωνίωση (δείτε παρακάτω). Τα ένζυμα που εμπλέκονται στην τυπική βιοσύνθεση της λευκίνης είναι τα ακόλουθα[6][7]:
- Ακετογαλακτική συνθετάση.
- Ισομεραναγωγάση των ακετοϋδροξυοξέων.
- Αφυδατάση των διυδροξυοξέων.
- α-Ισοπροπυλομηλική συνθετάση.
- α-Ισοπροπυλομηλική ισομεράση.
- Αμινοτρανσφεράση της λευκίνης.
Άλλες μέθοδοι
[Επεξεργασία | επεξεργασία κώδικα]Μέσω αλογόνωσης 4-μεθυλοπεντανικού οξέος
[Επεξεργασία | επεξεργασία κώδικα]Ρακεμικό μίγμα λευκίνης μπορεί να παραχθεί μέσω αλογόνωσης του 4-μεθυλοπεντανικού οξέος:
1. Το α-αλοξύ που προκύπτει έτσι, επιδράται με αμμωνία[8]:
2. Μέσω οργανομαγνησιακών ενώσεων και αλαμίνης με εστεροποίηση για «προστασία»[9] της καρβοξυλομάδας[10]:
3. Με φθαλιμιδικό κάλιο (σύνθεση Gabriel)[11]:
Αντίδραση Stracker
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση υδροκυανίου (HCN) και αμμωνίας (NH3) σε 3-μεθυλοβουτανάλη [(CH3)2CHCH2CHO)[12]:
Με αναγωγική αμμωνίωση του αντίστοιχου κετοξέος
[Επεξεργασία | επεξεργασία κώδικα]Με αναγωγική αμμωνίωση 4-μεθυλο-2-οξοπεντανικού οξέος[13]::
Με αναγωγή του αντίστοιχου νιτροξέος
[Επεξεργασία | επεξεργασία κώδικα]Από 4-μεθυλο-2-νιτροπεντανικό οξύ με αναγωγή[14]:
- Το 4-μεθυλο-2-νιτροπεντανικό οξύ παράγεται από το αντίστοιχο α-αλοπροπανικό οξύ:
Από ισοβουτυλομηλονικό οξύ
[Επεξεργασία | επεξεργασία κώδικα]Από ισοβουτπυλομηλονικό οξύ με μετροπή σε μονοαμίδιο και αποικοδόμηση-μετάθεση Hofmann[15]:
Από το αντίστοιχο αμινονιτρίλιο
[Επεξεργασία | επεξεργασία κώδικα]Από 2-αμινο-4-μεθυλοπεντανονιτρίλιο με υδρόλυση:
- To 2-αμινο-4-μεθυλοπεντανονιτρίλιο παράγεται από 3-μεθυλοβουτανάλη με επίδραση χλωριούχου αμμωνίου και κυανιούχου νατρίου[16]
Χημικές ιδιότητες και παράγωγα
[Επεξεργασία | επεξεργασία κώδικα]Αμφολυτική αυμπεριφορά
[Επεξεργασία | επεξεργασία κώδικα]1. Η πιο χαρακτηριστική είναι η αμφολυτική διάστασή της:
- Η κεντρική πάνω κατάσταση ισχύει για αδιάλυτη (ή διαλυτή σε απρωτικούς διαλύτες) αλανίνη.
- Σε υδατικά διαλύματα:
- Για pH<pK1 ιονίζεται η αμινομάδα (δεξιά).
- Για pH=pI ιονίζονται και η αμινομάδα και η καρβοξυλομάδα (κέντρο κάτω).
- Για pH>pK2 ιονίζεται μόνο η καρβοξυλομάδα (αριστερά).
2. Παραγωγή αλάτων με οξέα και βάσεις. Π.χ.:
και
Εστεροποίηση
[Επεξεργασία | επεξεργασία κώδικα]Αντιδρά με αλκοόλες σχηματίζοντας αμινεστέρες. Αποτελεί και μέθοδο «προστασίας»[17] της καρβοξυλομάδας.
Αλκυλίωση
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση αλκυλοαλογονιδίων σχηματίζονται δευτεροταγή αμινοξέα:
Ακυλίωση
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση ακυλοαλογονιδίων σχηματίζονται δευτεροταγή αμιδοξέα. Αποτελεί και μέθοδο «προστασίας»[17] της αμινομάδας, αφού τα αμίδια υδρολύονται.
Απαζώτωση
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση νιτρώδους οξέος πρακτικά αντικαθίστανται η αμινομάδα με υδροξυλομάδα. Παράγεται 4-μεθυλο-2-υδροξυπεντανικό οξύ:
Βιοχημεία
[Επεξεργασία | επεξεργασία κώδικα]Η λευκίνη χρησιμοποιείται στο ήπαρ, στο λιπώδη ιστό και στο μυϊκό ιστό. Στο λιπώδη ιστό και στους μύες η λευκίνη χρησιμοποιείται για το σχηματισμό των στερολών και η συνδυασμένη χρήση από τους δυο αυτούς ιστούς είναι μεγαλύτερη από την αντίστοιχη του ήπατος.[18].
Η λευκίνη είναι το μόνο διατροφικό αμινοξύ που έχει τη δυνατότητα να τονώσει τη μυϊκή σύνθεση πρωτεϊνών[19]. Ως συμπλήρωμα διατροφής, η λευκίνη έχει χρησιμοποιηθεί για να επιβραδύνει την υποβάθμιση του μυϊκού ιστού, αυξάνοντας τη σύνθεση των πρωτεϊνών των μυών σε υπέργηρους επίμυες[20].
Η τοξικότητα (από υπερκατανάλωση) της λευκίνης, όπως φαίνεται στην αποσταθεροποιημένη «ασθένεια ούρων με οσμή σιροπιού σφενδαμιού» Maple Syrup Urine Disease (MSUD), προκαλεί αρχικά ντελίριο και νευρολογική βλάβη, και μπορεί να φθάσει να απειλήσει και τη ίδια την ανθρώπινη ζωή.
Στη γενετική του ζυμομύκητα, μεταλλάγματα με ένα ελαττωματικό γονίδιο για τη σύνθεση λευκίνης (leu2) μετασχηματίζονται με ένα πλασμίδιο που περιέχει ένα λειτουργικό γονίδιο σύνθεσης λευκίνης (LEU2) και καλλιεργούνται σε μη εμπλουτισμένο θρεπτικό υλικό. Η σύνθεση της λευκίνης γίνεται τότε ένας χρήσιμος επιλέξιμος δείκτης του μετασχηματισμού.
Αναφορές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Προκύπτει ως μέσος όρος των pKa (βλέπε οξύτητα).
- ↑ Nomenclature and symbolism for amino acids and peptides (IUPAC-IUB Recommendations 1983)", Pure Appl. Chem. 56 (5): 595–624, 1984, doi:10.1351/pac198456050595.
- ↑ J. M. Berg· J. L. Tymoczko· G. J. Gatto· L. Stryer (2015). Βιοχημεία. Πανεπιστημιακές Εκδόσεις Κρήτης. σελ. 33.[νεκρός σύνδεσμος]
- ↑ National Nutrient Database for Standard Reference. U.S. Department of Agriculture. Αρχειοθετήθηκε από το πρωτότυπο στις 3 Μαρτίου 2015. Ανακτήθηκε στις 16 Σεπτεμβρίου 2009..
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Nelson, D. L.; Cox, M. M. "Lehninger, Principles of Biochemistry" 3rd Ed. Worth Publishing: New York, 2000. ISBN 1-57259-153-6.
- ↑ Παρατηρήστε ότι τα τρία (3) πρώτα είναι τα ίδια και στη βιοσύνθεση της βαλίνης
- ↑ Marvel, C. S. (1940), "dl-Valine", Org. Synth. 20: 106, http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=CV3P0848 Αρχειοθετήθηκε 2011-01-15 στο Wayback Machine. ; Coll. Vol. 3: 848. Γενίκευση για περισσότερα αλογόνα.
- ↑ Προσωρινή κάλυψη χαρακτηριστικής ομάδας για την αποφυγή παραγωγής ανεπιθύμητων παραπροϊόντων.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 298, §13.3Α1, σελ. 243, §10.2B4 και σελ. 301. §13.4.αII.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 329, §14.2.1.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 329, §14.2.2.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 329, §14.2.3.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 243, §10.2B2α.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 298, §13.3Α1, σελ. 296, §13.2Αα, §13.2Γ1, σελ. 243, §10.2B3 και σελ. 301. §13.4.αII.
- ↑ Σύνθεση Streckel
- ↑ 17,0 17,1 Προστασία ονομάζεται η προσωρινή δέσμευση μιας χαρακτηριστικής ενεργής ομάδας, ώστε αυτή να μη δώσει ανεπιθύμητες αντιδράσεις και παράγωγα με την επίδραση αντιδραστηρίων που σκοπεύουμε να χρησιμοποιήσουμε πάνω στην ένωση με σκοπό να αξιοποιήσουμε μια άλλη ομάδα και να πάρουμε τα επιθυμητά αποτελέσματα-παράγωγα. Μετά απελευθερώνουμε ή αποπροστατεύουμε την αρχική ομάδα, δηλαδή φροντίζουμε να απομακρυνθεί η ομάδα που την προστάτεψε προσωρινά.
- ↑ J. Rosenthal, et al. Department of Medicine, University of Toronto, Toronto, Canada. «Metabolic fate of leucine: A significant sterol precursor in adipose tissue and muscle». American Journal of Physiology Vol. 226, No. 2, p. 411-418. Αρχειοθετήθηκε από το πρωτότυπο στις 21 Νοεμβρίου 2008. Ανακτήθηκε στις 25 Μαρτίου 2008.
- ↑ Etzel MR (2004). «Manufacture and use of dairy protein fractions». The Journal of Nutrition 134 (4): 996S–1002S. PMID 15051860. http://jn.nutrition.org/content/134/4/996S.long.
- ↑ L. Combaret, et al. Human Nutrition Research Centre of Clermont-Ferrand. «A leucine-supplemented diet restores the defective postprandial inhibition of proteasome-dependent proteolysis in aged rat skeletal muscle». Journal of Physiology Volume 569, issue 2, p. 489-499. Αρχειοθετήθηκε από το πρωτότυπο στις 16 Μαΐου 2008. Ανακτήθηκε στις 25 Μαρτίου 2008.
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999.
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982.


![{\displaystyle \mathrm {(CH_{3})_{2}CHCH_{2}CHXCOOH+ROH{\stackrel {-H_{2}O}{\overrightarrow {\longleftarrow }}}(CH_{3})_{2}CHCH_{2}CHXCOOR{\xrightarrow[{|Et_{2}O|}]{+Mg}}(CH_{3})_{2}CHCH_{2}CH(MgX)COOR{\xrightarrow[{-MgX_{2}}]{+NH_{2}X}}(CH_{3})_{2}CHCH_{2}CH(NH_{2})COOR{\stackrel {+H_{2}O}{\overrightarrow {\longleftarrow }}}(CH_{3})_{2}CHCH_{2}CH(NH_{2})COOH+ROH} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7506e47c11096d6de612e98d29960a47e37f2584)

![{\displaystyle \mathrm {+(CH_{3})_{2}CHCH_{2}CHXCOOH{\xrightarrow[{+2H_{2}O}]{-KBr}}(CH_{3})_{2}CHCH_{2}CH(NH_{2})COOH+} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/3acd29cd01c7b01652dcf5a214b97bafab4ccb4c)


![{\displaystyle \mathrm {(CH_{3})_{2}CHCH_{2}COCOOH+2NH_{3}{\xrightarrow {-H_{2}O}}(CH_{3})_{2}CHCH_{2}C(=NH)COONH_{4}{\xrightarrow[{Ni}]{+H_{2}}}(CH_{3})_{2}CHCH_{2}CH(NH_{2})COONH_{4}{\xrightarrow {+HCl}}(CH_{3})_{2}CHCH_{2}CH(NH_{2})COOH+NH_{4}Cl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cf3d002f4af158d48eb06bf8d06c4ec044e2d67a)


![{\displaystyle \mathrm {HOOCCH[CH_{2}CH(CH_{3})_{2}]COOH+ROH{\xrightarrow {}}HOOCCH[CH_{2}CH(CH_{3})_{2}]COOR+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/86b7da6d8ed61662450f724f0af823c8e7f91334)
![{\displaystyle \mathrm {HOOCCH[CH_{2}CH(CH_{3})_{2}]COOR+SOCl_{2}{\xrightarrow {}}ClOCCH[CH_{2}CH(CH_{3})_{2}]COOR+SO_{2}+HCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ea5366c7dd034c7bebd890d7ede3ec167ba40141)
![{\displaystyle \mathrm {ClOCCH[CH_{2}CH(CH_{3})_{2}]COOR+NH_{3}{\xrightarrow {}}H_{2}NOCCH[CH_{2}CH(CH_{3})_{2}]COOR+HCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/5d0844c26aee3be42a494b365c09794d17277d8f)
![{\displaystyle \mathrm {H_{2}NOCCH[CH_{2}CH(CH_{3})_{2}]COOR+KBrO{\xrightarrow {}}(CH_{3})_{2}CHCH_{2}CH(NH_{2})COOR+KBr+CO_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/bf5826cb543242c341b1dfce06527cfc967c771e)







![{\displaystyle \mathrm {(CH_{3})_{2}CHCH_{2}CH(NH_{2})COOH+RX{\xrightarrow {}}RNHCH[CH_{2}CH(CH_{3})_{2}]COOH+HX} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ea6e29f2974dd6eae31dc10d523af64a8d23a680)
![{\displaystyle \mathrm {(CH_{3})_{2}CHCH_{2}CH(NH_{2})COOH+RCOX{\xrightarrow {}}RCONHCH[CH_{2}CH(CH_{3})_{2}]COOH+HX} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7e78daceb4a1042d08f59268cdb30dc80c105f0)
