Μονοξείδιο του διβρωμίου
| Μονοξείδιο του διβρωμίου | |||
|---|---|---|---|
| |||
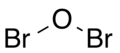
| |||
| Γενικά | |||
| Όνομα IUPAC | Μονοξείδιο του διβρωμίου | ||
| Άλλες ονομασίες | Βρωμυποβρωμιώδες Διβρωμιούχο οξυγόνο Οξείδιο του διβρωμίου Υποβρωμιώδες βρώμιο Ανυδρίτης του υποβρωμιώδους οξέος | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | Br2O | ||
| Μοριακή μάζα | 175,807 amu | ||
| Αριθμός CAS | 21308-80-5 | ||
| SMILES | O(Br)Br | ||
| InChI | 1S/Br2O/c1-3-2 | ||
| PubChem CID | 4513628 | ||
| ChemSpider ID | 10686917 | ||
| Δομή | |||
| Μήκος δεσμού | 185 pm | ||
| Είδος δεσμού | Πολωμένος ομοιοπολικός | ||
| Γωνία δεσμού | 112° | ||
| Μοριακή γεωμετρία | Γωνιακή | ||
| Φυσικές ιδιότητες | |||
| Χημικές ιδιότητες | |||
| Αυτοδιάσπαση | −17.5 °C | ||
| Επικινδυνότητα | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το μονοξείδιο του διβρωμίου[1] (αγγλ. dibromine monoxide) είναι ανόργανη δυαδική χημική ένωση με μοριακό τύπο Br2O. Είναι ένα σκούρο καφέ στερεό, που είναι σταθερό κάτω από τους −40 °C, που χρησιμοποιήθηκε σε αντιδράσεις βρωμίωσης.[2] Είναι παρόμοιο με το μονοξείδιο του διχλωρίου.
Δομή
[Επεξεργασία | επεξεργασία κώδικα]Η μοριακή γεωμετρία του μονοξειδίου του διβρωμίου είναι γωνιακή, με μοριακή συμμετρία C2V, όπως οι αντίστοιχες του νερού και του υποβρωμιώδους οξέος, εξαιτίας των δύο (2) μονήρων ζευγών ηλεκτρονίων του ατόμου του οξυγόνου. Η δεσμική γωνία είναι ελαφρώς μεγαλύτερη από το κανονικό, εξαιτίας της στερεοχημικής απώθησης μεταξύ των (σχετικά) ογκωδών ατόμων βρωμίου.
| Δεσμοί[3][4][5][6] | |||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός | Ισχύς δεσμού |
|---|---|---|---|---|---|
| O-Br | σ | 2sp³-4p | 185,0 pm | 5,6% Br+ O– | 201 kJ/mol |
| Γωνίες | |||||
| BrOBr | 112° | ||||
| Στατιστικό ηλεκτρικό φορτίο[7] | |||||
| O | -0,112 | ||||
| Br | +0,056 | ||||
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Το μονοξείδιο του διβρωμίου μπορεί να παρασκευαστεί με επίδραση ατμού (στοιχειακού) βρωμίου ή διαλύματος (στοιχειακού) βρωμίου σε τετραχλωράνθρακα (CCl4) σε οξείδιο του υδραργύρου (HgO), σε χαμηλές θερμοκρασίες:[2][6]
Μπορεί επίσης να σχηματιστεί με θερμική αποσύνθεση διοξειδίου του βρωμίου (BrO2)[5] ή με διέλευση ηλεκτρικού ρεύματος μέσω αερίου μείγματος βρωμίου και οξυγόνου, σε αναλογία 1:5:[6]
Χημικές αντιδράσεις
[Επεξεργασία | επεξεργασία κώδικα]Αντιδρά με το (στοιχειακό) ιώδιο, σχηματίζοντας πεντοξείδιο του ιωδίου (I2O5):
Αντιδρά με υδροξείδιο του νατρίου, σχηματίζοντας υποβρωμιώδες νάτριο NaOBr:
Δείτε επίσης
[Επεξεργασία | επεξεργασία κώδικα]Αναφορές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Για εναλλακτικές ονομασίες και συμβολισμούς δείτε τον πίνακα πληροφοριών.
- ↑ 2,0 2,1 Perry, Dale L.; Phillips, Sidney L. (1995), Handbook of Inorganic Compounds, CRC Press, σελ. 74, ISBN 0-8493-8671-3, https://books.google.com/books?id=0fT4wfhF1AsC&q=%22Bromine+dioxide%22&pg=PA74, ανακτήθηκε στις 25 August 2015
- ↑ Τα δεδομένα προέρχονται από τους πίνακες δεδομένων των στοιχείων άνθρακα, πυριτίου και υδρογόνου και τις πηγές«Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και «Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982»
- ↑ «chem.tamu.edu» (PDF). Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 28 Ιανουαρίου 2018.
- ↑ 5,0 5,1 Levason, William; Ogden, J. Steven; Spicer, Mark D.; Young, Nigel A. (January 1990). «Characterization of dibromine monoxide (Br2O) by bromine K-edge EXAFS and IR spectroscopy». Journal of the American Chemical Society 112 (3): 1019–1022. doi:.
- ↑ 6,0 6,1 6,2 Wiberg, Egon (2001). Wiberg, Nils, επιμ. Inorganic chemistry (1st έκδοση). San Diego, Calif.: Academic Press. σελ. 464. ISBN 9780123526519.
- ↑ Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα




